基于代谢组学研究雷公藤甲素诱导HepaRG 细胞损伤的机制
2020-04-29周玲玲朱华旭周学平
邢 琦,谢 彤,冯 哲,周玲玲,朱华旭,周学平
(南京中医药大学,江苏 南京 210023)
雷公藤甲素(triptolide,TP)是从雷公藤Tripterygium wilfordiiHook.f.中分离得到的环氧二萜内酯化合物,为其主要活性成分,具有抗炎、免疫调节、抗生殖和促凋亡等多种药理活性[1]。但该成分在临床使用中表现出了明显的毒副作用,尤以肝毒性常见[2]。
近年来有研究表明,雷公藤甲素肝毒性在细胞水平表现明显。姚金成等[3]观察了雷公藤甲素对正常人肝细胞株L-02 的作用和对肝CYP3A、CYP2E1 蛋白表达的影响,发现随着雷公藤甲素浓度提高和孵育时间延长,L-02 细胞受损程度加重,CYP3A 蛋白的表达受到抑制,而CYP2E1 蛋白表达增加,推测雷公藤甲素引起肝细胞毒性的机制与影响CYP450 酶系有关;尹亮等[4]探讨了雷公藤甲素对人肝癌细胞HepG2 的作用和分子机制,结果显示雷公藤甲素在体内外能诱导HepG2 细胞的凋亡,其机制可能与抑制HSP70 蛋白表达,增强caspase 级联反应相关;刘春晖等[5]进一步研究了雷公藤甲素对HepG2 细胞的损伤作用,发现在肝毒性剂量下,雷公藤甲素能降低细胞中过氧化指标SOD、GSH-Px 酶的活力,引起自噬相关蛋白LC3Ⅱ、Beclin1 表达增高,推测损伤机制可能为过氧化损伤和氧化应激诱发了过度的自噬。
代谢组学是一门研究内源性小分子代谢物变化规律的新兴科学,随着其深入发展,该技术在细胞水平的研究中展现出独特的优势。细胞代谢组学以细胞中具有高敏感性和高特异性的生物标志物为切入口,探索疾病发生、中药毒性和中药治疗作用的机制。本实验基于GC-MS 代谢组学技术检测雷公藤甲素干预不同时间后HepaRG 肝细胞内代谢物的变化,筛选出雷公藤甲素致肝细胞损伤的生物标志物,从代谢通路的角度初步探索雷公藤甲素对肝细胞的毒性作用机制。
1 材料
1.1 细胞株 HepaRG 人源肝癌细胞购自上海纪宁实业有限公司,保存于南京中医药大学江苏省儿童呼吸疾病(中医药)重点实验室。
1.2 药物与试剂 雷公藤甲素(批号150602)购自成都普菲德生物技术有限公司;1,2-13C-肉豆蔻酸(批号SH2326B)、N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA)(批号BCBW2670)、吡啶(批号 SHBJ7548)、甲氧胺盐酸盐(批号BCBW2927)购自美国Sigma-Aldrich 公司;正己烷(批号4A6004)购自美国ROE Scientific 公司;甲醇(批号10994607906)购自德国Merck 公司;RPMI-1640 培养基(批号8118167)、胎牛血清(批号42F5091K)、胰蛋白酶(批号2053591)购自美国Gibco 公司;甲基噻唑蓝(MTT)(批号EZ3455C328)购自德国Biofroxx 公司;青链霉素混合液(批号20181110)、二甲基亚砜(DMSO)(批号1029B0313)购自北京索莱宝科技有限公司;磷酸盐缓冲液(PBS)(批号AD24464280)购自美国HyClone 公司。
1.3 仪器 AS 1310 自动进样器、Trace 1310 气相色谱仪、TG-5MS 气相色谱柱(30 m×0.25 mm,0.25 μm)、TSQ 8000 质谱仪、Savant SPD 1010 SpeedVac 真空浓缩仪(美国Thermo Fisher 公司);Allegra 64R 高速冷冻离心机(美国 Beckman Coulter 公司);Vortex-Genie 2 涡旋振荡器(美国Scientific Industries 公司);Infinite M200 PRO 多功能酶标仪(瑞士Tecan 公司);MCO-20AZC 型CO2培养箱、超低温冰箱(日本Sanyo 公司)。
2 方法
2.1 MTT 法测定HepaRG 细胞存活率 使用1640完全培养基培养HepaRG 细胞,于37 ℃、5% CO2培养箱中培养。选择处于对数生长期,生长状态良好的HepaRG 细胞,分为空白组、DMSO 组(1%DMSO)、雷公藤甲素组(2、0.4、0.08、0.016、0.0032 μg/mL),每组设6 个复孔,细胞浓度为6×104/mL,接种于96 孔板中,每孔加入180 μL 细胞悬液,约12 h 后细胞贴壁,加入药物分别处理12、24、48 h,每孔加入0.5% MTT 20 μL 继续培养,4 h 后弃上清液,每孔加入DMSO 150 μL。将96 孔板置于摇床上振荡10 min,镜下观察结晶完全溶解后,于490 nm 波长酶标仪上测定各孔光密度值(OD),存活率= [OD给药组/OD空白组]×100%。重复3 次。
2.2 样本收集 选择处于对数生长期、生长状态良好的HepaRG 细胞进行实验,分为空白组、雷公藤甲素组(0.4 μg/mL),细胞浓度为5×105/mL,接种于6 孔板中,每孔加入1.8 mL 细胞悬液,约12 h 后细胞贴壁,雷公藤甲素组加入雷公藤甲素溶液200 μL(终质量浓度0.4 μg/mL),空白组加入1640 培养基溶液200 μL,分别处理12、24、48 h,PBS 冲洗2 次后迅速加入约3 mL 液氮进行淬灭,待液氮挥发后,加入300 μL 纯水收集样本,于-80 ℃冰箱中保存。
2.3 样本前处理及衍生化 上述细胞经过-80 ℃冷冻60 min、37 ℃融化30 min 的3 次冻融循环后,涡旋30 s 以保证细胞分离。经离心浓缩仪挥干后加入450 μL 甲醇(含内标1,2-13C-肉豆蔻酸12.5 μg/mL),涡旋5 min 后离心(15 000 r/min)10 min,取400 μL 上清挥干。加入30 μL 甲氧胺吡啶溶液(10 mg/mL),涡旋5 min 后振荡1.5 h(30 ℃,350 r/min),再加入30 μL BSTFA 溶液,涡旋5 min 后振荡30 min(37 ℃,350 r/min),离心(4 ℃、18 000 r/min)10 min 后取50 μL 上清进样。
2.4 GC-MS 分析条件
2.4.1 色谱条件 TG-5MS 气相色谱柱(0.25 mm×30 m,0.25 μm);载气氦气,体积流量1.2 mL/min;采用分流模式,分流比20∶1;进样量1 μL,进样口温度250 ℃;起始温度为60 ℃,保持1 min,以20 ℃/min 升高至320 ℃,保持5 min。
2.4.2 质谱条件 离子源为EI 电子源,电离能量70 eV;离子源温度300 ℃;传输线温度300 ℃;质谱扫描范围m/z50~500;采集时间3.8~19 min。
2.5 数据处理及统计分析 运用GC-MS 技术采集图谱信息,并导入MS-DIAL 软件和NIST 数据库中提取色谱峰及鉴定物质,得到代谢物名称、组别、峰高的三维数据信息,以VIP >1.0、P<0.05 为条件,筛选雷公藤甲素致肝细胞损伤的生物标志物。将三维数据信息导入SIMCA-P 13.0 软件进行主成分分析(PCA)和偏最小二乘法判别分析(PLSDA),建立PLS-DA 模型时应用置换检验来判断模型是否发生过度拟合现象,避免监督性模型获得结果的偶然性,通过多次随机改变分类变量Y的排列顺序(n=200)建立模型以获取随机模型的R2和Q2值,Q2回归直线与Y 轴的截距小于0,说明所建模型稳定性较好。使用PLS-DA 模型计算HepaRG 细胞样本中各变量的变量投影重要性(VIP)值,根据VIP>1.0 筛选不同时间点空白组和雷公藤甲素组之间的差异性代谢物。数据进行归一化、log 转化和Pareto 校准后进行单因素方差分析,根据P<0.05 筛选差异性代谢物,选取同时满足VIP>1.0、P<0.05 的代谢物作为生物标志物,经Metaboanalyst 4.0 网站(http://www.metaboanalyst.ca/)对数据进行代谢通路分析。
3 结果
3.1 雷公藤甲素对HepaRG 细胞存活率的影响 与空白组比较,随着雷公藤甲素质量浓度增加、作用时间延长,HepaRG 细胞存活率出现明显的下降趋势;2、0.4 μg/mL 雷公藤甲素处 理HepaRG细胞12、24、48 h,细胞存活率均下降(P<0.01),见图1。后续实验选择0.4 μg/mL 雷公藤甲素进行研究。
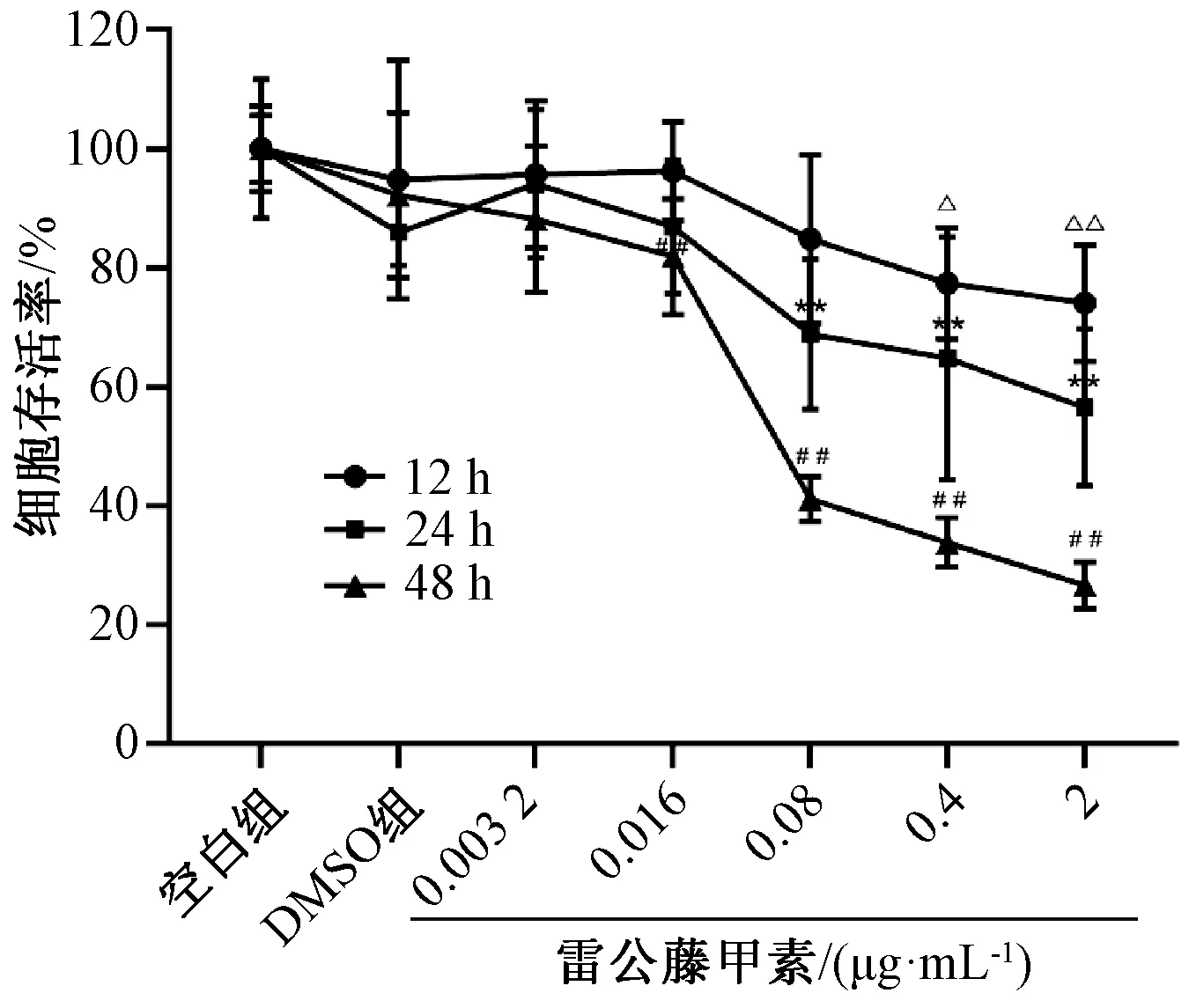
图1 雷公藤甲素对HepaRG 细胞存活率的影响Fig.1 Effect of triptolide on survival rate of HepaRG cells
3.2 GC-MS 分析 HepaRG 细胞总离子流图(图2)显示,空白组和雷公藤甲素干预不同时间的HepaRG 细胞存在较多的色谱峰差异,提示细胞内部分代谢物的含有量发生了变化。
通过MS-DIAL 软件和NIST 数据库提取色谱峰及鉴定物质,根据代谢物名称、组别、峰高等信息鉴定得到104 种代谢物,包括苏氨酸、丝氨酸、异亮氨酸等氨基酸类,甘油酸、硬脂酸、棕榈酸等脂肪酸类,麦芽糖、核糖、塔格糖等糖类,广泛涉及氨基酸代谢通路、脂质代谢通路和糖代谢通路等。
3.3 代谢轮廓分析及差异代谢物的鉴定 将数据导入SIMCA-P 13.0 软件构建PCA 模型,模型的得分图见图3A,R2X=0.69,Q2=0.495,说明所建模型能够反映HepaRG 细胞的代谢轮廓。在PCA 得分图上可以看出,干预不同时间点的雷公藤甲素组细胞样本可以和空白组明显分开。其中空白组、雷公藤甲素组12 h 细胞基本能够和其他组别完全区分,空白组24、48 h 与雷公藤甲素组24、48 h细胞大部分重合,表明这2 个时间点间给予相同剂量雷公藤甲素后,细胞代谢物差异较小。在SIMCA-P 13.0 软件中构建PLS-DA 模型,得分图见图3B,模型参数R2X=0.661,R2Y=0.643,Q2=0.427;置换检验结果见图3C,Q2回归直线的纵截距为-0.281,说明所建模型不存在过拟合现象,能较好地反映细胞代谢轮廓。在PLS-DA 得分图上可以看出,不同时间点雷公藤甲素组和空白组的样本区分明显,干预12、24、48 h 时代表细胞的点在图中呈现同向移动的变化趋势,说明雷公藤甲素处理HepaRG 细胞12 h 后,细胞内源性代谢物已经产生显著变化,而且随时间延长而逐渐增大。
图2 不同时间空白组和雷公藤甲素组的TIC 色谱图Fig.2 TIC chromatograms of the control groups and the triptolide groups at different time
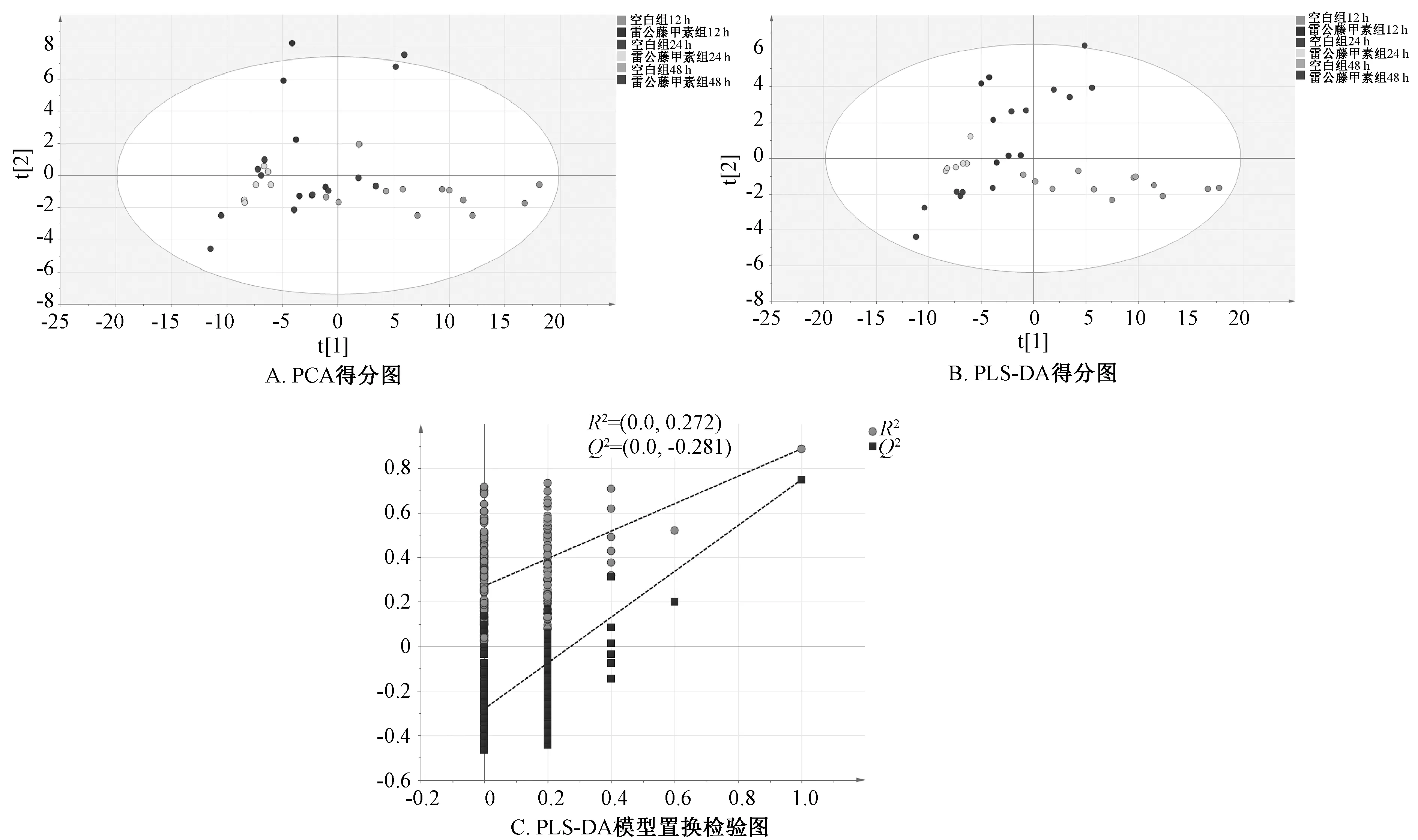
图3 各组HepaRG 细胞的代谢轮廓分析Fig.3 Analysis of metabolic profiles for HepaRG cells in each group
使用上述PLS-DA 模型计算HepaRG 细胞样本中各变量的VIP 值,以VIP >1.0 和单因素方差分析P<0.05 为条件鉴定差异代谢物。如表1 所示,共鉴定出26 个显著性差异代谢物,包括氨基酸类、糖类、脂类等小分子物质;与空白组相比,雷公藤甲素处理HepaRG 细胞12 h 后大部分代谢物(如棕榈油酸、苹果酸、氨基丙二酸等)出现明显改变,处理24、48 h 后部分代谢物(如泛酸、赖氨酸、丝氨酸等)水平降低。对上述代谢物数据归一化后聚类分析,所得热图见图4,各组细胞样本中代谢物的相对水平和变化趋势见图5。
3.4 代谢通路分析 将上述鉴定得到的显著性差异代谢物导入MetaboAnalyst 4.0 网站(http://www.metaboanalyst.ca/)中进行代谢通路分析,以影响值大于0.1 为条件,筛选得到11 条可能涉及的代谢通路,见图6。图中圆点越大的通路,对代谢通路的重要性越大。
4 讨论
近年来随着雷公藤甲素在临床的广泛应用,其不良反应受到重视,其中雷公藤甲素诱导肝毒性的机制复杂,仍有待进一步深入研究。本研究运用了基于GC-MS 的代谢组学技术,建立了具有区分度和预测性的PCA 和PLS-DA 模型,对不同时间点的空白组和雷公藤甲素组HepaRG 肝细胞进行区分及预测,筛选出26 个显著性差异代谢物,涉及11条代谢通路。
4.1 雷公藤甲素通过影响氨基酸代谢通路扰乱肝细胞基本生命活动 氨基酸是生命活动的基本物质,肝脏是机体内进行氨基酸代谢的主要场所。在氨基酸代谢途径中,肝脏损伤导致氨基酸代谢紊乱,肝细胞内的氨基酸合成减少。其中天冬氨酸在相关酶的催化作用下参与机体新陈代谢,缓解三羧酸循环中草酰乙酸、苹果酸等中间产物的缺失,促进三羧酸循环的正常运行及ATP 的产生[6],同时天冬氨酸在酶的作用下转化为天冬酰胺,是机体合成脂肪酸的碳源之一。雷公藤甲素能明显降低HepaRG 细胞中天冬氨酸水平,减少细胞能量供应,进一步加重肝损害。细胞可从甘氨酸合成丝氨酸,并且丝氨酸在细胞代谢中发挥重要作用,产生一碳单位,参与嘧啶与嘌呤合成、免疫球蛋白合成和脂肪酸代谢等,促进细胞的正常增殖与生长[7],故丝氨酸水平下降时,可能从多个方面诱导肝细胞的损伤。氨基酸在氨基酰-tRNA 合成酶的催化下,与相对应的tRNA 精确结合生成氨基酰-tRNA,为蛋白质的生物合成提供必需原料[8]。雷公藤甲素减少细胞内氨基酸的合成时,氨基酰-tRNA 生物合成也受到影响,可直接抑制细胞营养物质蛋白质的生成,从而抑制细胞的生命活动。
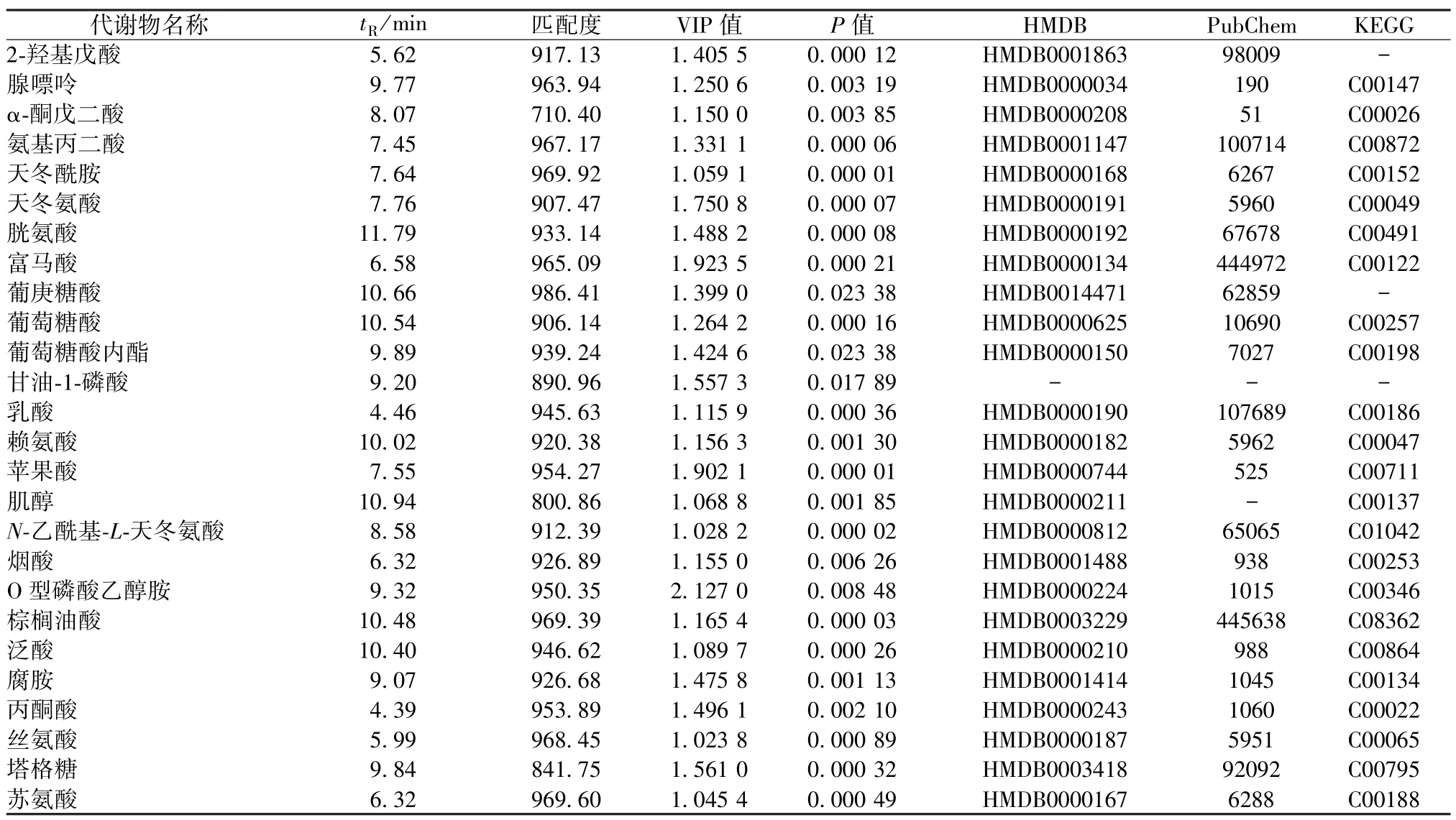
表1 雷公藤甲素干预HepaRG 细胞的潜在生物标志物Tab.1 Potential biomarkers of triptolide intervention in HepaRG cells

图4 生物标志物热图Fig.4 Biomarker heatmap

图5 各组HepaRG 细胞代谢物的相对水平Fig.5 Relative levels of metabolites in HepaRG cells of each group
4.2 雷公藤甲素通过改变糖代谢通路干扰肝细胞能量代谢过程 柠檬酸循环又称为三羧酸循环,既是三大营养物质(糖类、脂肪、蛋白质)代谢的共同最终通路,又是它们相互联系的重要枢纽[9],Chen 等[10]认为,雷公藤损伤细胞线粒体,阻碍了三羧酸循环,使其上游和下游的能量代谢不一致。本研究中鉴定出的三羧酸循环相关代谢物主要有苹果酸和丙酮酸,雷公藤甲素干预后细胞中两者含有量减少,低于空白组细胞。苹果酸水平的减少致其脱氢后生成的进入下一循环的草酰乙酸减少,同时葡萄糖的分解也随之降低;丙酮酸是三羧酸循环中重要的中间产物,在相关酶的作用下转化为乙酰辅酶A 和草酰乙酸,从而参与能量代谢过程,雷公藤甲素可能通过影响中间代谢产物破坏三羧酸循环的稳定,对细胞产生了伤害。此外,烟酸可在机体内转化为烟酰胺,后者作为辅酶NADH 和NADPH的重要前体,是三羧酸循环必不可少的电子转运蛋白[11]。Wang 等[12]发现,雷公藤甲素的毒性作用改变机体泛酸代谢途径,泛酸是三羧酸循环等途径的中间产物之一,可在机体内转化为辅酶A,后者是机体内多种酶的辅助因子。本实验观察到,烟酸和泛酸含有量降低也表明能量代谢受损。
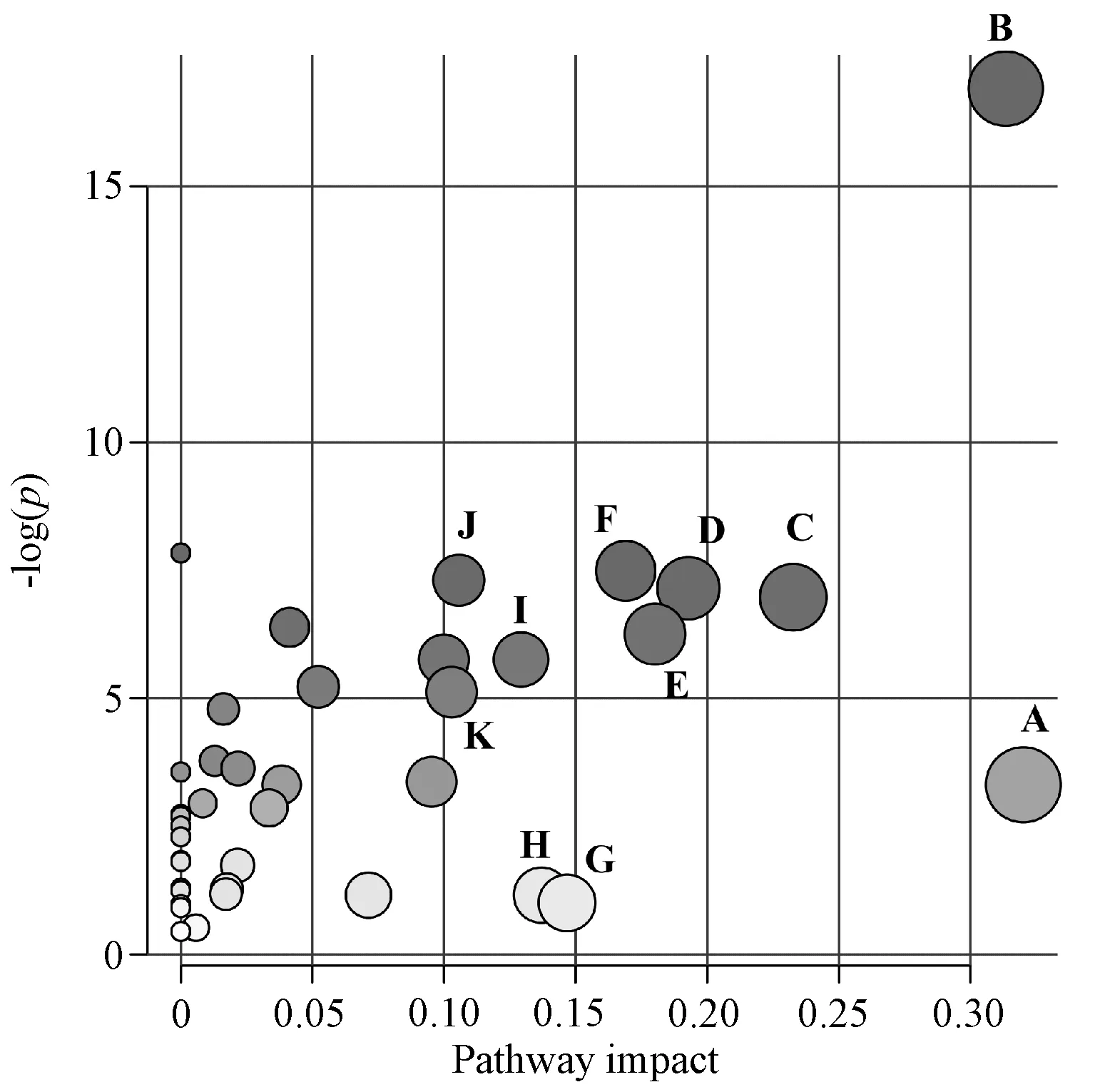
图6 雷公藤甲素干预HepaRG 细胞的代谢通路分析Fig.6 Analysis of metabolic pathway of HepaRG cells under triptolide intervention
4.3 雷公藤甲素通过干预脂类代谢通路加剧肝细胞氧化损伤 脂质在肝脏代谢中具有关键作用。Xie 等[13]发现,长期使用雷公藤会导致肝脏脂质稳态失衡,从而造成肝脏损伤。本实验结果显示,雷公藤甲素干预后不饱和脂肪酸(如棕榈油酸等)水平显著下降,可能是由于肝细胞受损时在氧化应激过程中产生活性氧(ROS),后者促使肝细胞膜不饱和脂肪酸发生脂质过氧化,使其水平减少。丁酸是短链脂肪酸的一种,丁酸钠(NaBu)是其钠盐,能改善细胞的氧化应激状态,抑制炎性因子表达[14-15],雷公藤甲素改变细胞内丁酸代谢,影响NaBu 对机体氧化损伤的保护作用,从而加剧肝脏损伤。肌醇能被磷酸化生成磷脂酰肌醇,细胞中后者在相应酶的作用下生成多种衍生物,直接参与多种细胞活动过程,包括膜泡运输、离子转运、信号转导、细胞凋亡等,雷公藤甲素对细胞造成损伤后可破坏磷脂代谢途径,妨碍细胞活动。
综上所述,本研究初步探讨了雷公藤甲素对肝细胞HepaRG 的毒性作用机制,通过代谢组学技术揭示该成分引起肝细胞毒性的主要因素可能与氨基酸代谢、糖代谢和脂类代谢相关,可为其在临床上安全有效的应用提供参考。
