倾向性评分匹配分析口咽癌PD-L1的表达与HPV感染及预后的相关性研究
2020-04-29高立明朱莹莹师晓华陈兴明
高立明,朱莹莹,师晓华,陈兴明*
(中国医学科学院 北京协和医学院 北京协和医院 1.耳鼻咽喉科;2.病理科,北京100730)
口咽癌为头颈部常见恶性肿瘤之一,90%以上为鳞状细胞癌[1]。人乳头状瘤病毒(human papillomavirus,HPV)感染已成为除吸烟和饮酒外口咽癌的又一重要致病因素[2]。全球每年约有32%的口咽癌(主要包括扁桃体癌及舌根癌)由HPV感染导致[3]。欧美国家相关研究发现HPV阳性的口咽癌患者其临床预后较HPV阴性者更好[2,4]。同时,最新的临床试验表明,HPV阳性和HPV阴性头颈部鳞癌患者对免疫治疗的反应存在差异[5,6],提示HPV阳性及HPV阴性头颈肿瘤的免疫逃避机制可能不同。然而,程序性细胞死亡配体1(programmed death ligand 1,PD-L1)在口咽癌中的临床意义尚不明确。本研究旨在探讨PD-L1在口咽癌中的表达情况,分析其与HPV感染状态及临床预后的相关性。
1 资料与方法
1.1 一般资料
收集2008-2014年我院收治的确诊为口咽鳞癌(原发灶为扁桃体或舌根)患者的临床资料,纳入50例HPV阳性的口咽癌患者,使用倾向性评分匹配(Propensity score matching,PSM)方法1∶1匹配纳入50例HPV阴性口咽癌患者,所有患者按照2010年美国癌症联合委员会(AJCC)指定的TNM分级标准确定TNM分期。所有患者进行超过5年的长期随访或直至出现死亡。
1.2 PD-L1免疫荧光染色
采用常规方法制备5 μm厚的石蜡切片,进行免疫荧光染色,EDTA缓冲液中进行微波抗原修复,PD-L1一抗4℃过夜孵化,洗涤后孵育荧光标记二抗,DAPI复染,荧光防淬灭剂封片后荧光显微镜观察染色并照相记录。膜性表达PD-L1的肿瘤细胞占所有肿瘤细胞的比例≥ 5%定义为PD-L1阳性。
1.3 统计学方法
本研究采用1∶1的比例运用PSM方法对50例HPV阳性口咽癌患者进行匹配,匹配因素包括年龄、性别、吸烟、肿瘤、原发灶、治疗方式及分期。所有二分类变量用χ2检验(或Fisher精确检验)分析;有序分类变量用 Mann-Whitney 秩和检验分析。运用 Kaplan-Meier 法进行总生存率(overall survival,OS) 及疾病特异性生存率 (disease-specific survival,DSS)单因素分析,采用Cox比例风险模型进行多因素分析。以上所有分析均使用SPSS 22.0进行,均为双侧检验,P<0.05为差异有统计学意义。
2 结果
100例口咽癌患者的年龄、性别、吸烟、饮酒、合并症、分化程度、分期及治疗方法等临床资料见表1,两组各匹配因素无明显统计学差异。
随访时间为13-113个月,中位随访时间在HPV阳性组和HPV阴性组分别为67个月和47.5个月。随访期间共有53例患者死亡,45例患者死于口咽癌。HPV阳性组及HPV阴性组5年总生存率分别为66%和40%(P=0.003),5年疾病特异生存率分别为73% 和44%(P=0.001),两组间差异具有统计学意义。采用COX多因素回归分析,结果显示,HPV阳性(HR=0.32,95% CI 0.18-0.58,P<0.001)、吸烟(HR=2.50,95% CI 1.27-4.91,P=0.008)、存在合并症(HR=2.08,95% CI 1.07-4.01,P=0.032)及分化程度高(HR=0.26,95% CI 0.13-0.55,P<0.001)为口咽癌总生存率独立预后因素,疾病特异生存率结果类似,但存在合并症不再具有统计学意义(见表2)。
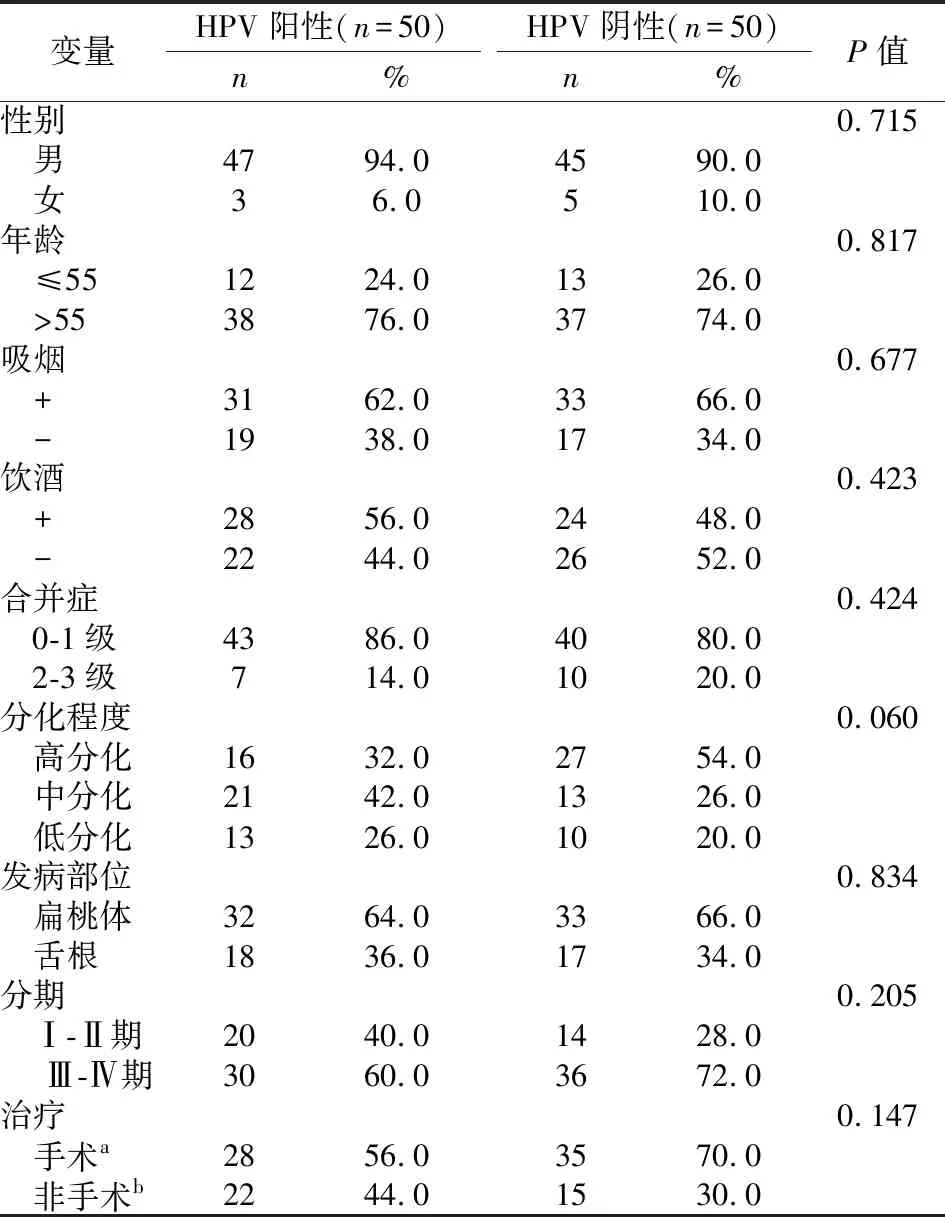
表1 100例口咽癌患者的临床资料
缩写:HPV,人乳头状瘤病毒a手术治疗,包括手术,手术+放疗,手术+放化疗;b非手术治疗,包括放疗和化疗

表2 口咽癌相关预后因素单因素与多因素分析
缩写: HPV,人乳头状瘤病毒;CI,可信区间;HR,风险比;OS,总生存率;DSS,疾病特异性生存率
HPV阳性口咽癌组织中PD-L1阳性率为70%(35/50),显著高于HPV阴性口咽癌患者的42%(21/50)(P=0.005)。PD-L1阳性表达者多见于年轻患者(P=0.020),而与其他临床病理特征包括性别、吸烟、饮酒、肿瘤原发部位、肿瘤分期及分化程度无明显相关性。PD-L1阳性为改善口咽癌患者总生存率和疾病特异性生存率的独立预后因素(DSS,P<0.001;OS,P<0.001)(见图1A)。
为进一步分析HPV阳性口咽癌患者与HPV阴性患者中PD-L1表达的相关预后差异,我们将其进行分组。结果提示,HPV+/PD-L1+患者较 HPV+/PD-L1-者(DSS,P<0.001;OS,P=0.004),HPV-/PD-L1+者(DSS,P=0.010;OS,P=0.047) 以及HPV-/PD-L1-者(DSS,P<0.001;OS,P<0.001)具有显著的预后优势(见图1B)。

图1 口咽癌患者A) PD-L1;B) HPV/PD-L1 总生存率的Kaplan-Meier曲线
3 讨论
HPV感染为口咽癌的重要致病因素之一,全球约31%的口咽癌由HPV感染导致[7]。HPV阳性口咽癌较HPV阴性口咽癌通常分期较晚,分化较差[8,9]。2010年新英格兰医学杂志上报道了RTOG0129临床试验的部分研究结果,发现HPV阳性口咽癌患者预后明显较HPV阴性口咽癌患者预后要好,3年生存率分别为62.4%(95% CI,77.2-87.6)和57.1% (95% CI,48.1-66.1)[4]。此后,越来越多的研究提示HPV阳性口咽癌患者预后明显改善。本研究通过倾向性评分匹配,纳入50对HPV阳性及HPV阴性口咽癌患者,进一步证实了在中国人群中,HPV阳性为口咽癌良好预后的独立因素(HR=0.32,95% CI 0.18-0.58,P<0.001)。
然而,HPV阳性口咽癌预后较好的机制尚不明确。部分学者将 HPV 阳性肿瘤预后较好归因于对放化疗的敏感性增强[10,11]。然而,单纯手术的 HPV阳性肿瘤患者较分期相当的HPV阴性患者的预后仍有所改善[12]。Williams等发现表达E6/E7蛋白的HPV阳性肿瘤细胞在免疫活性小鼠中的增殖速度显著落后于 HPV 阴性肿瘤,但同样的实验结果在免疫缺失的裸鼠体内却未被发现,据此推测 HPV 阳性肿瘤较好的临床预后可能与机体的适应性免疫相关[13]。免疫治疗,尤其是针对PD-1/PD-L1的免疫检查点抑制剂在多种肿瘤(例如肺癌、黑色素瘤、肾癌、膀胱癌、结肠癌等)治疗中展现出良好前景,在头颈部鳞癌中亦取得了不错的疗效。需要注意的是,仅小部分患者表现出持久疗效。Checkmate 141[14]等临床研究发现头颈癌PD-L1阳性者接受PD-1抑制剂nivolumab治疗后疗效更好。因此有必要进行针对我国人群口咽癌患者进行PD-L1表达水平的检测,以为HPV阳性患者更好的临床预后提供理论基础,同时为PD-1/PD-L1应用于头颈肿瘤提供基线数据。
口咽癌PD-L1的表达与HPV感染的相关性尚不明确。部分研究报道PD-L1的表达与HPV感染无明显相关性[15,16],而另外一些研究发现PD-L1在HPV阳性头颈肿瘤中表达率更高[17]。本研究发现口咽癌PD-L1的表达与HPV感染状态存在显著性相关。HPV阳性口咽癌组织中PD-L1阳性率(70%)显著高于HPV阴性口咽癌患者的42%(P=0.005)。这些矛盾结果可能部分归因于分析方法缺乏统一性,包括观察者之间的免疫组织学检测的变异性、缺乏确定PD-L1表达情况的标准化抗体以及定义阳性表达的各种临界值不同。同时,肿瘤细胞中PD-L1的表达在疾病的不同阶段可能发生动态变化,检测结果可能受活检时间的影响。而且肿瘤具有异质性,同一病灶的不同位置,不同病灶之间PD-L1的表达可能是不同的。
PD-L1作为免疫检查点配体,与细胞毒性T细胞上的PD-1结合后可造成其功能耗竭,从而协助肿瘤细胞逃避免疫监视。既往研究发现,在多种肿瘤中PD-L1的过表达与远处转移及不良预后相关,其中包括肾癌、皮肤癌、肺癌和胰腺癌等[18-26]。在头颈肿瘤中,PD-L1过表达与头颈肿瘤的预后关系尚无一致性结果[17,27-29]。本研究结果提示,PD-L1阳性为改善总生存率和疾病特异性生存率的独立预后因素(DSS,P<0.001;OS,P<0.001)。同时,HPV+/PD-L1+患者较 HPV+/PD-L1-者(DSS,P<0.001;OS,P=0.004),HPV-/PD-L1+者(DSS,P=0.010;OS,P=0.047) 以及HPV-/PD-L1-者(DSS,P<0.001;OS,P<0.001)具有显著的预后优势。这种矛盾和不一致性可能与以下原因有关:(1)病毒相关肿瘤由病毒相关癌蛋白致癌,通常肿瘤突变负荷呈低度或中度。病毒感染后出现相关新抗原,可能引起更强的免疫反应,多种病毒相关肿瘤表现为较强的免疫应答及PD-L1过表达[30,31];(2)肿瘤特异性抗原和肿瘤相关抗原激活免疫系统后,肿瘤细胞PD-L1表达上调,PD-L1表达可能代表先前的内源性抗肿瘤免疫反应,该反应减速但未能完全阻止肿瘤生长,可以使用PD-1/PD-L1抑制剂使之恢复活力[32];(3)有研究提示PD-L1过表达机制不同,包括动态IFNγ或癌基因激活[33,34],前者IFNγ升高导致的PD-L1过表达为获得性免疫的一部分,通常与免疫细胞浸润相关,表现为局限性过表达[35];癌基因激活相关的PD-L1过表达通常缺少淋巴细胞浸润而呈弥漫性过表达[34,36]。不同机制导致的PD-L1过表达可能与免疫检查点抑制剂疗效不同相关。
总之,本研究结果证实HPV阳性口咽癌较HPV阴性口咽癌患者预后明显改善。PD-L1在HPV阳性口咽癌患者表达程度更高,为口咽癌的良好独立预后因素,HPV阳性口咽癌患者较好的预后可能与不同的免疫微环境有关。
