下龙湾地区根际土壤可培养原核微生物多样性研究
2020-04-28孟晓林丁辰龙明红单金峰吴春聂国兴
孟晓林,丁辰龙,明红,单金峰,吴春,聂国兴*
(1.河南师范大学 水产学院,河南 新乡 453007;2.江苏省农业科学研究院 宿迁农科所,江苏 宿迁 223800;3.新乡医学院 生命科学技术学院合成生物学医药研究所,河南 新乡 453003)
近年来,土壤微生物多样性研究已成为生物多样性研究的重要领域[1]。有研究显示,普通土壤中每克包含至少1010个细菌[2],物种接近6 000~50 000个[3,4]。而在有机质土壤中存在的生物种类、数量更是惊人,其中细菌数量每克包含1012个,原生动物数量每克包含104个,线虫数量每克包含104个[5]。因此,土壤中含有大量的微生物物种多样性及丰富度信息,其群落构成、生物量变化情况及所含酶活性是评价土壤生态系统恢复、系统管理及健康状况的关键指标[6]。其中,以基因、物种、种群和群落作为评价土壤微生物多样性的4个不同层面[7]。
国内外研究表明,植物根际与根系土壤微生物的生命活动对土壤形状、植物对养分的利用与吸收、植物的生长都有明显影响[8],根际土壤微生物类群与植物的健康状况也有一定的关系[9]。根际土壤微生物在调解土壤肥力、改善生态环境、促进植物根系生长和防治植物病虫害等方面均有一定的作用[10~14]。通过从根际环境样品中筛选具有抗菌、抑菌和降解作用的有益菌来改善生态环境,日益为人们所重视。丁浩等[15]以人工芦苇湿地为研究对象,对不同时期湿地芦苇根际及非根际微生物群落结构和优势菌群的变化进行了研究,结果表明芦苇湿地根际优势微生物除了芽孢杆菌(Bacillus)之外,还包括假单胞菌(Pseudomonadaceae)、气单胞菌(Aeromonas),它们在湿地系统污水处理过程中可能发挥了重要作用,并以此研发出一种新型微生物制剂,利用人工接种技术改善湿地系统中微生物群落特征,增强特定微生物群落降解功能。杜小刚等[16]通过研究不同树龄刺槐根际微生物多样性,建议在造林时采用合适的物种和菌根真菌相结合,充分发挥菌根真菌在黄土生态退化区植被恢复中的重要作用。Teixeira等[17]则把目光投向极地环境,通过研究南极维管植物根际土壤微生物多样性,以期扩大微生物菌种库(尤其是厌氧菌),结合环境的碳循环讨论分析该地环境微生物与温室效应及生态系统功能的相互影响和作用。由此,通过了解不同环境不同植被下的根际土壤微生物多样性,对其群落微生物的功能和利用价值进行研究,可深入剖析某一生境存在的生态问题,着力改善生态环境。
下龙湾位于越南东北部广宁省,属于群岛海湾区,年平均气温20 ℃,平均降水量为2 100 mm,土壤pH为6.0~6.5。该地区属于典型的喀斯特地貌,拥有独特的生态系统,且存在一些特殊的植被类群,如海岸泥滩,水淹红树林,山脚沙滩,山坡石壁植物等。本研究以下龙湾地区采集的植物根际土壤及沙滩沉积物样品为研究对象,基于纯培养技术及16SrRNA测序技术对其中的细菌和放线菌进行分析,旨在对该地区可培养原核微生物的多样性进行分析评价,并获取具有产业化应用前景的微生物资源。
1 材料与方法
1.1 样品采集
试验样品采集于越南下龙湾地区,采样时间为秋季。根据地形确定采样地点,并随机采集12个样品(表1),土壤pH为6.0~6.5,标记后装入无菌自封袋中,试验室4 ℃保存待用。
1.2 培养基
分离培养基和纯化培养基配方见表2和表3。

表2 分离培养基配方
1.3 分离试验方法
1.3.1 样品预处理
样品各称取3 g,分别倒入三角烧瓶中,加入30 mL无菌水,并放入无菌玻璃珠,180 r·min-1振荡1 h进行富集培养。以移液器吸取1 mL悬液转移至试管中,并加入9 mL无菌水,按此方法稀释至10-4。
分离培养基的配制:依据表2分别配制分离培养基,并加入制霉菌素(75 mg·L-1,抑制霉菌)。

表3 纯化培养基配方
1.3.2 菌株的分离、纯化及保藏
吸取100 mL上述悬液,在不同分离培养基上分别进行平板涂布,每个平板设2个生物学重复,倒置于恒温培养箱中28 ℃培养10 d;挑选形状、颜色或大小各不相同的菌落,转接至纯化培养基上,对菌落编号并描述其特征;多次纯化直至纯化板上长出单一菌落,以斜面和甘油管分别进行保藏,斜面置于4 ℃冰箱,甘油管置于-80 ℃超低温冰箱。
1.3.3 DNA提取及系统进化树的构建
样本基因组DNA提取采用酶解法与SDS-高盐法。PCR扩增引物采用细菌与放线菌通用引物,上游引物F:5′-CAGAGTTTGATCCTGGCT-3′,下游引物R:5′-AGGAGGTGATCCAGCCGCA-3′。PCR扩增体系为20 μL,其中10×buffer 2 μL,上下游引物各1.0 μL,DNA 模板0.5 μL,dNTP Mixture 1.6 μL,TaKaRa Taq0.1 μL,灭菌离子水补足20 μL。反应条件为94 ℃预变性5 min后进入循环,参数为94 ℃变性60 s,55 ℃退火60 s,72 ℃ 1 min,30个循环后72 ℃延伸10 min,4 ℃保存。扩增产物经胶回收纯化后,由上海生工生物工程有限公司完成测序。测序序列利用BLAST和EzTaxon Server 2.1软件进行序列比对。以具有不同分类地位的典型菌株基因序列和同源性较高的菌株基因序列为参比,利用Clustal X软件计算序列相似性,以MEGA 6.0软件进行系统发育分析。
1.3.4 微生物多样性指数计算[18]
香农-威纳(Shannon-Wienner)生物多样性指数:
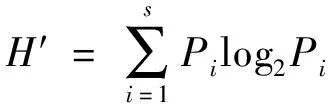
辛普森(Simpson)物种多样性指数:
马格列夫(Margalef)物种丰富度指数:
香农(Shannon)物种均匀度指数:
式中,S表示微生物群落全部物种数目,Pi表示样品中属于第i个种的个体比例,N表示样本中所有个体的数量。
2 结果与分析
2.1 微生物群落多样性分析
本试验基于10种分离培养基,共分离得到细菌和放线菌共499株,依据菌株的形状、颜色、透明度、边缘、凸起、湿润度等指标去重复后,对其中266株进行16S rRNA基因序列测序。
对266株的16S rRNA基因进行比对、系统发育分析,结果表明:下龙湾地区根际土壤可培养细菌和放线菌分布于12个目,29个科,54个属。其中,多样性最为丰富的类群为芽孢杆菌目(Bacillales)和放线菌目(Actinomycetales),分别分离到8个属和19个属,其次是变形菌门(Proteobacteria)的根瘤菌目(Rhizobiales)和伯克氏菌目(Burkholderiales),分别分离到6个属和7个属(见图1a)。
在测序的266株菌株中,数量最多的为芽孢杆菌(25株),为该地区占据优势的细菌微生物类群。其次是链霉菌(19株),为该地区占据优势的放线菌微生物类群。此外,分离到杜幹氏属(Duganella)18株;诺卡氏菌属(Nocardiopsis)13株(7个种);根瘤菌属(Rhizobium)12株(9个种);节杆菌属(Arthrobacter)11株(8个种);分枝杆菌属(Mycobacterium)11株(7个种);假单胞菌属(Pseudomonas)10株(8个种)。剩余147株菌隶属于另外46个属(见图1b),包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、栖热菌门(Deinococcus-Thermus)和放线菌门(Actinobacteria)。因此,从菌株的分布情况和数量分析,该地区土壤可培养原核微生物优势类群为芽孢杆菌属、杜幹氏菌属和链霉菌属。
基于上述测序结果,对原核微生物多样性指数计算,结果表明,该地区多样性指数分别为:香农-威纳生物多样性指数H′=6.970;辛普森物种多样性指数D=0.987;马格列夫物种丰富度指数dMa=27.40;香农物种均匀度指数E=1.384。
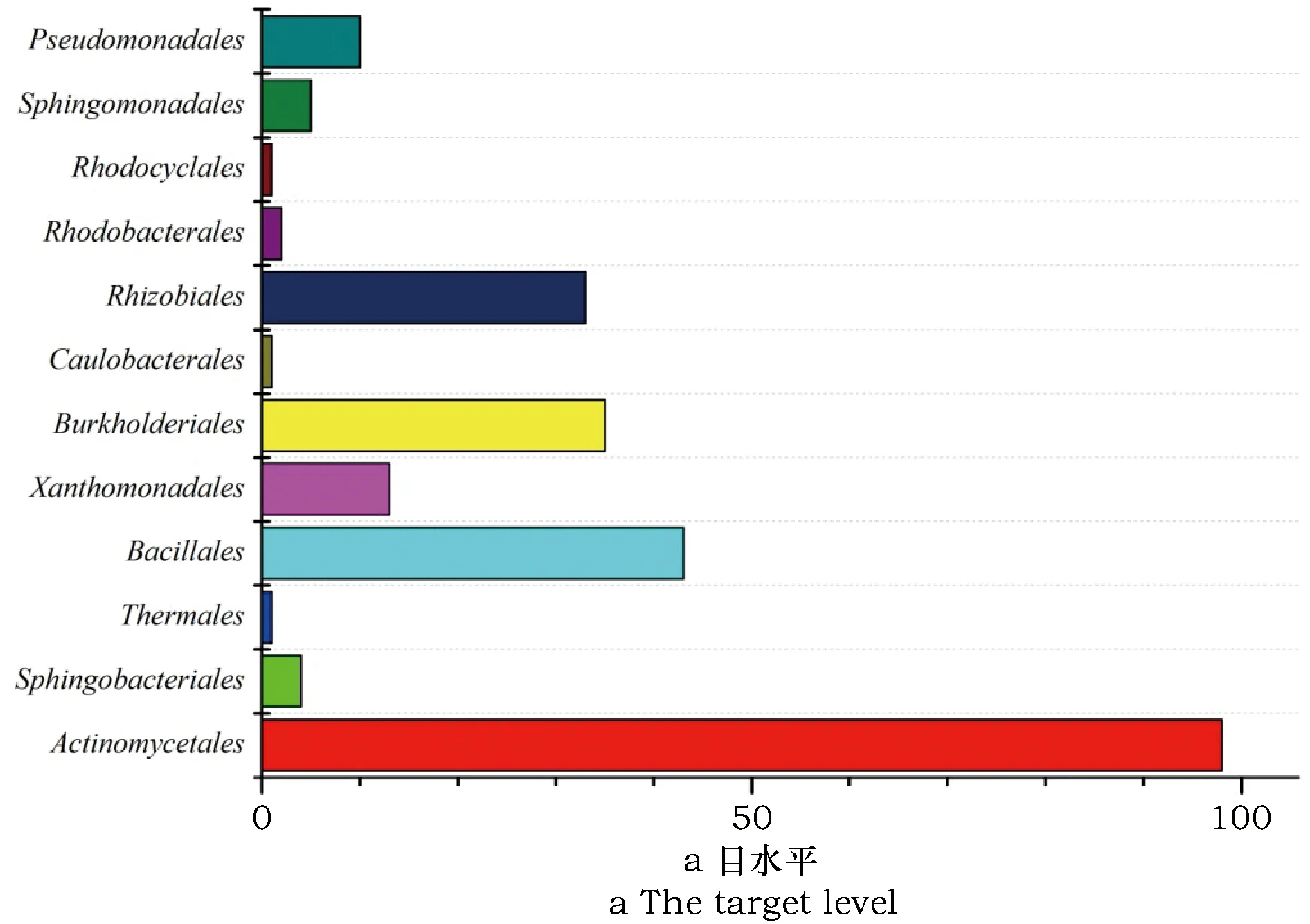
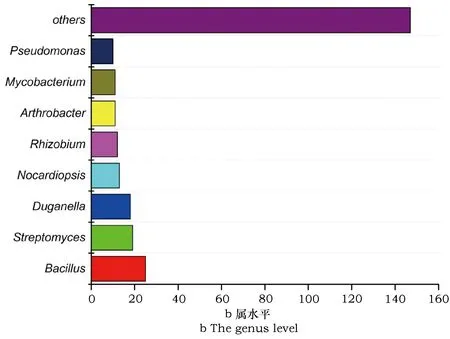
图1 下龙湾可培养细菌分布
2.2 可纯培养细菌和放线菌系统进化分析
由细菌和放线菌的系统发育分析结果可知,它们主要属于放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)3个门(图2),少数属于拟杆菌门(Bacteroidetes)和栖热菌门(Deinococcus-Thermus),隶属于54个属。其中,芽孢菌属、链霉菌属及杜幹氏菌属为该地区土壤微生物优势类群,占测序菌株数量的9.4%、7.14%和6.77%,其余还包括诺卡氏菌属(Nocardiopsis)、根瘤菌属(Rhizobium)、分枝杆菌属(Mycobacterium)、节杆菌属(Arthrobacter)、假单胞菌属,占测序菌株总数的4.89%、4.51%、4.14%、4.14%和3.76%。而其中链霉菌属、诺卡氏菌属、节杆菌属和分枝杆菌属均为放线菌门。在所分离的菌株中,CFH84的16S rRNA基因序列相似性是94.36%,为鞘脂杆菌目(Sphingobacteriales)的候选新属,CFH 60、CFH 499、CFH 483、CFH 363、CFH 308、CFH 351、CFH 326的16S rRNA基因序列相似性分别是96.8%、96.68%、96.92%、96.46%、96.41%、95.8%、96.16%,为壤霉菌属(Agromyces)、芽孢杆菌属、中华单胞菌属(Sinomonas)和拟无枝酸菌属(Amycolatopsis)的候选新种。
2.3 不同样点细菌和放线菌多样性分析
由图3可知,在全部12个样点中,样点2中分离的微生物类群最为丰富,占总数量的20.64%,样点5及样点6所获分离菌株数量其次,占总数的18.24%和16.23%,样点4及样点9分离菌株数量最少,占总数的0.4%。
2.4 分离培养基对可培养微生物分离的影响
由图4可以看出,4号、8号培养基分离得到的菌株数量最多,分离效果最为理想,所分离菌株占菌株总数的12.82%、12.02%。10号培养基分离菌株数次之,占菌株总数的11.62%。6号培养只分离到占总数3.81%的菌株。
3 讨论
越南下龙湾地区是喀斯特地形的典型代表。迄今为止,关于越南土壤微生物多样性的研究多集中于作物根际、河流沉积物、红树林及植物内生菌等。本文采取纯培养技术,获取了丰富的细菌和放线菌资源,在此基础上,分析该地区微生物物种多样性及群落结构,旨在为该生境下微生物资源的开发利用提供参考依据。在本研究中,根际土壤常见的芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、链霉菌属(Streptomyces)均被分离出来,其中最优势类群为芽孢杆菌属(Bacillus),它可以合成降解高聚物的胞外酶、抗生素和促进植物生长的化合物,在腐生营养环境中通常为优势属[19]。此外,假单胞菌属(Pseudomonadaceae)也有较高的丰度。肖龙敏等对枸杞根际微生物群落多样性研究结果显示,假单胞菌属、红环菌属(Rhodocyclus)、链霉菌属和分支杆菌属(Mycobacterium)为优势类群,与本研究结果类似,但芽孢杆菌属并非优势类群。分析原因,不同的植被覆盖类型对根际土壤微生物多样性影响较大[20]。芽孢杆菌属和假单胞菌属均为植物根际土壤典型微生物,在植物分泌物和脱落物产生的生境条件下反应迅速,繁殖速度很快[19]。
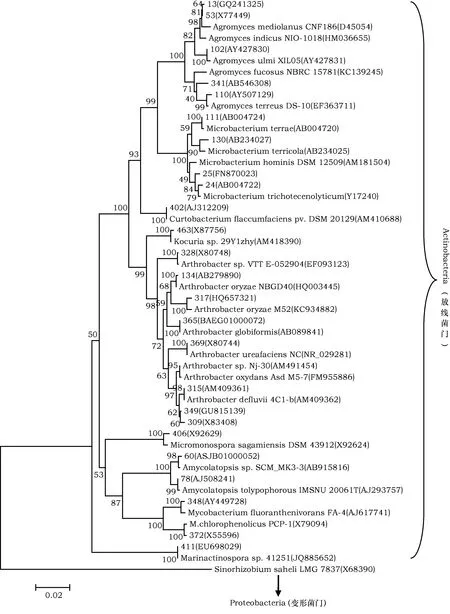

图2 基于16S rRNA基因序列构建的可培养细菌和放线菌系统发育树
本研究结果显示,下龙湾地区根际土壤微生物的Shannon-Wienner指数及Shannon物种均匀度指数相对于其它根际土壤[16,17,21]的均较高,表明该地区微生物多样性较高,微生物资源较为丰富。但本研究在不同的12个采样点所获得的微生物组成差异较大,其中样点2占总分离微生物类群的20.64%,而样点4及样点9仅占到总分离微生物类群的0.4%。说明在下龙湾不同的样品采集点根际微生物组成差异显著不同。Gelsomino等在不同地理位置的土壤中采集16个土壤样本,以DGGE法分析不同生境条件下的土壤微生物群落结构,结果证明,微生物群落结构在不同的土壤类型中差异较大[22]。唐杰等[23]对若尔盖高原湿地土壤中微生物多样性及群落结构进行了研究,结果表明不同退化阶段的高原湿地土壤中微生物数量、细菌群落结构及多样性均存在显著差异。究其原因,不同样品采集点的地理位置、不同类型的土壤理化性质(如养分、通气、水分、pH等)、地上植被的种类、生长状况及根系分泌物数量的变化,均会影响根际微生物群落结构[24]。下龙湾地区属于喀斯特地貌的特殊地质,其多样化的生态系统、独有的植被种类、特殊的土壤类型使得该地区原核微生物存在特有的结构特征。此外,该地区植物种类繁多,且存在一些特殊的植物群落,如海岸泥滩,山脚沙滩,山坡石壁植物等,都会很大程度上影响其根际土壤原核微生物多样性。因此,应根据具体情况,综合分析下龙湾样点间植物根际微生物类群的差异及其与其它地域根际微生物类群的差异,进一步对于这种特殊植被覆盖下的环境微生物存在的潜在价值开展深入研究、评估。
目前关于根际土壤微生物的研究主要集中在其功能和利用上。丁浩[15]和吴林坤[25]等人研究发现根际土壤优势微生物除了芽孢杆菌之外,还包括假单胞菌、气单胞菌,以此研发的新型微生物制剂,不仅可以显著改善湿地系统中微生物特征,增强微生物降解功能,也为提高作物的产量、质量和防治病虫害提供了保障。此外,本研究利用不同类型培养基对下龙湾地区根际土壤原核微生物多样性进行分析,发现该地区根际土壤微生物类群对不同碳、氮源具有选择性。张超等对黄土高原不同植被类型根际土壤微生物群落功能多样性研究发现,不同植被根际土壤微生物碳源代谢特征不同[26]。因此,可根据下龙湾地区根际土壤微生物类群碳、氮源代谢特征进行植被种类的选择,或者根据其现有植被种类,采用人工的方法对其根际土壤理化性质进行调控,进而使特定根际微生物类群选择性增殖。综上所述,本研究结果不仅可为判断下龙湾地区土壤质量提供数据支撑,而且为采取合理的植被覆盖模式、土壤经营模式,开发该地区旅游资源,维护其生态平衡奠定基础。
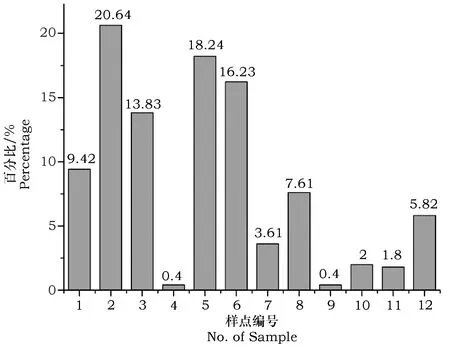
图3 下龙湾地区不同样点分离菌株的百分比
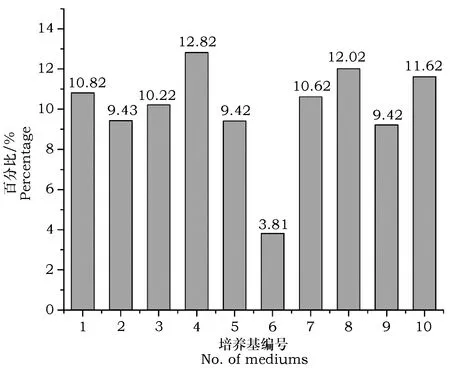
图4 不同分离培养基分离下龙湾地区菌株的百分比
