甲基转移酶dSet1调控果蝇生殖细胞发育
2020-04-28宣涛张欣李明发孟和张小民
宣涛,张欣,李明发,孟和,张小民*
(1.上海交通大学 农业与生物学院,上海 200240;2.山西大学 生命科学学院,山西 太原 030006)
果蝇卵巢在雌蝇幼虫期的生长发育,保证了蛹期及成体卵巢组织拥有数目稳定、规模适中的生殖干细胞单元,保证了雌蝇羽化后数周内持续不断地产生成熟卵细胞,保持其生殖活力。雌性果蝇幼虫卵巢中包括生殖细胞谱系和体细胞谱系,这两大细胞谱系的协同发育是果蝇卵巢正常发育的保证,这一过程已成为研究组织/器官发育中的细胞命运及行为调控以及细胞间的相互调控的理想工作平台。作为果蝇成体生殖干细胞的前体,属于生殖细胞谱系的原始生殖细胞(PGC)在幼虫卵巢发育过程中经历了一系列特征性的发育过程,包括增殖与有序分化的开启。PGC从1龄(1st instar)幼虫开始持续增殖直至3龄幼虫晚期(late 3rd instar larvae, LL3),数目从12个增殖至超过100个,在此期间,PGC分化始终处于被抑制状态,而进入幼虫向蛹转换期(larval/pupal transition),PGC开启适度、有序的细胞分化程序[1,2]。在PGC程序化的细胞命运及行为改变过程中,体细胞谱系扮演了不可或缺的角色,其中作为PGC微环境(niche)重要细胞类群之一的混合细胞(intermingled cells,ICs)参与调控PGC的增殖及有序分化[3,4]。
越来越多的证据表明,除经典的遗传控制外,染色质结构层面的调控,即表观遗传调控也参与到众多的细胞与发育过程中[5~8]。本课题组和同行实验室陆续发现多个表观调控因子参与果蝇成虫卵巢发育调控[9~12]。前期研究中我们发现组蛋白H3第四位赖氨酸(H3K4)甲基转移酶dSet1不仅参与调控果蝇成虫生殖干细胞的命运维持,还以非细胞自治性的方式调控生殖干细胞的分化[12]。不仅如此,雌性果蝇幼虫阶段卵巢正常发育是成体生殖干细胞正常维持的前提和基础,该过程亦受到多层次复杂调控[13~17],我们之前的研究还发现,microRNA参与调控雌性果蝇幼虫原生生殖细胞发育的证据[13]。而本研究的开展,则系统阐述了组蛋白H3K4甲基转移酶dSet1在果蝇原始生殖细胞分化与增殖过程中发挥的调控功能,旨在揭示更多的表观遗传调控因子在果蝇卵巢发育过程中行使的功能。
1 材料与方法
1.1 果蝇品系
果蝇品系饲养过程在温度25 ℃,湿度60%条件下进行。
果蝇杂交过程为挑取相应品系雌性处女蝇与相应雄性果蝇合管饲养。
本研究所使用的果蝇品系包括CantonS(CS)、tj-gal4、nos-gal4、UAS-dSet1-RNAi(BloomingtonDrosophilastock center 33704)、UAS-dSet1-RNAi(BloomingtonDrosophilastock center 38368)。
围绕云南省委、省政府打造“三张牌”战略要求,恒丰银行昆明分行紧跟政策导向,将绿色信贷列为重点支持行业,并不断延伸服务“三张牌”上下游企业。
1.2 抗体及荧光素染料
(6)二抗染色:用封闭液稀释相对应的二抗,室温下孵育2 h,用PBST洗涤3次,每次20 min。
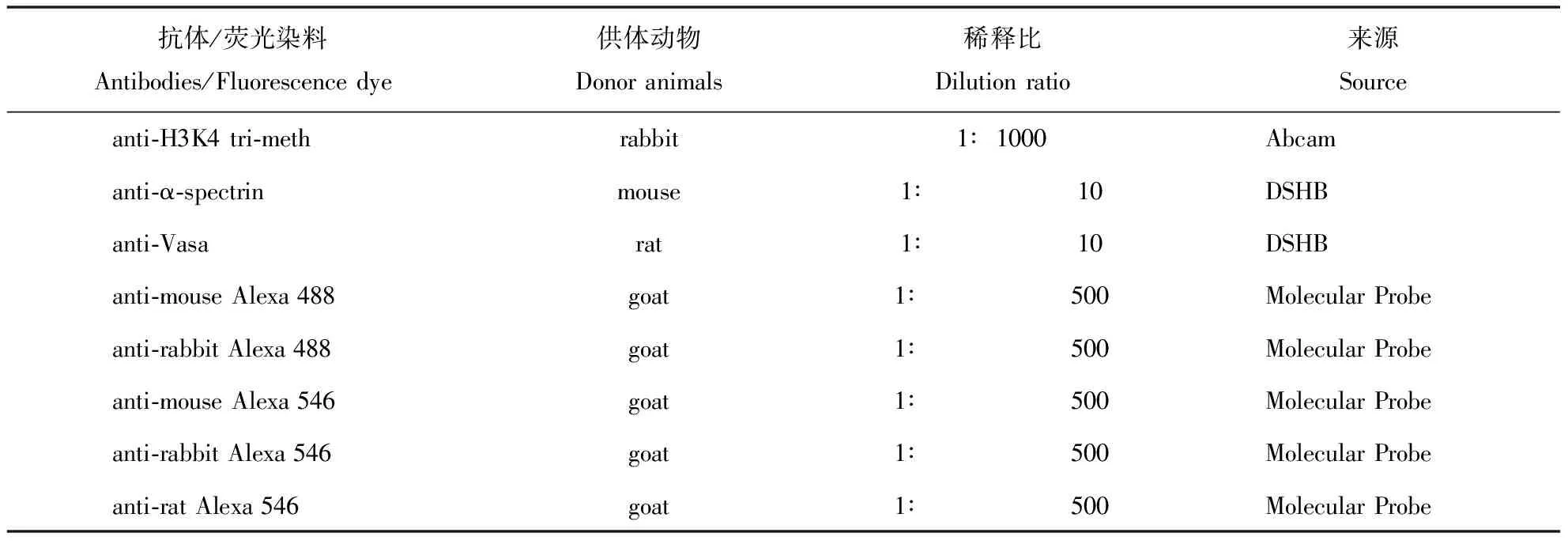
表1 抗体和荧光素染料列表
1.3 UAS-Gal4二元表达系统及RNAi
本研究使用Gal4-UAS二元表达系统及RNAi技术,在果蝇体内进行时空特异性下调dSet1表达量。试验时需要将UAS-dSet1-RNAi品系果蝇与Gal4品系果蝇进行杂交,后代中既包含Gal4又包含UAS-dSet1-RNAi的果蝇即可在组织特异性增强子驱动下下调dSet1表达量。
1.4 果蝇幼虫性腺解剖
论文中解剖的果蝇幼虫主要有3个时期,包括三龄幼虫中期(ML3)、三龄幼虫晚期(LL3)和蛹期早期(WP)。果蝇幼虫发育时间见表2。
秩和检验(Mann-Whitney Test)或χ2检验(χ2-test)用于本研究中对P值(p-values)的计算。当P<0.05时,差异显著。

表2 果蝇幼虫发育时间
注:hrs=小时;AEL=产卵后
Note:hrs means hours; AEL means after egg laying
发育至三龄幼虫中期(ML3)的幼虫仍然处在食物中;发育至三龄幼虫晚期(LL3)的幼虫大部分已经爬壁;WP时期果蝇蛹呈白色,处于正在成蛹或刚成蛹阶段。Pupae时期果蝇已成蛹。
雌性果蝇幼虫性腺位于其后1/3处,大概在第10体节处。解剖过程在PBS(pH=7.4)解剖缓冲液中进行。解剖时双手各持一支解剖镊,使用左手镊固定幼虫,使用右手镊从果蝇幼虫中间处扯开,将幼虫后半部分的组织剖出,将消化管、气管等多余器官剔除。性腺呈球形透明状,位于幼虫脂肪体中间,需仔细识别。
1.5 果蝇幼虫性腺间接免疫荧光染色
如上所述,在含有PBS(PH=7.4)解剖缓冲液中解剖出幼虫或蛹期雌蝇性腺。荧光染色步骤如下:
(1)组织固定:于4%多聚甲醛中进行组织固定,固定时间为室温30 min。结束后,用含0.3% TritonX-100的PBS(PBST)洗涤3次,每次10 min。
(4)一抗染色:用封闭液将一抗稀释到适当浓度,4 ℃孵育卵巢组织过夜。
急性病猪主要为败血症变化,慢性病例有典型的病变在盲肠、结肠,甚至回肠。可见肠壁淋巴滤泡肿胀隆起,以后发生坏死和溃疡。肠黏膜呈弥漫性坏死性糜烂,表面被覆一层灰黄色或黄绿色易剥离的麸皮样物质,肠壁粗糙增厚。重症病例,肠壁大片坏死脱落,肝、脾和肠系膜淋巴结常可见到针尖大灰黄色坏死灶或灰白色结节。
(3)组织封闭:渗透结束后,将组织移至含10% 山羊血清(GS)的PBST室温下封闭2 h。
(2)组织预渗透:染色前组织需进行预渗透,条件为含1% TritonX-100 的PBS缓冲液中室温放置1 h。
(7)涂片并封片后4 ℃避光保存。
本研究中使用的一抗、二抗及荧光素染料见表1。
(5)再次封闭:一抗染色结束后,用PBST洗涤3次,每次20 min,后将组织移至含10% 山羊血清(GS)的PBST室温下封闭1 h。
1.6 原始生殖细胞识别
原始生殖细胞识别使用Vasa和α-Spectrin抗体染色。用Vasa抗体标记生殖细胞,用α-Spectrin抗体标记生殖细胞中的血影小体(spectrosome)。
贸易互补性指数。主要是衡量两国间贸易互补程度,通常以一国特定产品出口的比较优势与其贸易伙伴国该产品进口的比较劣势的乘积来衡量。计算公式如下:
原始生殖细胞中血影小体为圆形,而在分化的生殖细胞中,血影小体形态发生改变,两细胞胞囊中血影小体为棒状,四细胞胞囊中血影小体为U型,八细胞与16细胞胞囊中血影小体呈分支状(branch)。根据血影小体形态判断生殖细胞分化程度并进行计数。
积极开展剖宫产术后阴道分娩 (vaginal birth after cesarean,VBAC),降低剖宫产率,减少母儿近远期并发症成为产科学界关注的焦点。随着循证医学证据的累积,国际产科学界对VBAC的观念亦不断发生变迁,认为VBAC安全、适宜,推荐有1次子宫下段剖宫产史且无阴道分娩禁忌症者试行VBAC。疤痕子宫并非剖宫产手术的绝对手术指征,国内外研究表明[13-16],由于医疗技术的提高、监护手段的改善以及子宫下段剖宫产的普及,选择剖宫产术后再次妊娠经阴道分娩的人数逐渐增多。
Apache HTTP Server,是Apache软件基金会的一个开放源码的网页服务器,具有跨平台使用和安全性高的特点。通过模块化的设计来适应各种外在平台环境,允许网站管理员通过在编译时或运行时,选择哪些模块将会加载在服务器中,从而选择服务器特性。Django框架使用mod_wsgi.so作为插入模块,使网站正常运行。主要配置代码如下:
1.7 荧光染色组织图像的采集及处理
有研究指出,植物叶片的N、P含量在不同时期往往展现出较大的差异[31]。胡耀升等[32]对长白山森林植物功能性状的研究表明,LNC与LPC呈极显著正相关,而赵光伟[33]则发现烤烟叶片总氮含量随叶龄的增大逐渐降低,本研究结果与之一致。长柄双花木的LNC和LPC在植株的不同发育阶段表现出显著的差异,LNC和LPC均随着植株的发育而下降。这可能是由于在幼苗时期叶片代谢频繁,需要较多的蛋白质和核酸来满足叶片生长的需求,提升了N、P浓度;而到了幼树和成树时期,植物获取的大部分养分被输送到其他器官用于开花等,相应地植物叶片中的N、P含量有所下降[32]。
1.2.2 抗H7N9病毒治疗 (1)奥司他韦胶囊(意大利Roche S.p.A公司)150 mg口服,每日两次;(2)在取得患者和家属同意并签署“知情同意书”后实施奥司他韦雾化治疗,将奥司他韦75 mg(1粒)捣碎后转入雾化器杯里,加生理盐水7 mL,并充分搅拌后雾化(flexicare口含型雾化器,富利凯医疗用品有限公司),每日雾化两次。
1.8 数学分析方法
“观自在”——儒道佛思想对人之存在的美学规定 ……………………………………………… 韩书堂(3.67)
Nikon 80i荧光显微镜或Leica TCS SP5共聚焦显微镜用于采集本研究所展示的多色通道荧光照片。Adobe Photoshop软件用于对采集图片进行汇集和整理排版。
2 结果与分析
2.1 雌性果蝇幼虫卵巢细胞中组蛋白H3K4三甲基化修饰依赖dSet1的功能
已有研究证明,在体外培养细胞中,dSet1参与调控组蛋白H3K4三甲基化。但在果蝇幼虫卵巢组织中dSet1与组蛋白H3K4三甲基化之间的关系并未被证明。本文使用UAS-Gal4二元表达系统和RNAi技术,选择在雌蝇幼虫卵巢体细胞谱系中特异性表达的tj-GAL4以及生殖细胞谱系中特异性表达的nos-Gal4,分别在2个细胞谱系中特异性下调dSet1表达量并使用anti-H3K4三甲基化抗体进行免疫荧光染色检测组蛋白H3K4三甲基化。生殖细胞谱系中下调dSet1表达量的幼虫卵巢,使用anti-Vasa抗体标记生殖细胞,体细胞谱系中下调dSet1表达量的幼虫卵巢,使用anti-TJ抗体标记混合细胞(体细胞谱系)。与对照组(图1 A、A’、C、C’)相比,dSet1表达量下调的卵巢中无论生殖细胞谱系(图1 B、B’箭头)还是混合细胞(体细胞谱系)(图1 D、D’箭头)中H3K4三甲基化水平均明显下调。试验结果证明,dSet1参与调控雌蝇幼虫卵巢两大细胞谱系组蛋白H3K4三甲基化修饰。
2.2 dSet1参与调控PGC有序分化
使用UAS-Gal4二元表达系统以及RNAi技术,选择在性腺生殖细胞谱系中特异性表达的nos-GAL4在生殖细胞谱系中下调dSet1表达量;选择在体细胞谱系中特异性表达的traffictj-Gal4在体细胞谱系中下调dSet1表达量。采用免疫荧光染色方法,生殖细胞用Vasa特异性抗体标记,生殖细胞中的血影小体用α-spectrin特异性抗体标记。根据血影小体形态判断生殖细胞分化程度并进行计数。
生命是一个创造的过程,也是一个积淀的过程,每个人无时无刻不在为自己的人生埋下“伏笔”。在平凡的生活中,我们只有尽可能地积聚力量,不断奠定坚实的人生基础,才会散发出耀眼的光芒,实现自身的飞跃。毛竹的精神是令人钦佩的,我们要做一夜之间蹿入云霄的毛竹,就要拥有毛竹的气度:沉得住底气、耐得住寂寞,俯下身子、站稳脚步,积聚能量、蓄势待发。一旦时机成熟,定会拔地而起。
免疫荧光染色显示,对照组(仅含nos-GAL4驱动子或tj-GAL4驱动子)雌性LL3性腺组织中生殖细胞基本处于单细胞或两细胞状态,表明PGC的分化在LL3期并未启动(nos-Gal4/+:0%,n=15;tj-Gal4/+:0%,n=15);不同于对照组,处于同一发育阶段的试验组(nos-GAL4或tj-GAL4驱动dSet1-RNAi转基因分别在生殖或成体细胞谱系中表达)包含四细胞生殖系胞囊的性腺个数显著增多(nos-Gal4>dSet1-RNAi:100%,n=14;tj-Gal4>dSet1-RNAi:58.3%,n=12)(图2B-B’、D-D’,箭头)。结果提示,2种细胞谱系中下调dSet1基因的表达可促进三龄晚期LL3性腺组织中的PGC分化。
2.3 体细胞谱系中的dSet1参与调控PGC增殖
体细胞谱系与生殖细胞谱系之间的协同发育是保证雌性果蝇幼虫卵巢正常发育基础。PGC中表达并分泌的表皮生长因子受体(epidermal growth factor receptor,EGFR)信号配体Spitz,激活混合细胞(intermingle cell, IC)中的EGFR信号通路。EGFR信号通路的激活抑制蛋白聚糖Dally(Division abnormally delayed)的表达,从而达到控制骨形态发生蛋白(Bone morphogenetic protein,BMP)信号通路配体Dpp的扩散范围的目的。这样精细的调控机制,目的在于控制PGC增殖与分化。
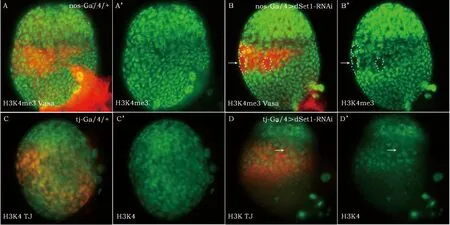
(A-D’)对照组(A-A’、C-C’)和dSet1表达量下调(B-B’、D-D’)雌蝇幼虫卵巢,使用H3K4三甲基化抗体(绿色)(A-F’)检测H3K4三甲基化水平,以及分别使用anti-Vasa(红色)(A-B’)标记生殖细胞、anti-Traffic Jam(TJ)(红色)(C-D’)标记混合细胞(体细胞谱系)。对照组果蝇卵巢中H3K4三甲基化发生于所有细胞中,包括生殖细胞(A-A’)和混合细胞(C-C’)。生殖细胞谱系中下调dSet1表达量,这类细胞中H3K4三甲基化水平明显降低(B-B’)。同样,体细胞谱系中下调dSet1表达量,混合细胞(D-D’)中的H3K4三甲基化水平亦明显下调
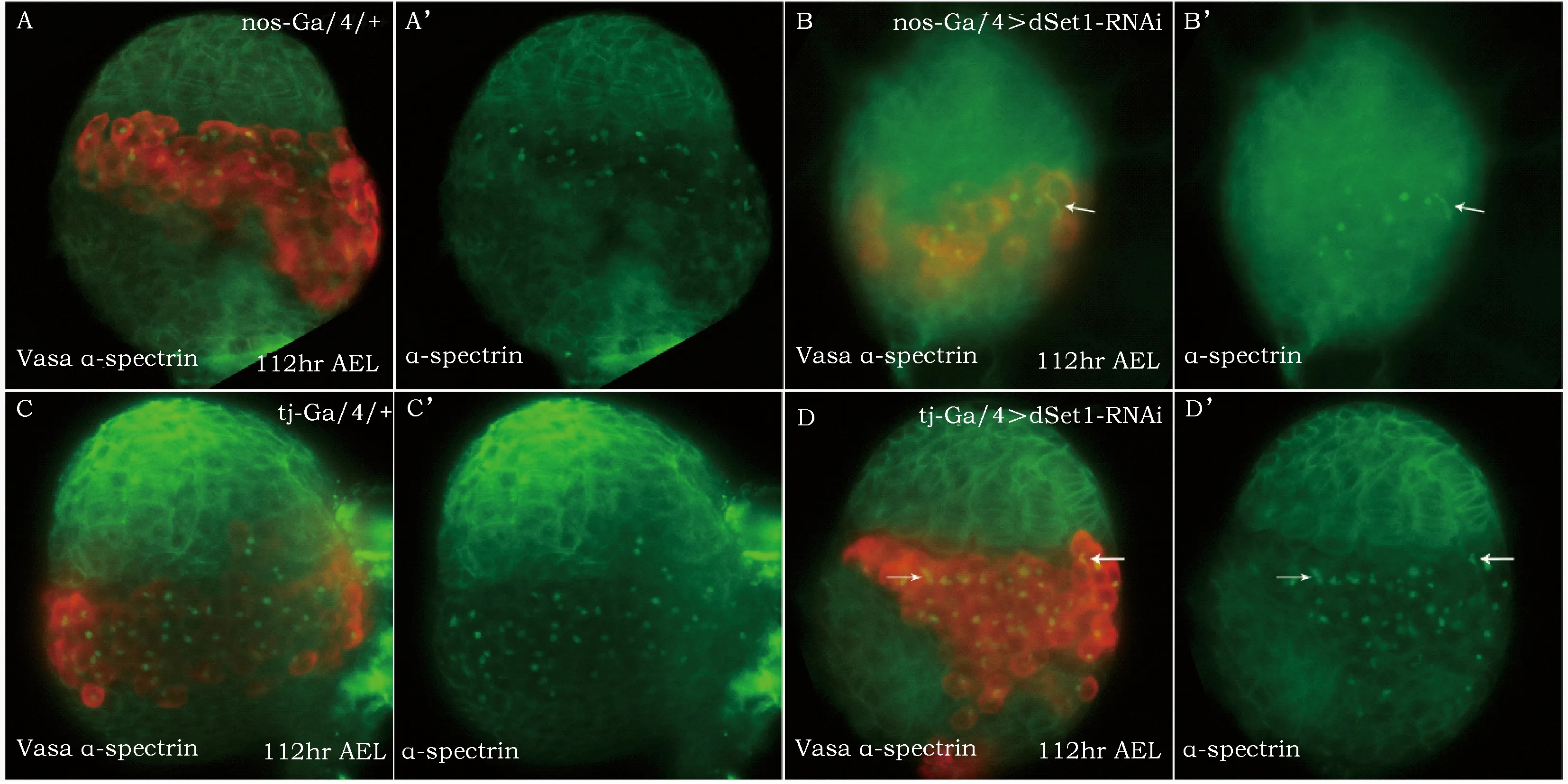
(A-D’):使用Vasa(红色)和α-Spectrin(绿色)抗体免疫荧光双染色分别标记LL3期性腺组织中的生殖细胞谱系和融合体(fusome, 生殖细胞特有的细胞器)。对照组nos-Gal4/+(A、A’)和tj-Gal4/+(C、C’)中,PGC/CB中的融合体均呈球形。在下调生殖细胞谱系(B、B’)或体细胞谱系(D、D’)dSet1表达量的性腺中可以检测到由PGC分化而来的生殖系胞囊,其中含分枝状融合体(B、B’、D、D’,箭头)
我们使用UAS-Gal4二元表达系统和RNAi技术,以在幼虫卵巢体细胞谱系中特异性表达的tj-GAL4为对照,在卵巢体细胞谱系中特异性下调dSet1表达量。采用免疫荧光染色方法,生殖细胞用Vasa特异性抗体标记,生殖细胞中的血影小体用α-spectrin特异性抗体标记,根据血影小体形态判断生殖细胞并进行计数。结果表明,在对照组(tj-Gal4/+)中,每个性腺平均包含115个PGCs(n=14),而在体细胞谱系下调dSet1的表达量,每个性腺中PGC数目可达149个(n=11,P<0.05)(图3及表3)。这样的结果表明,体细胞谱系中的dSet1以非细胞自治的方式参与调控PGC的增殖过程。
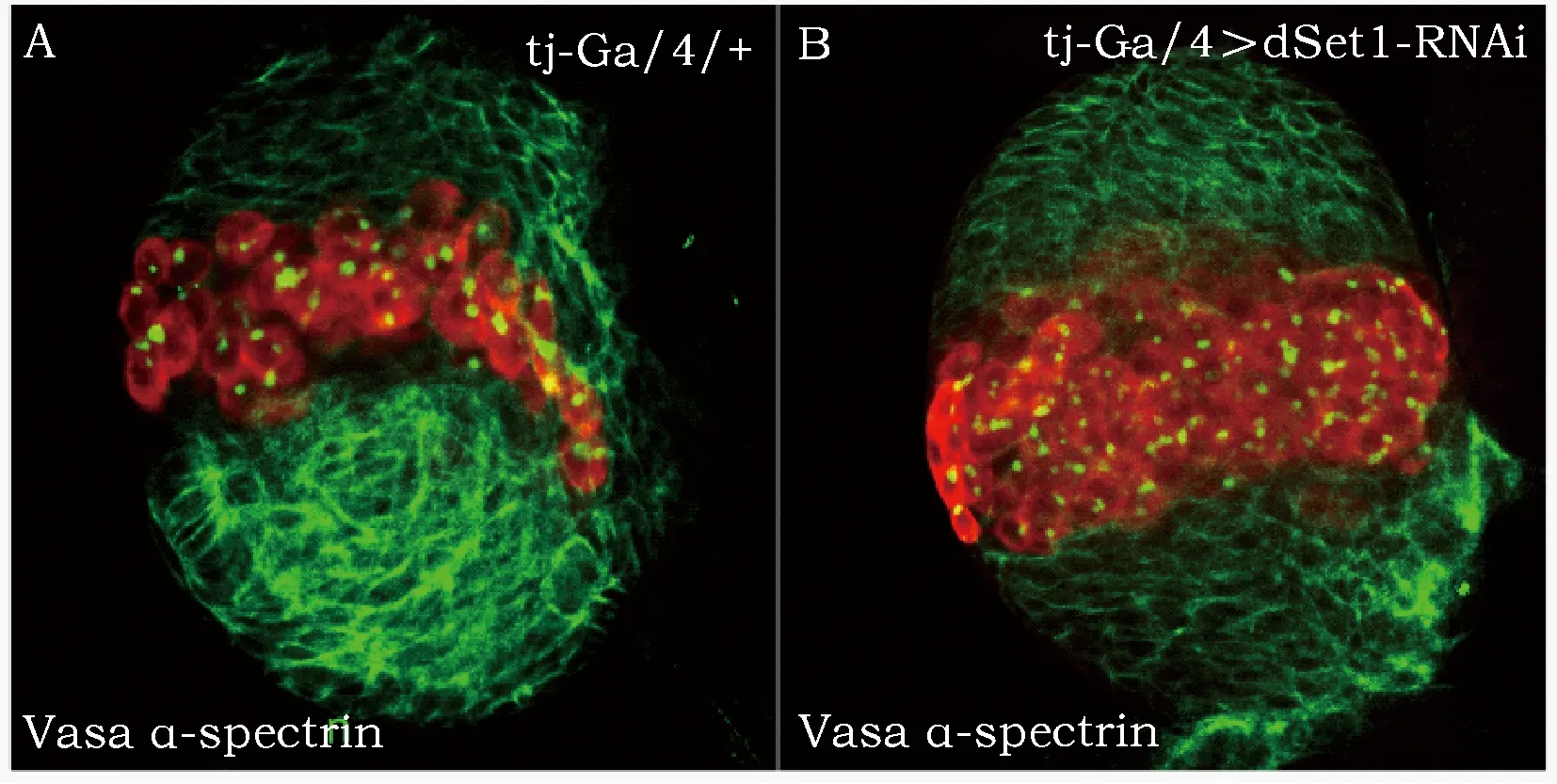
使用Vasa(红色)和α-Spectrin(绿色)抗体免疫荧光双染色分别标记LL3期性腺组织中的生殖细胞谱系和融合体。与对照组tj-Gal4/+(A)相比,下调体细胞谱系中的dSet1表达(B),PGC数目显著增多

表3 体细胞中的dSet1参与调控PGC增殖
*P<0.05
3 讨论与结论
表观遗传学是指在不改变DNA序列的前提下,基因表达或功能的稳定的变化,这种稳定性一般是指可以在细胞分裂时遗传至子细胞。目前已知的表观遗传学变化包括非编码小RNA调控,组蛋白修饰,染色质重塑,DNA甲基化与去甲基化等。其中,组蛋白赖氨酸位点的甲基化通过影响组蛋白的构象及亲水性,以及与DNA的亲和性参与调控基因的表达。组蛋白H3第4位赖氨酸(H3K4)位点上的甲基化是转录的起始位点的标志,组蛋白甲基转移酶dSet1参与这一甲基化过程。本文选择果蝇幼虫性腺生殖细胞谱系的增殖与分化这一发育过程,研究dSet1在此发育过程中所行使的调控功能。证明dSet1不仅参与调控PGC有序分化,而且表达于体细胞谱系的dSet1还参与调控PGC的增殖。
已有研究证明,dSet1在果蝇多个器官正常发育过程中扮演着非常重要的角色[18]。在果蝇幼虫翅成虫盘与眼成虫盘发育过程中,H3K4甲基化的缺失影响到NOTCH信号通路的活性,该信号通路其部分成员基因表达异常。而H3K4甲基化的缺失并未影响到BMP信号通路靶基因spalt的表达,这说明,H3K4甲基化对于基因表达的调控是具有特异性的[19]。本实验室已发表文章中结果证明,雌性果蝇成体生殖干细胞的发育也受dSet1调控,dSet1表达量下调的生殖干细胞不能维持其干性,而在此发育过程中,BMP信号通路活性受到影响[12]。本研究的开展是之前研究结果的延伸,探究dSet1在雌性果蝇幼虫性腺发育中的功能。在雌性果蝇幼虫性腺发育过程中,BMP信号,EGFR信号,NOTCH信号均发挥中重要的调控作用,dSet1通过调控何种信号通路的活性参与调控这一复杂的发育过程?这是我们未来的研究重点。
在果蝇中,dSet1、Trx、Trr和Ash1均参与调控组蛋白H3K4甲基化,诸多研究均认为dSet1是果蝇中最主要的H3K4三甲基化甲基转移酶[12,20,21]。我们不禁要问,其余三个甲基转移酶是否调控雌性果蝇幼虫卵巢正常发育?不仅如此,dSet1与Trx、Trr形成COMPASS(Complex of Ptotein Associated with Set1)复合物,以复合物方式行使甲基转移酶功能,那么在雌性果蝇幼虫原始生殖细胞有序分化及增值调控过程中,该复合物中的其他成员是否具有调控功能?以何种方式行使调控功能?这也将是我们课题组接下来的工作重点。
本研究探讨表观遗传调控在果蝇器官发育过程中的调控功能,找到组蛋白H3K4甲基转移酶dSet1参与调控性腺发育的实验证据,为表观遗传调控参与细胞及器官发育过程提供新的证据。
