以肢体无力为主要表现的原发性家族性脑钙化症一例报告
2020-04-28周敏慧谢心怡任汝静
周敏慧,谢心怡,任汝静,王 刚
(1.上海交通大学医学院附属瑞金医院神经内科,上海 200025 2.江苏省启东市中医院脑病科,江苏 启东 226200)
特发性基底节钙化又被称为Fahr 病,随着该病致病基因被发现,且其受累脑区其实并不局限于基底节,故也被称为原发性家族性脑钙化症(primary familial brain calcification,PFBC)。这是一种特发性和难治性的疾病,发病原因目前仍不明。此病最主要的特点是患者基底节、下丘脑、齿状核异常钙化,临床症状包括锥体外系症状、认知障碍、精神障碍、癫痫等,但临床报道该病以锥体系受损起病者较少。现报道本研究收治的1 例因肢体无力为表现入院的老年男性PFBC 患者。
病例:患者,老年男性,64 岁,农民,小学文化,育有一子,体健。患者因“言语不利伴左侧肢体乏力3 周”被收治入院。入院3 周前,患者在无明显诱因下出现言语不利,伴有左侧肢体无力,遂至当地医院诊治。予查头颅MRI,结果提示“两侧小脑齿状核、两侧基底节区、丘脑区、两侧侧脑室旁及两侧大脑枕叶皮层下多发对称性钙化灶,不除外Fahr 病”。故当地医院予患者阿司匹林抗血小板,予瑞舒伐他汀降血脂、巩固斑块,长春西汀改善微循环等治疗,患者的症状稍有好转。
为进一步诊治,患者转入我院。入院查体示,患者神志清,精神可,言语稍含糊;双侧额纹对称,无变浅,双侧瞳孔等大、等圆,直径为3 mm,对光反射灵敏,双侧鼻唇沟、口角基本对称,伸舌偏左;无双睑下垂,眼球活动可,四肢肌张力轻度增高,左上肢肌力Ⅳ级,左下肢肌力Ⅴ-级,右侧肢体肌力Ⅴ级,左上肢腱反射+++,右上肢及双下肢腱反射++,颈软,脑膜刺激征(-),左侧肢体针刺觉减退;生理反射存在,病理征均未引出,双侧指鼻试验及跟膝胫试验正常,双手平举未见不自主运动,双侧轮替动作稍慢。患者的简易智能精神状态检查量表(mini-mental status examination,MMSE)评分为12 分(共30 分)。追问病史,患者儿子否认患者存在肢体乏力及运动迟缓,并表示患者在近日的健康体检中曾行头颅CT 检查,体格检查示神经系统检查结果正常。予患者行实验室检查,结果如下。血钠141 mmol/L(参考值130~147 mmol/L),血钾4.27 mmol/L(参考值3.50~5.10 mmol/L),血氯104 mmol/L(参考值96~108 mmol/L),血钙2.19 mmol/L(参考值2.00~2.75 mmol/L),血磷1.17 mmol/L(参考值0.80~1.60 mmol/L),血镁0.89 mmol/L(参考值0.74~1.03 mmol/L);25-羟基维生素D 104.30 nmol/L(参考值>50 nmol/L);甲状旁腺激素(parathyroid hormone,PTH)47.8 pg/mL(参考值15.0~68.3 pg/mL);甲状腺功能,三碘甲状腺原氨酸1.91 nmol/L(参考值0.89~2.44 nmol/L),甲状腺素103.84 nmol/L(参考值62.67~150.84 nmol/L),游离三碘甲腺原氨酸5.14 pmol/L(参考值2.63~5.70 pmol/L),游离甲状腺素12.35 pmol/L(参考值9.01~19.04 pmol/L),促甲状腺素1.255 0 U/mL(参考值0.350 0~4.940 0 U/mL)。同时予患者及其儿子行头颅CT 检查,结果提示(见图1),患者两侧小脑齿状核、两侧基底节区、丘脑区、两侧侧脑室旁及两侧大脑枕叶皮层下多发对称性钙化灶,不除外Fahr 病;患者儿子的双侧侧脑室旁、基底节区、小脑可见多发对称性钙化灶,不除外Fahr 病(见图2)。基因检测结果显示,患者的全外显子测序结果提示其致病突变为SLC20A2 基因3 号外显子:c.370G>A:p.G124R,随后对其进行一代测序验证,并检测其儿子的基因,结果发现患者儿子存在与患者一致的基因突变(见图3)。分析发现,该错义突变是一个未被报道的新突变位点,在单核苷酸多态性数据库、临床变异数据库中均未被收录。

图1 患者头颅CT 图像
讨论:PFBC 是一种特发性、难治性疾病,此病的最主要特点为基底节、下丘脑、齿状核等异常钙化。这些钙化灶在CT 图像上表现为典型的对称性高密度灶,在头颅MRI 的T2 加权像上表现为低信号,在T1 加权像上表现为低或高信号[1]。头颅MRI 检查虽然也可见PFBC 基底节区对称性异常信号灶,但其诊断特异度明显低于头颅CT 检查。目前,头颅CT 检查仍是诊断PFBC 的首选影像学检查。本例报道的患者其临床症状与CT 图像上呈现的钙化部位及程度并非呈一致性,且患者的儿子虽无相关临床表现,但查头颅CT已出现小脑、基底节区、侧脑室旁对称性钙化灶。PFBC 的诊断标准[2]如下。①CT 显示双侧对称性钙沉积,且该钙沉积物通常会出现在苍白球、壳核、尾状核、丘脑(尤其是后外侧部分)和小脑(尤其是齿状核),此外内囊、半卵圆中心、大脑和小脑皮层以及脑干中也可能会出现钙化现象;②在CT 影像符合的前提下,应详细询问家族史,并在可能的情况下对亲属进行脑CT 检查,并提供适当的遗传咨询(见下文);③排除其他可能引起脑钙化的病因,包括线粒体、代谢性、传染性、中毒性、血管性和神经退行性疾病等继发性病因。
PFBC 的临床表现异质性较高,与钙质沉积部位、致病突变基因间均无明显相关性。PFBC 可发生于任何年龄阶段,但40~60 岁发病最常见,患者的典型临床表现为进行性运动症状、精神症状、认知损害等,与许多神经变性疾病表现重叠[2]。SLC20A2 突变导致的PFBC 报道最常见,在各年龄段均有发病报道,平均起病年龄为50 岁左右,无明显性别差异。约50%的SLC20A2 突变患者可有帕金森病表现[3],其他临床症状包括肢体无力、偏头痛、认知减退、执行功能障碍、视空间能力减退、震颤、行走不稳、肢体抽搐、共济失调、语言问题等[2]。多数PFBC 患者以锥体外系症状起病,但国外一项研究显示,约30%的PFBC 患者无明显临床症状,尽管其神经影像学检查中可见广泛钙化,且无症状患者的年龄与有症状患者比较,差异无统计学意义[4]。本例报道的患者其儿子的头颅CT 图像上亦可见钙化,但其儿子没有明显的临床表现。本例患者临床表现为类似脑梗死样的左侧肢体无力,影像学未见新发梗死病灶,考虑源于PFBC 引起的锥体系损害。
PFBC 作为基底节钙化的一种特异性疾病,应与以下疾病相鉴别。①甲状旁腺功能减退,其特点是低血钙,高血磷,且血PTH 极低,头颅CT 检查可见在双侧基底节、小脑的大片状、对称性钙化灶,与PFBC 病的钙化比较类似。②假性甲状旁腺功能减退,这是一种非常少见的基因缺陷病,病因为骨骼和肾小管等靶器官对甲状旁腺激素的作用不敏感;实验室检查可见血清PTH 浓度升高,血钙降低,血磷升高,Ellsworth-Howard 试验阳性。③结节性硬化,该病的临床特点为面部皮脂腺瘤、癫痫发作和智力水平功能下降;CT 检查可见脑室周围钙化灶,边界较清;血生化检验如血钙、血磷在正常值范围内,Ellsworth-Howard 试验阴性[3]。④生理性钙化,其常见于50 岁以上的老年人,且钙化灶比较小,大部分没有临床表现。本例报道的患者及其儿子行电解质及血清PTH 检测均未见明显异常,且头颅CT 表现具有特异性,均不支持上述诊断。综上,本研究报道的病例可明确诊断为PFBC(Fahr 病)。

图2 患者儿子的头颅CT 图像
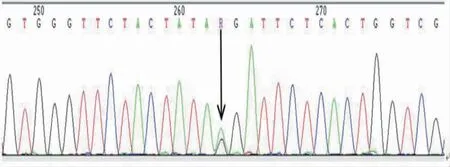
图3 患者儿子的一代测序验证结果(SLC20A2:NM_006749:3 号外显子:c.370G>A:p.G124R)
迄今为止共发现5 个与PFBC 相关的致病基因,分别为溶质载体家族20 成员2(SLC20A2)、血小板衍生生长因子受体β(PDGFRB)、血小板衍生生长因子亚基B(PDGFB)、XPR1、MYORG[5],其中除MYORG 表现为隐形遗传模式外,其余4 个致病基因均表现为显性遗传模式。SLC20A2 基因突变最常见[6],可能是我国特发性基底节钙化的主要致病基因,因此推荐将其作为首选筛查基因。携带相同SLC20A2 基因突变的患者,其颅脑CT 影像的钙化特点以及临床表现可能相似[5]。本例报道的患者其基因检测结果为SLC20A2 基因3 号外显子:c.370G>A:p.G124R。该患者的头颅CT 表现与其儿子相似,但该患者的钙化范围更广,可能提示在遗传基础上病情可随年龄而进展。SLC20A2 突变提示为常染色体显性遗传模式可能大,建议完善患者第三代家属基因检测,并继续随访该家系中患者。
PFBC 进展缓慢,病程较长,在疾病早期无任何临床症状,可不用药,也没有有效药物或其他治疗手段可以改善、延缓或阻止疾病的进展,目前只能对症处理。对PFBC 致病基因及疾病机制的更深入研究或许可以带来新的治疗思路[7-8]。
