NLRP3炎症小体和氧化应激在新生儿缺氧缺血性脑病患者胎盘组织中的表达及其临床意义
2020-04-27韦婷艳杨杰曾宇婷
韦婷艳 杨杰 曾宇婷

[摘要] 目的 研究新生儿缺氧缺血性脑病(HIE)患者胎盘组织中NLRP3炎性小体表达和氧化应激状态,探讨NLRP3炎性小体和氧化应激在HIE中的临床意义。 方法 选择广州市增城区人民医院2010年7月~2019年5月HIE患者胎盘组织(HIE组)及正常胎盘组织(正常组)各30例,免疫组化法检测两组NLRP3表达。取两组新鲜胎盘组织各10例,测定丙二醛(MDA)和超氧化物歧化酶(SOD)浓度。并对两组胎盘组织进行病理学评估。 结果 HIE组胎盘组织中有合体滋养叶细胞结节和有细胞滋养叶细胞的绒毛数量均高于正常组(P < 0.05),而具有血管合体细胞膜的绒毛数少于正常组(P < 0.05)。HIE组胎盘组织中的NLRP3表达量明显高于正常组,差异有统计学意义(P < 0.05)。HIE组的SOD活力低于正常组(P < 0.05),MDA含量高于正常组(P < 0.05)。NLRP3与SOD活力呈负相关(r = -0.63,P = 0.00),而与MDA含量呈正相关(r = 0.74,P = 0.00)。 结论 HIE新生儿胎盘组织中NLRP3炎症小体表达明显增加并存在异常氧化应激,两者存在相关性,其可能是新生儿HIE发生的原因。
[关键词] 缺氧缺血性脑病;NLRP3炎症小体;氧化应激;胎盘
[中图分类号] R714.43 [文献标识码] A [文章编号] 1673-7210(2020)03(b)-0017-04
[Abstract] Objective To investigate the expression and oxidative stress of NLRP3 inflammasomes in the placenta of neonates with hypoxic-ischemic encephalopathy (HIE), and to investigate the clinical significance of NLRP3 inflammasome and oxidative stress in HIE. Methods From July 2010 to May 2019, 30 cases of HIE placental tissue (HIE group) and 30 cases of normal placental tissue (normal group) were selected from Zengcheng District People′s Hospital, Guangzhou, NLRP3 expression was detected by immunohistochemistry. The concentrations of malondialdehyde (MDA) and superoxide dismutase (SOD) were measured in 10 fresh placental tissues, placental tissues of the two groups were pathologically evaluated. Results The number of villi with cytosygotrophoblast nodules and cytotrophoblast cells in the placenta tissues of neonates in HIE group was higher than that of normal group (P < 0.05). The number of villi with cytosomal membrane was less than that of normal group (P < 0.05). The expression level of NLRP3 in HIE group neonatal placenta was significantly higher than that in normal group, and the difference was statistically significant (P < 0.05). SOD activity in HIE group was lower than that in normal group (P < 0.05), and MDA content was higher than normal group (P < 0.05). NLRP3 was negatively correlated with SOD activity (r = -0.63, P = 0.00), while positively correlated with MDA content (r = 0.74, P = 0.00). Conclusion There is a significant increase in the expression of NLRP3 inflammasomes in the placenta of neonates with HIE and abnormal oxidative stress, both of which are correlated, which may be the cause of neonatal HIE.
[Key words] Hypoxic-ischemic encephalopathy; NOD-like receptor protein 3 inflammasomes; Oxidative stress; Placenta
新生兒缺氧缺血性脑病(hypoxic-ischemi cencephalopathy,HIE)是因围生期窒息或缺氧所致的脑血流减少性脑损伤,是新生儿死亡率和并发严重慢性疾病的最重要原因之一[1]。新生儿HIE发病机制复杂,尚未阐明。氧化应激(oxidative stress,OS)由氧化与抗氧化作用失衡导致,在许多疾病中起着核心作用。OS在HIE发病机制和进展中发挥重要作用[2]。脑中枢组织受到多种有害损伤时其固有免疫系统可产生炎性反应,而固有免疫系统中模式识别受体NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体对于炎性反应的诱导起到了重要作用[3]。在新生鼠缺氧缺血性脑损伤模型的脑组织中,NLRP3炎症小体及其下游炎症介质表达升高,NLRP3可能介导和参与新生鼠缺氧缺血性脑损伤病程的发生与发展[4]。目前NLRP3炎症小体在人类新生儿HIE中的作用及相关研究甚少报道。本研究分析新生儿HIE胎盘组织中NLRP3炎症小体表达和OS状态,探讨NLRP3炎症小体和OS在HIE中的作用。
1 资料与方法
1.1 一般资料
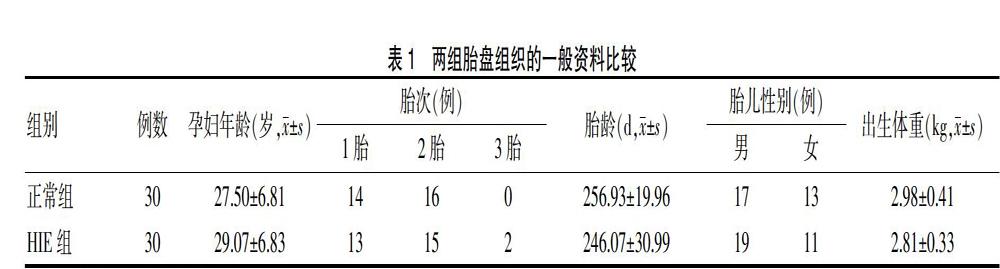
选择2010年7月~2019年5月广州市增城区人民医院(以下简称“我院”)出生的新生儿HIE患者中胎盘组织石蜡块30例为HIE组,其中-80℃冻存的新鲜胎盘组织10例。按照中华医学会儿科学会新生儿学组标准[5],包括前置胎盘10例,胎盘早剥12例,妊娠高血压综合征妊娠6例,多胎妊娠2例。孕龄30~44周,平均(39.00±0.73)周。选取同期在我院出生的正常新生儿的胎盘石蜡组织30例作为正常组,其中-80℃冻存的新鲜胎盘组织10例。两组一般资料比较,差异无统计学意义(P > 0.05),具有可比性,见表1。本研究经我院医学伦理委员会批准并已获得患者监护人知情同意。
1.2 方法
1.2.1 胎盘组织的病理学观察 所有病理石蜡组织均为4%中性甲醛固定,常规石蜡包埋。新鲜胎盘组织切取成小块,生理盐水清洗后于-80℃冻存备用。所有石蜡组织4 μm厚切片,常规HE染色。采用盲法由有经验的高年资病理医师在400×光学显微镜下观察胎盘的病理组织学形态特征,随机观察10个不重复的高倍视野(high power field,HPF)。
1.2.2 免疫组织化学染色 免疫组化试剂盒MaxVisionTM HRP(Mouse/Rabbit)(KIT-5002)、柠檬酸盐抗原修复液(MVS-000),PBS缓冲液(PBS-0060)、DAB显色剂(DAB-0031)均购自福州迈新生物技术开发有限公司。兔抗NLRP3多克隆抗体(ab214185)购自英国Abcam公司。30例HIE新生儿和30例正常新生儿胎盘的石蜡组织4 μm厚切片,常规脱蜡水化,切片浸泡在修复液中高压锅加热3 min,自然冷却后PBS洗5 min×3次,3% H2O2室温孵育10 min,PBS洗3 min×3次,加NLRP3抗体(稀释度1∶200)于37℃水浴箱孵育1 h,PBS洗3 min×3次,加入MaxVisionTM HRP 孵育20 min,PBS洗3 min×3次,显微镜下DAB控色5~10 min,苏木精复染核,常规封片。免疫组化染色结果参照文献[6],高年资病理医师在双盲情况下对切片染色结果进行判读:染色强度按无色、淡黄色、棕黄色和棕褐色依次记0、1、2、3分。同样物镜下计数阳性细胞数,1%~10%记1分,<10%~50%记2分,<50%~75%记3分,>75%记4分。两项得分相乘,满3分为+,4分为++,≥5分为+++,+~+++为阳性表达。
1.2.3 氧化应激指标的检测 从-80℃冰箱分别取出10名HIE新生儿和10例正常新生儿胎盘组织,匀浆处理后2000 r/min离心15 min(离心半径10 cm),取上清检测。超氧化物歧化酶(SOD)(A001-3)和丙二醛(MDA)测试盒(A003-1)均购自南京建成生物工程研究所,检测按照说明书进行,在酶标仪(Thermo ScientificTM,MultiskanTM FC IVD型)450 nm和532 nm波长测定OD值。按试剂盒说明书给定的公式计算SOD活性和MDA含量:SOD活力(U/mgprot)=SOD抑制率(%)÷50%×反应体系稀释倍数(0.24 mL/0.02 mL)×样本测试前稀释倍数;MDA含量(nmol/mgprot)=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度(10 nmol/mL)÷待测样本蛋白浓度(mgprot/mL)。
1.3 统计学方法
采用SPSS 20.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,比較采用两独立样本t检验;计数资料采用百分率表示,比较采用χ2检验。相关性分析采用Spearman等级相关分析。以P < 0.05为差异有统计学意义。
2 结果
2.1 两组胎盘组织病理学观察结果比较
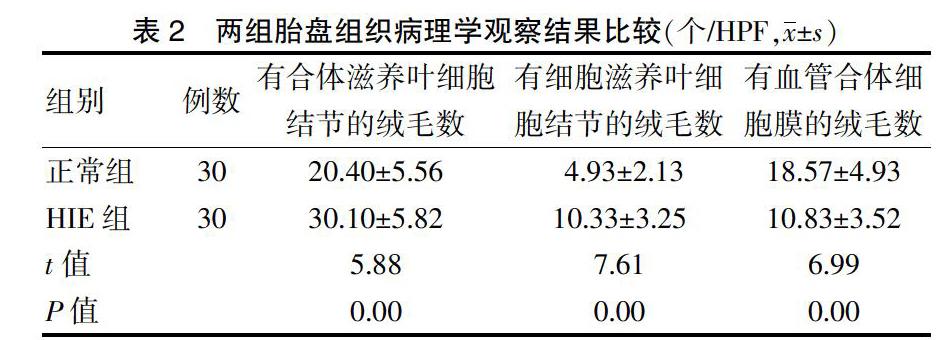
HIE组胎盘组织中有合体滋养叶细胞结节和有细胞滋养叶细胞的绒毛数量均高于正常组(P < 0.05),而具有血管合体细胞膜的绒毛数少于正常组(P < 0.05)。见表2。
2.2 两组胎盘组织中NLRP3的表达情况比较
NLRP3主要表达在胎盘合体滋养叶细胞的细胞质中,呈棕黄色着色(图1,见封三)。HIE胎盘组织中可见不同强度的NLRP3表达,正常胎盘组织中大部分不表达NLRP3,差异有统计学意义(P < 0.05)。见表3。
2.3 两组胎盘组织中SOD和MDA水平比较
HIE组新生儿胎盘组织中SOD活力明显低于正常组(P < 0.05),MDA含量明显高于正常组(P < 0.05)。见表4。
2.4 NLRP3与SOD、MDA的相关性分析
Spearman等级相关分析发现,NLRP3与SOD活力呈负相关(r = -0.66,P = 0.00),NLRP3与MDA呈正相关(r = 0.74,P = 0.00)。
3 讨论
HIE病因复杂,涉及到氧化应激损伤、炎性反应等病理因素[7-9],确切机制尚未阐明。由于新生儿脑内糖原甚少,使其对缺血缺氧极其敏感。胎盘是母体向胎儿供血供氧的唯一通道,胎盘的异常会导致母胎之间血气交换异常,从而影响胎儿生长和发育。本研究显示新生儿HIE的胎盘组织发生了一定程度的病理改变。这些病理改变包括HIE胎盘组织的有合体滋养叶细胞结节和有细胞滋养叶细胞的绒毛数量均高于正常新生儿胎盘,而具有血管合体细胞膜的绒毛数比正常新生儿减少(P < 0.05)。新生儿HIE胎盘的这些病理改变,是由于低氧条件下导致的组织学形态[10]。
目前NLRP3在新生儿HIE胎盘组织中的研究较少。研究报道NLRP3在胎膜早破胎膜及胎盘组织中的表达升高[11]。在新生鼠HIE损伤模型的脑组织中,NLRP3炎症小体及其下游炎症介质表达升高,NLRP3可能介导和参与新生鼠HIE损伤病程的发生与发展[4]。本研究NLRP3在新生儿HIE胎盘组织的表达明显高于正常新生儿胎盘(P < 0.05)。新生儿HIE的发生会伴随炎性反应的出现[12],而炎症的发生离不开炎症小体的参与[13-14]。NLRP3炎症小体调控产生的多种炎症介质和因子介导免疫炎性反应,从而产生一系列的级联放大作用,促进炎性反应和组织损伤进程[15]。作为母体向胎儿供血供氧的唯一通道,胎盘组织中NLRP3炎症小体的表达增高,有可能通过激活下游多种炎症介质和因子,通过级联放大作用介导脑部免疫炎性反应和组织损伤,从而引起后续的HIE,但有待进一步研究证实。
正常妊娠期的氧化和抗氧化作用保持相对平衡,不会产生过度的OS[16-17]。有研究已证实OS在新生儿HIE的发生、发展中起重要作用[18-19]。本研究显示新生儿HIE胎盘的SOD活力明显低于正常新生儿胎盘的,MDA含量明显高于正常新生儿胎盘组织,显示新生儿HIE胎盘组织中存在过度OS。MDA是细胞膜磷脂中的多不饱和脂肪酸在受到活性氧攻击后发生脂质过氧化反应的最终产物,其水平升高说明组织中活性氧含量过多,被认为是检测活性氧水平的指标[20]。SOD是体内极为重要的抗氧化酶,具有强大的清除氧自由基的能力,SOD的活性在抵抗氧化剂产生及氧自由基中起着根本性的作用[20]。推测胎盘存在缺血缺氧后,导致活性氧产生,并且迅速增加的活性氧抵抗抗氧化剂的防御,最终导致过度的OS反应。
本研究NLRP3与SOD活力呈密切负相关性,相反,与MDA呈密切正相关性。提示新生儿HIE胎盘中同时存在炎性反应与OS,且二者相关性好。推测新生儿HIE胎盘组织中NLRP3炎症小体表达明显增加和存在异常OS可能是新生儿HIE发生的原因。进一步研究炎性反应体和OS在新生儿HIE中的作用机制,将有望为预防和治疗新生儿HIE提供新策略。
[参考文献]
[1] 王鑫,姜泓.新生儿缺氧缺血性脑病的病因和发病机制研究进展[J].新乡医学院学报,2019,36(2):194-197.
[2] Zhao M,Zhu P,Fujino M,et al. Oxidative Stress in Hypoxic-Ischemic Encephalopathy:Molecular Mechanisms and Therapeutic Strategies [J]. Int J Mol Sci,2016,17(12):2078.
[3] Schroder K,Kanneganti TD,Shao F,et al. Mechanism and Consequences of Inflammasome Activation [J]. J Mol Biol,2018,430(2):131-132.
[4] 李晓光,王茉琳,罗文哲,等.NLRP3炎性小体在缺氧缺血新生大鼠脑组织中的表达及意义[J].中华行为医学与脑科学杂志,2017,26(1):13-16.
[5] 中华医学会儿科学会新生儿学组.新生儿缺氧缺血性脑病诊断依据和临床分度[J].中国实用儿科杂志,2000,15(6):379-380.
[6] 高鹏,莫春艳,龚洵,等.复发性流产患者绒毛和蜕膜中NLRP3炎症小体的差异性表达研究[J].现代妇产科进展,2018,27(10):762-765.
[7] Al Mamun A,Yu H,Romana S,et al. Inflammatory Responses are Sex Specific in Chronic Hypoxic-Ischemic Encep-halopathy [J]. Cell Transplant,2018,27(9):1328-1339.
[8] Al-Shargabi T,Govindan RB,Dave R,et al. Inflammatory cytokine response and reduced heart rate variability in newborns with hypoxic-ischemic encephalopathy [J]. J Perinatol,2017,37(6):668-672.
[9] Thurmond P,Yang JH,Li Y,et al. Structural modifications of the prostate in hypoxia,oxidative stress,and chronic ischemia [J]. Korean J Urol,2015,56(3):187-196.
[10] 谭运福,崔颖鹏.新生儿缺氧缺血性脑病的胎盘组织学定量学改变[J].实用医学杂志,2004,20(6):627-628.
[11] 季美芸,卢红.NOD样受体蛋白3、Toll样受体2在胎膜早破患者胎盘和胎膜组织中的表达及其臨床意义[J].广西医学,2019,40(1):33-38.
[12] Yu-fei NI,Qiu-yan GU,Xiao-qin LI. Research Progress of Mechanism and Treatment of Neonatal Hypoxic-Ischemic Encephalopathy [J]. J Int Transl Med,2017,5(3):117-122.
[13] Schroder K,Kanneganti TD,Shao F,et al. Mechanism and Consequences of Inflammasome Activation [J]. J Mol Biol,2018,430(2):131-132.
[14] Coll RC,O′Neill L,Schroder K. Questions and controversies in innate immune research:what is the physiologicalrole of NLRP3? [J]. Cell Death Discov,2016,2(1):16019.
[15] Mangan MSJ,Olhava EJ,Roush WR,et al. Targeting the NLRP3 inflammasome in inflammatory diseases [J]. Nature Reviews Drug Discovery,2018,17(9):588-608.
[16] de Andrade Ramos BR,Witkin SS. The influence of oxidative stress and autophagy cross regulation on pregnancy outcome [J]. Cell Stress Chaperones,2016,21(5):755-762.
[17] Lisha S,Pammal RS,Indu M,et al. Oxidative stress during early pregnancy and birth outcomes [J]. Public Health Nutr,2016,19(17):3210-3215.
[18] Zhao M,Zhu P,Fujino M,et al. Oxidative Stress in Hypoxic-Ischemic Encephalopathy:Molecular Mechanisms and Therapeutic Strategies [J]. Int J Mol Sci,2016,17(12):2078.
[19] Qin X,Cheng J,Zhong Y,et al. Mechanism and Treatment Related to Oxidative Stress in Neonatal Hypoxic-Ischemic Encephalopathy [J]. Front Mol Neurosci,2019, 12:88.
[20] 苗绘,孙艳美,张萍萍,等.酶抗氧化系统与复发性流产关系的研究进展[J].山东医药,2018,58(21):98-10.
(收稿日期:2019-09-04 本文编辑:封 华)
