对比基于PET/CT的不同方法定性诊断孤立性肺结节的效能
2020-04-27田蓉蓉杜红彦
马 宁,赵 铭,田蓉蓉,刘 洋,李 娟,杜红彦
(1.山西医科大学医学影像学系,山西 太原 030001;2.山西省肿瘤医院PET/CT中心,山西 太原 030013;3.新郑市中医院肿瘤院区医学影像科,河南 新郑 451150)
定性诊断孤立性肺结节(solitary pulmonary nodule, SPN)一直是影像医学比较棘手的问题。高分辨率CT(high resolution CT, HRCT)及PET/CT可清楚显示结节密度、边缘特征、周围关系及代谢信息,是诊断SPN的主要影像学手段。数学诊断模型可客观预测SPN危险程度。目前国内外已有多个依靠临床信息及CT特征的SPN诊断模型[1-2]。本研究拟建立以临床信息、HRCT及PET/CT资料为基础的定性诊断SPN模型,并比较观察其与PET/CT及HRCT对SPN的诊断效能。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月—2019年3月山西省肿瘤医院收治的161例因无法定性诊断而进一步接受PET/CT检查的SPN患者,男91例,女70例,年龄27~85岁,平均(60.8±9.7)岁。纳入标准:①肺部单发结节且结节最大径5~30 mm;②无纵隔疾病或淋巴结肿大;③无肿瘤病史;④有明确病理诊断结果。
1.2 仪器与方法 采用GE Discovery STE 16排PET/CT扫描仪,显像剂为18F-FDG,放射化学纯度>95%。检查前嘱患者禁食6 h以上,使其空腹血糖<12 mmol/L,经静脉注射18F-FDG,剂量0.12 mCi/kg体质量,待患者平息静卧50~60 min后行全身PET/CT显像,扫描范围自颅顶至股骨上段。首先行低剂量MSCT扫描并PET采集图像,管电压120 kV、管电流180 mA,MSCT图像重建层厚3.75 mm,PET图像采集7~8床位/例,2.5~3.0分钟/床位。1 h后对靶结节行直接HRCT扫描及PET延迟期扫描,管电压120 kV,管电流300 mA,HRCT扫描重建层厚0.625 mm。将图像传输至AW及Xeleris工作站,并进行图像融合。
1.3 图像分析 分别由1名影像科医师(高年资主治医师)和1名核医学科医师(副主任医师)对HRCT及PET/CT图像(图1、2)进行独立阅片。观察HRCT有无显示恶性征象,包括分叶、毛刺、胸膜牵拉、气管血管集束等;记录病灶及纵隔血池的最大标准化摄取值(maximum standard uptake value, SUVmax),如病灶SUVmax高于纵隔血池则计为恶性。
1.4 统计学方法 采用SPSS 20.0和MedCalc1 5.0软件进行统计学分析。以±s表示患者年龄,采用两独立样本t检验对良恶性SPN患者进行比较。以中位数(上下四分位数)表示最大径及SUVmax,采用Mann-WhitneyU检验进行比较。对HRCT征象采用χ2检验进行比较。将良恶性SPN之间差异有统计学意义的变量纳入多因素Logistic回归分析,采用Enter法将P<0.05的自变量纳入SPN数学诊断模型。以MedCalc1 5.0绘制HRCT、PET/CT及模型的ROC曲线并计算AUC,以Z检验比较三者的诊断效能。P<0.05为差异有统计学意义。
2 结果
161例SPN中,经病理诊断恶性131例,包括腺癌107例、鳞癌22例、小细胞肺癌2例;良性30例,其中炎性假瘤7例、错构瘤8例、结核6例、硬化性肺细胞瘤2例、化脓性炎症7例。PET/CT诊断恶性136例、良性25例,其中2例假阴性(病理诊断腺癌),7例假阳性(病理诊断炎性假瘤及结核各3例,化脓性炎症1例);其诊断恶性SPN的灵敏度、特异度及准确率分别为98.47%(129/131)、76.67%(23/30)及94.41%(152/161)。HRCT诊断恶性83例、良性78例,其中53例假阴性(病理诊断腺癌39例、鳞癌12例、小细胞癌2例),5例假阳性(病理诊断错构瘤及炎性假瘤各2例、化脓性炎症1例);其诊断恶性SPN的敏感度、特异度及准确率分别为59.54%(78/131)、83.33%(25/30)及63.98%(103/161)。
单因素分析显示,恶性SPN患者年龄、结节直径及SUVmax均高于良性SPN(P均<0.05)。在HRCT征象方面,恶性SPN分叶、毛刺、胸膜牵拉、气管血管集束出现比例均高于良性,而良性SPN内部脂肪、钙化比例高于恶性(P均<0.05);见表1。
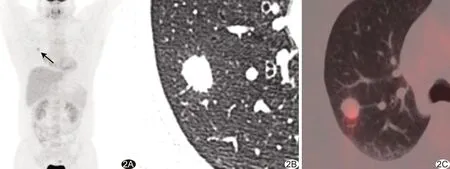
图2 患者男,41岁,右肺上叶炎性假瘤,FDG低摄取(箭),SUVmax=3.49 A.MIP; B.HRCT; C.PET/CT融合图像
二元Logistic回归分析结果显示,SUVmax、患者年龄、钙化及气管血管集束是良恶性SPN的独立预测因子(P均<0.05);见表2。建立回归方程(即数学诊断模型)为:X=-5.54+0.31×SUVmax+0.06×年龄+1.32×气管血管束-2.66×钙化。选取截断值P=0.843时,Youden指数最大,模型诊断恶性SPN的敏感度、特异度及准确率分别为82.44%(108/131)、86.67%(26/30)及83.23%(134/161)。
ROC曲线结果显示,模型PET/CT及HRCT诊断恶性SPN的AUC分别为0.909、0.876及0.714,见图3;模型及PET/CT的AUC高于HRCT(Z=5.751、3.095,P<0.001、=0.002),模型与PET/CT间AUC差异无统计学意义(Z=0.726,P=0.468)。
3 讨论
随着CT设备的普及与人群健康意识的增加,越来越多的SPN患者在体检或因其他疾病而接受的筛查中被发现,健康人群中SPN总检出率约31%,其中绝大多数为良性,恶性比例仅为1.0%~1.5%[3]。

图3 数学模型、PET/CT及HRCT诊断恶性SPN的ROC曲线
HRCT可清楚显示SPN内部及边缘特征,分叶征、空泡、细短毛刺、胸膜牵拉及气管血管集束等均为具有代表性的恶性征象,大多与肿瘤细胞生长浸润方式密切相关,如肿瘤细胞在肺泡壁间不同程度播散及结缔组织增生在HRCT图像上表现为分叶或细短毛刺改变[4]。本组分叶、毛刺、胸膜牵拉及血管集束在恶性SPN中出现比例较高,与既往文献[5-6]报道基本一致;但良恶性SPN之间病变位置(左肺或右肺、上叶或中下叶)无明显差异,与既往研究[5-6]有所不同,可能与观察对象存在个体差异有关。本研究HRCT诊断恶性SPN的准确率仅63.97%,与既往研究[7]结果相近,提示单纯依据HRCT恶性征象定性诊断SPN效果不佳。
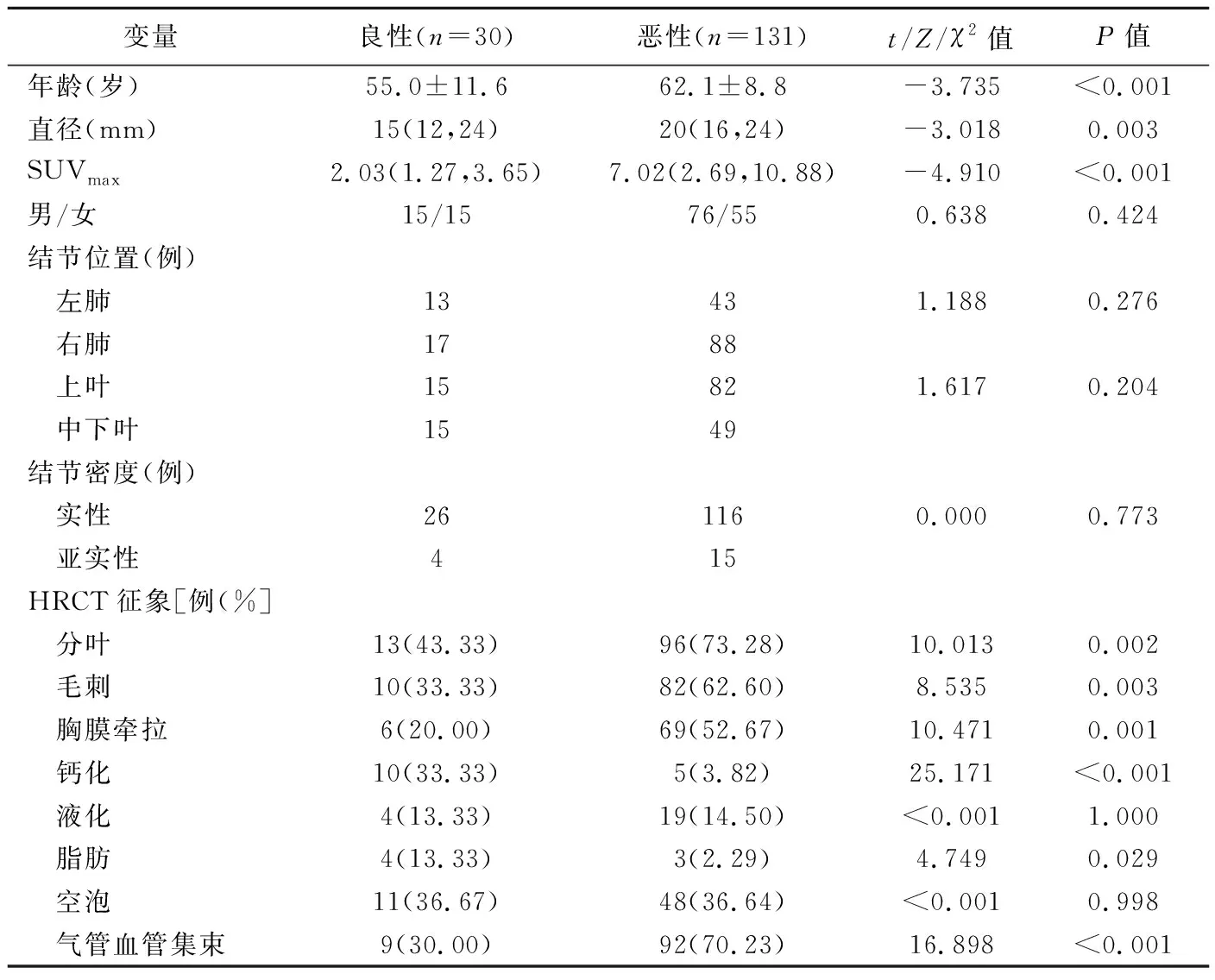
表1 良恶性SPN患者相关资料
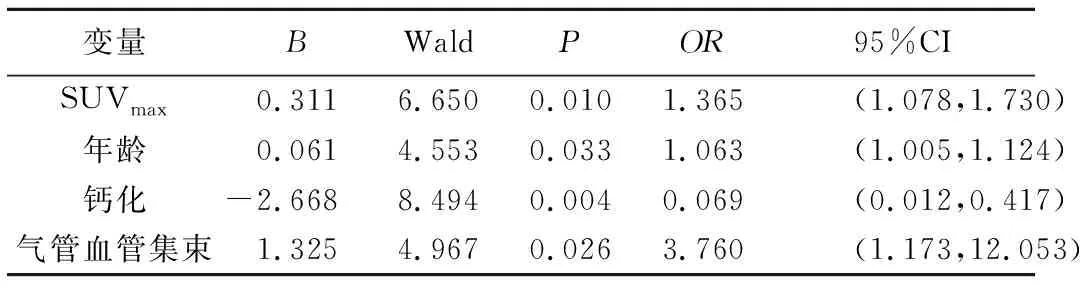
表2 多因素Logistic回归分析结果
美国放射学院2019版Lung-RADS 1.1和弗莱希纳(Fleischner)学会2017版肺结节随访指南提出,对于直径≥8 mm的肺结节均有必要行PET/CT检查[8-9]。恶性肿瘤细胞增殖旺盛,导致代谢水平高于良性,通常SUVmax>2.5的结节倾向于诊断恶性。本研究中鉴别诊断良恶性SPN的SUVmax阈值为5.38,可能与本组良性SPN中活动性炎症(7/30,23.33%)占比较大有关。结合形态变化和代谢特征,本组PET/CT诊断恶性SPN的灵敏度达98.47%,但特异度较低(76.67%),提示存在过度治疗风险。本研究中42.86%(3/7)炎性假瘤和50.00%(3/6)结核被误诊,可能与18F-FDG并非恶性肿瘤特异性显像剂相关,如炎性假瘤主要以肌纤维母细胞、浆细胞等组成而导致FDG高摄取,且形态特征与恶性肿瘤相似[10-11]。
数学模型诊断 SPN以其客观性、易获得性和可重复性等优点成为研究热点,如国外应用广泛的Mayo模型和VA模型[1];但Mayo模型过多关注患者临床信息,对SPN本身形态特征关注不足,而VA模型样本全部来自于退伍军人,且获得最终病理结果的样本量较少。本研究分析15个临床信息和影像学征象,并将单因素分析结果显示差异有统计学意义的9个变量纳入多因素分析,最终仅SUVmax、患者年龄、气管血管集束和钙化被纳入模型,其中气管血管集束与恶性SPN的相关度最高(OR=3.760)。气管血管集束与新生肿瘤组织分裂增殖活跃相关,在周围型肺癌中的出现率为37%~83%,肿瘤细胞所需血供和氧气远大于正常细胞,其分泌的血管生长因子诱导新生血管形成,表现为肺内纹理向病变处纠集后消失甚至穿透结节[10]。程远等[2]对362例SPN患者进行建模观察,并将钙化作为保护因素纳入模型,其偏回归系数为-1.532,优势比OR为0.216。本组中发现结节中存在钙化亦提示良性SPN。Fleischner学会[6]与Lung-RADS 1.1[9]也提出SPN中出现钙化灶多为良性。SPN直径作为单独预测因素被纳入Mayo和VA模型,但在本研究中,虽然单因素分析显示良恶性SPN直径差异有统计学意义,但多因素分析时并未显示其具有诊断价值,可能与本组SPN直径多为10~30 mm、而5~10 mm者仅占4.97%(8/161)有关,也可能与Mayo和VA模型作为初筛评价标准而纳入了良性病例更多有关。既往研究[12]显示亚实性SPN可能是肺腺癌的早期表现,特别是在女性和非吸烟患者中,但本研究中良恶性SPN在患者性别和结节密度方面未见明显差异,可能与本组亚实性病变占比较少(19/161,11.80%)有关,需要更大样本量进一步分析。
综上所述,气管血管集束、患者高龄及SUVmax增高是恶性SPN的重要征象。PET/CT定性诊断SPN的效能优于HRCT,对于HRCT难以定性的SPN患者,有必要行PET/CT检查。基于PET/CT所建数学模型的诊断价值与PET/CT相仿,且特异度更高,临床医师可在PET/CT基础上纳入该模型加以效验,以作出最佳诊断。
