癌基因C-jun及其缺失突变体过表达细胞株的构建与鉴定
2020-04-27余斯琦朱长军
余斯琦,朱长军
(1.天津师范大学生命科学学院, 天津 300387; 2.天津师范大学天津市动植物抗性重点实验室, 天津 300387;3.天津师范大学 分子细胞系统生物学重点实验室,天津 300387)
转录因子C-jun 基因作为原癌基因, 在多种癌变器官中呈现高表达,如肺癌、宫颈癌、乳腺癌[1-4]等.C-jun 在子宫内膜癌中的表达量也较高, 并且能够与类固醇生成因子1 和肝脏受体同源物1 结合促进子宫内膜癌的增殖.研究[5-6]表明,C-jun 的表达水平与患者临床病理特征和预后密切相关, 预示着C-jun 可作为肿瘤发生发展的重要指标.
C-jun 全长331 个氨基酸,包括两大功能域:转录因子激活功能域和亮氨酸拉链bZIP 功能域(含DNA结合功能域), 属于Jun 家族蛋白.Jun 家族成员主要包括 C-Jun、Jun B 和 Jun D.Jun 家族可与 Fos 家族(包括 C-Fos、Fos B、Fra1 和 Fra2)通过亮氨酸拉链 bZIP 结构组成二聚体,其中最为稳定的转录因子二聚体AP-1就是由C-jun 和C-Fos 聚合而成[1].C-jun 在细胞中参与调控细胞增殖、分化、凋亡等重要生理过程[7],它主要通过行使自身的转录功能来调控多种蛋白的表达,进而完成对细胞生理过程的调节.当它发挥转录功能时,C-jun 氨基端激酶(JNK)对 C-jun 的 N 端进行磷酸化,使其能够二聚化形成同型或异型二聚体[1],并增强其二聚体的稳定性,进而促进转录[8].C-jun 在细胞中能够转录 WT1[9-10]、Keratin 5[11-12]、Id2A[13-14]等多种与细胞生理活动相关的蛋白.其中,C-jun 通过转录WT1,使得WT1 在有丝分裂时期与MAD2、BUBR1 等结合,从而抑制细胞有丝分裂后期促进复合物APC(anaphase promoting complex)对 Cyclin B1 的降解作用[10].因此,C-jun 对于细胞的正常生长分裂具有重要意义.
C-jun 作为一个重要的转录因子, 其下游靶基因已见文献报导,这些基因都参与细胞分化[15]、增殖[10]、凋亡[16]等重要生命过程.本研究通过细胞转染、点突变、药物筛选等方法,获得Flag-C-jun 和Flag-C-junmut稳定表达的HelaS 细胞株, 并用蛋白印记杂交和细胞免疫荧光染色方法对细胞株进行验证,为进一步筛选转录因子C-jun 的下游靶基因, 研究其调控细胞生命活动的作用机制奠定实验基础.
1 材料与方法
1.1 材料与试剂
1.1.1 质粒和细胞
pFlag-c-jun 表达质粒, 购于优宝生物公司;HelaS细胞,由天津师范大学分子细胞系统生物学重点实验室提供.
1.1.2 主要试剂和工具酶
Phanta Max Super-Fidelity DNA Polymerase(Phanta Max 超保真 DNA 聚合酶),美国 Vazyme 公司;BamH1、Xho1 限制性内切酶、转染试剂Turbofect,美国Thermo Scientific 公司;琼脂糖(REGULAR AGAROSE G-10),法国 BIOWESTE 公司; Gelred,美国 Biotium 公司;DMEM 细胞培养基,以色列Biological Industries 公司;FBS,美国HyClone 公司;G418,北京索莱宝科技有限公司;Opti-MEM 培养基,美国 Gibico 公司;Super DNA Marker,北京康为世纪生物科技有限公司.
1.2 方法
1.2.1 Flag-C-jun DNA 结合功能域缺失突变体质粒的引物序列设计
以NCBI 上提供的C-jun cDNA 参考序列(NM_002228)作为模板,根据其DNA 结合功能域位置设计点突变PCR 引物,引物序列如表1 所示,引物由中美泰和生物技术(北京)有限公司合成.
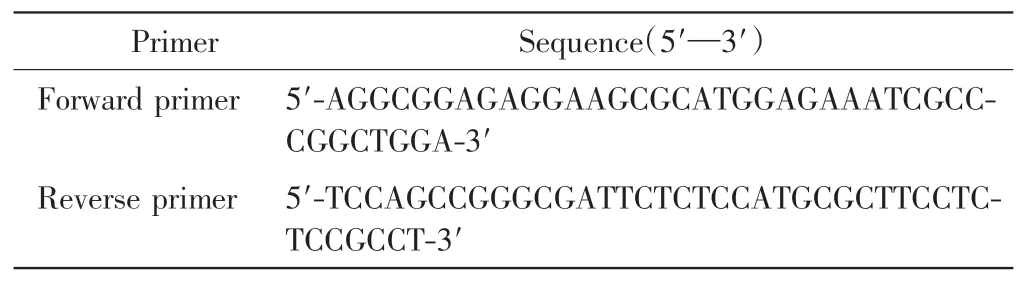
表1 pFlag-C-jun DNA 结合功能域缺失突变体质粒引物设计Tab.1 Primer design of pFlag-C-jun DNA binding domain deletion mutant
1.2.2 点突变
以pFlag-c-jun 质粒为模板,加入Phanta Max 超保真 DNA 聚合酶、dNTP、 引物、buffer 进行 PCR 扩增.PCR 扩增程序如下:95 ℃ 30 s 预变性,95 ℃ 30 s 变性,64 ℃ 1 min 退火,72 ℃ 7 min 延伸,16 个循环;72 ℃10 min 终延伸,4 ℃保存.得到的PCR 产物进行1%琼脂糖凝胶电泳,验证无杂带后用Dpn I 酶切1 h(水浴37 ℃),再次 DNA 电泳验证无误后,将 PCR 产物转入感受态细胞进行扩增, 所得质粒送至生物公司测序,验证无误后获得突变体质粒.
1.2.3 质粒转染
用含 10%FBS 的 DMEM 培养 HelaS 细胞.将HelaS 细胞接种于24 孔板中,每孔3×104个细胞,24 h后将配制好的转染试剂(每孔含质粒250 ng、Turbofect 0.5 μL、Opti-MEM 100 μL) 边摇边加至 24 孔板中,放入细胞培养箱(CO2体积分数为5%, 37 ℃)中培养24~48 h.
1.2.4 稳筛细胞株的构建
将HelaS 细胞接种于24 孔板中,每孔细胞数量为3×104个,铺4 个孔.其中,空白对照和转染pFlag-c-jun或pFlag-c-junmut质粒各2 个孔,48 h 后从空白对照和质粒转染的细胞中各取一孔做Western blot, 测定Flag-C-jun 蛋白表达.将另一孔中的细胞(对照细胞和转染后的细胞) 用胰酶消化后转至10 cm 平板使细胞分散开,用含有750 ng/μL G418 的 DMEM 进行培养.5 d 后换液, 直至细胞形成单克隆.挑取细胞克隆至24 孔板进行培养.细胞正常生长后,取1/2 细胞进行Western blot 检测是否有 Flag-C-jun 或 Flag-C-junmut的表达,将能够表达Flag-C-jun 或Flag-C-junmut的细胞转至10 cm 平板进行正常细胞传代培养.
1.2.5 蛋白质印迹杂交
用配制的SDS 裂解液收集细胞,得到全细胞裂解液后经SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,再通过半干型转印电泳槽将蛋白转至PVDF 膜,转膜1 h.脱脂奶粉封闭 0.5 h,一抗室温孵育 2 h(M α tubulin,RT 2 h;M α Flag,RT 2 h),TBST 洗 3 次,二抗室温孵育 1 h(G α mouse HRP),加入 ECL 和过氧化氢后曝光.
1.2.6 细胞免疫荧光染色
细胞计数后,在细胞爬片上每孔铺3×104个细胞,待密度大约为80%~90%时取出爬片,PBS洗3次,用甲醇-丙酮固定液固定5 min,再次用PBS 清洗3 次.用山羊血清配成的封闭液封闭0.5 h,用0.1% PBS-TX洗3 次.加入0.1% PBS-TX 稀释的一抗稀释液, 室温孵育 2 h(M α Flag,RT 2h).PBS-TX 洗 3次,加入0.1% PBS-TX 稀释的二抗稀释液, 室温避光孵育1 h.二抗结束后, 加入 0.1% PBS-TX 稀释的DAPI,0.1%PBS-TX 洗3 次后加入抗荧光猝灭剂, 用指甲油将细胞爬片的周围密封,置于荧光显微镜下观察.
2 结果与分析
2.1 真核细胞表达质粒pFlag-c-jun的酶切鉴定
pFlag-c-jun 质粒全长 6 445 bp,其中 c-jun 的 cD NA全长为996 bp.根据图1 的质粒图谱可以看出,pFlag-c-jun 质粒经BamH1 和Xho1 双酶切后,通过1%琼脂糖凝胶电泳能够看到一条约为1 005 bp 的条带,与目的基因的长度大致相符,同时还有一条长度约为5 440 bp 的条带,与载体片段大小一致,因此酶切验证该质粒正确.
2.2 构建Flag-c-jun DNA结合功能域缺失突变体质粒pFlag-c-junmut
根据NCBI 上查找到的C-jun 的DNA 结合功能域(图2),通过点突变的方式将该区域去除,琼脂糖凝胶电泳验证后(图3),用获得的质粒转化感受态细菌.将生长的单克隆细菌小量扩增后小提质粒,送至生物公司测序.通过比对测序结果可以得知, 本研究已成功将C-jun DNA 结合功能域去除(图4).

图1 质粒pFlag-c-jun 的酶切鉴定结果Fig.1 Identification of plasmid of pFlag-c-jun
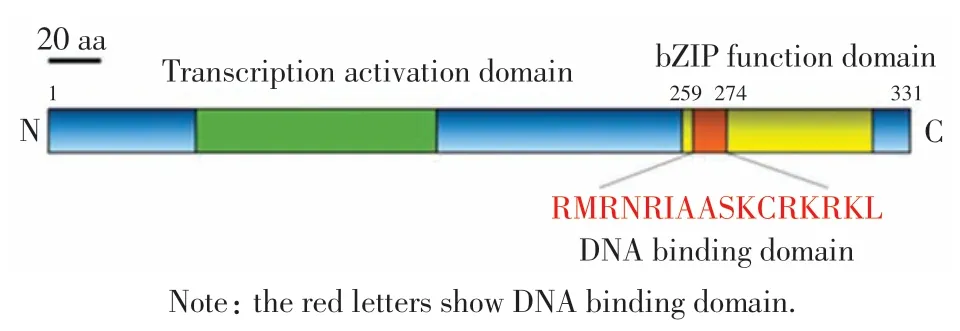
图2 C-jun 的氨基酸序列Fig.2 Amino acid sequence of C-jun
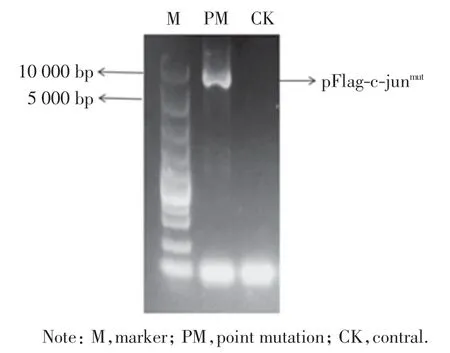
图3 pFlag-c-junmut 点突变琼脂糖凝胶电泳结果Fig.3 Agarose gel electrophoresis results of pFlag-c-junmut point mutation

图4 pFlag-c-junmut 点突变测序结果比对Fig.4 Alignment of pFlag-c-jun and pFlag-c-junmut sequences
2.3 Flag-C-jun和Flag-C-junmut稳定表达细胞株的构建
成功得到真核细胞表达质粒pFlag-c-jun 和pFlag-c-junmut后, 构建能够稳定表达 Flag-C-jun 和Flag-C-junmut的稳筛细胞株.分别转染pFlag-c-jun 和pFlag-c-junmut质粒,48 h 后收集细胞进行 Western blot,结果如图5 所示.由图5 可以看出,2 个质粒在转染48 h 后均有表达.随后用含有G418 的培养液继续培养,挑取单克隆移至24 孔板后, 收集部分细胞进行蛋白表达检测, 以瞬时转染的pFlag-c-jun 和pFlag-c-junmut作为对照, 直至选出能够稳定表达Flag-C-jun 和Flag-C-junmut的细胞株.由图6 可以看出, 转染了质粒pFlag-c-jun 的细胞中,1 号细胞株能够稳定表达Flag-C-jun.由图7 可以看出, 转染了pFlag-c-junmut的细胞中,2 号细胞株能够稳定表达Flag-C-junmut.随后对2个筛选出来的细胞株进行免疫荧光染色, 结果如图8所示.由图8 可以看出, 细胞中有Flag-C-jun 和Flag-C-junmut的稳定表达,且均在细胞核内.
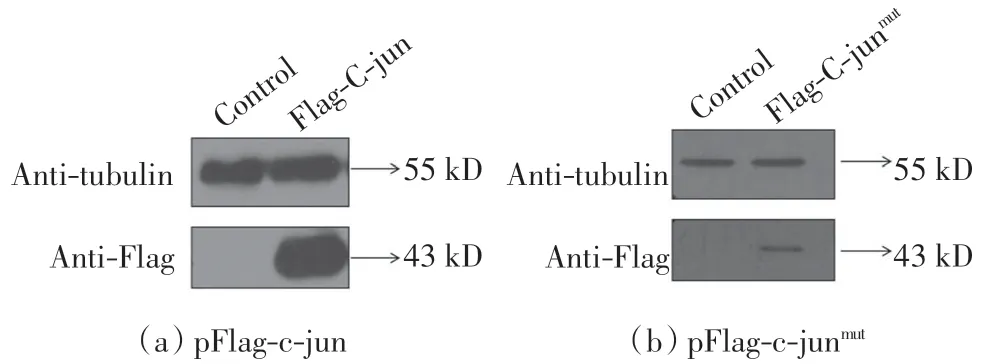
图5 pFlag-c-jun 和pFlag-c-junmut 质粒转染后Western blot 结果Fig.5 Western blot results of transfection of pFlag-c-jun or pFlag-c-junmut

图6 Flag-C-jun 稳定表达细胞株的构建Fig.6 Congstruction of Flag-C-jun cell lines
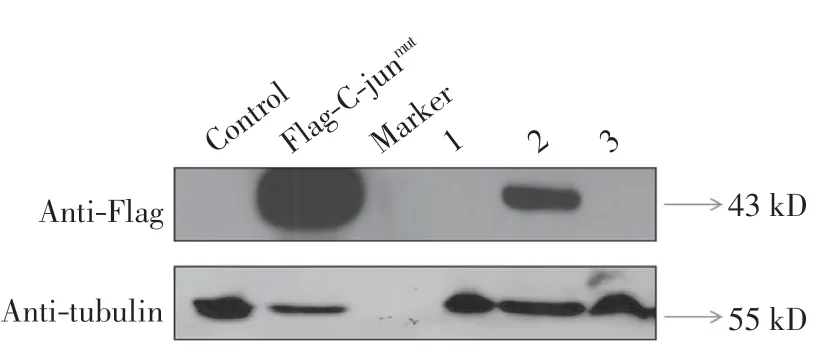
图7 Flag-C-junmut稳定表达细胞株的构建Fig.7 Construction of Flag-C-junmut cell lines

图8 Flag-C-jun 和Flag-C-junmut 稳定表达细胞株的免疫荧光染色Fig.8 Immunofluorescence staining of Flag-C-jun and Flag-C-junmut stable expressed cell lines
3 讨论
C-jun 是一种转录因子,同时也是促分裂原活化蛋白激酶(MAPK)信号通路的下游关键成员之一.C-jun 参与调节多种细胞功能,包括细胞增殖、存活、分化、对紫外线辐射的反应、免疫反应和炎症等.C-jun可以帮助乙酰转移酶募集到RUNX2 启动子,进而完成对组蛋白3 特定位点的乙酰化促进RUNX2 的转录[17];NMB(Neuromedin B)促进 C-jun 磷酸化,能够诱导COX-2 和 IL-6 的表达上调[18];C-jun 是激活 AXL 的必不可少的转录因子, 促进与耐药相关的STC2-JUNAXL-ERK 通路[19];C-jun 还参与 p53 的负调控,通过抑制p53 的表达降低p21 的积累,使得细胞周期能够顺利进行[20].
由于C-jun 在多个生理过程中都发挥着重要作用,因此作为一个转录因子,其转录底物的研究非常重要.本研究通过点突变的方法,将C-jun 序列中的DNA结合功能域切除, 使C-jun 无法形成二聚体与DNA 结合.在此基础上,分别构建了能够稳定表达Flag-C-jun和Flag-C-junmut的细胞株.这些细胞株的构建有助于进一步通过ChIP 实验研究转录因子C-jun 的下游关键靶基因, 为更加清晰深入地认识C-jun 的生物学功能提供实验基础.
