小麦与白粉菌互作中TaSTPK-CCR3基因功能的初步研究
2020-04-27冯静云黄建国张超群张露露尚云涛范宝莉刘晓颖王振英
冯静云, 牛 欢, 黄建国, 张超群, 张露露,尚云涛, 范宝莉, 刘晓颖, 王振英
(1.天津师范大学生命科学学院,天津 300387;2.天津师范大学 天津市动植物抗性重点实验室,天津 300387;3.天津师范大学 天津市水资源与水环境重点实验室,天津 300387)
小麦是世界上广泛栽培的农作物之一,布氏白粉菌(Blumeria graminis f.sp.Tritici)可引起小麦真菌病害,严重时可造成13%~34%的减产[1].研究病原菌与小麦互作的分子机理有助于获得更多的抗病种质资源,培育抗病品种,从根本上解除白粉病对小麦产量造成的危害.
在长期进化过程中,植物自身形成了一套抵抗外界病原菌感染的免疫防御系统,包括分子模式触发的免疫反应(pattern-triggered immunity,PTI)和效应子触发的免疫反应(effector-triggered immunity,ETI)[2-3].植物在受到病原菌侵染时会发生PTI 反应, 导致植物体内发生一系列变化, 从而激活下游反应通路.蛋白激酶作为防御系统的重要组成部分, 在植物生长发育、识别病原体等方面起到十分关键的作用[4-5].目前,根据底物蛋白被磷酸化的氨基酸残基种类,将真核生物的蛋白激酶大致分为:①丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase, STPK);②酪氨酸蛋白激酶(tyrosine proteinkinase,TPK);③组氨酸蛋白激酶;④色氨酸蛋白激酶;⑤天冬氨酞基/谷氨酞基蛋白激酶[6].蛋白激酶家族基因能够参与不同植物的防御反应,在植物代谢过程中起到重要作用.2011 年,Cao 等[7]在小麦-簇毛麦易位系T6VS.6AL 中,克隆得到Stpk-V,该基因编码丝氨酸/苏氨酸蛋白激酶, 定位在Pm21 核心区,过表达该基因可明显提高感病小麦Yangmai 158 的抗病性.2016 年,杨亚洲[8]从小麦的cDNA 文库中分离得到TaTPK 蛋白激酶基因,通过基因转化成功获得了T6代转基因小麦株系,发现该基因具有抗旱、耐高盐双重特性.蛋白激酶是一类庞大的家族, 有着复杂的调控机制.其中,蛋白激酶 C(protein kinase C,PKC)在细胞生长分化、 代谢发育等过程起到重要的调节作用.2003 年,Dickman 等[9]利用 4 种 PKC 特异性抑制剂,发现PKC 表达降低后,紫花苜蓿炭疽病病原菌的孢子萌发和附着胞的形成受到抑制.2011 年,赵巍[10]同样利用PKC 特异性抑制剂,发现PKC 基因表达被抑制后,玉米大斑病菌孢子的萌发率及附着胞形成受到了严重影响.上述研究均表明,PKC 在病原菌孢子萌发、附着胞芽管侵入宿主细胞以及成功侵染宿主后形成次级菌丝等方面发挥着重要作用.
本课题组利用cDNA-AFLP 技术研究抗病小麦和感病小麦对白粉菌胁迫的基因表达差异时,在感病材料中获得了1 个表达下调基因片段[11].本研究以该片段为基础,结合中国春小麦的基因组信息,克隆了1 个STPK-CCR3 基因.通过生物信息学、 白粉菌侵染后该基因的表达模式以及基因沉默分析,探究该基因在小麦与病原菌互作过程中发挥的作用.研究丰富了病原菌与植物互作的信息资源, 为STPK-CCR3 基因在小麦分子育种中的应用提供理论支持.
1 材料和方法
1.1 材料
植物材料为白粉病敏感品种小麦京411; 菌株为白粉菌生理小种E09; 病毒材料为大麦条纹花叶病毒(barley stripe mosaic virus,BSMV).
1.2 试剂
RNAiso Plus Total RNA 提取试剂、高保真 DNA 聚合酶、质粒提取试剂盒、琼脂糖凝胶DNA 回收试剂盒和DNA marker 等购自大连宝生物工程有限公司;Ribo-MAX Large Scale RNA Production-T7 试剂盒和M-MLV反转录相关试剂等购自美国Promega 公司.
1.3 引物
由金唯智生物科技有限公司天津分公司合成相关引物,序列信息如表1 所示.

表1 引物序列Tab.1 Sequence of primer
1.4 TaSTPK-CCR3基因克隆及序列分析
提取小麦京411 总RNA,琼脂糖凝胶电泳检测RNA 的完整性,Nanodrop1000 检测其质量和浓度.以Oligo(dT)15为引物,根据 Promega 公司的 M-MLV 反转录体系合成cDNA.以实验室前期获得的差异片段为基础, 根据中国春小麦基因组信息设计STPK-CCR3基因引物,进行PCR 扩增.扩增体系为:5×PSGXL Buffer 5 μL,dNTP Mix 2 μL,STPK-CCR3-F/R 0.5 μL,cDNA 1 μL,PrimeSTAR GXL DNA Polymerase 0.5 μL,无菌水15.5 μL.PCR 反应程序为:94 ℃ 5 min; 35 cycles of 98 ℃ 10 s, 58 ℃ 15 s,68 ℃ 2 min;68 ℃ 7 min; 4 ℃保存.将PCR 产物经琼脂糖凝胶电泳检测并切胶回收后连接到pGEM-T easy 载体上, 转化至大肠杆菌感受态细胞,挑取阳性克隆进行测序.
测序结果提交至NCBI GenBank 进行 Blastx 比对,分析该基因的结构功能域及所属基因家族,利用DNAMAN、MEGA5.0 等软件进行氨基酸序列比对分析并构建系统发育树.
1.5 白粉菌诱导下TaSTPK-CCR3表达模式分析
培养小麦京411,待小麦长至一叶一心期时,采用抖拂法将白粉菌生理小种E09 的分生孢子接种在小麦叶片上,在接种 0、2、4、8、12、24、48 和 72 h 后,取相同部位的叶片存于-80 ℃冰箱.提取小麦叶片总RNA,反转录合成cDNA.根据TaSTPK-CCR3 基因序列信息,在其特异性区域设计定量引物STPK-CCR3-QRT-F和STPK-CCR3-QRT-R.以小麦Actin 作为内参基因,对白粉菌诱导后TaSTPK-CCR3 基因的转录水平进行检测和数据分析.扩增长度为142 bp,总体系为20 μL,其中,2×Mix(SYBRRGreen)缓冲液 10 μL,上下游引物各 1 μL,cDNA 1 μL,无菌水 7 μL.扩增程序为:50 ℃2 min;95 ℃ 10 min; 40 cycles of 95 ℃ 15 s,58 ℃ 30 s.
1.6 TaSTPK-CCR3基因沉默重组载体构建及沉默效率检测
根据序列信息,在基因的非保守区设计上、下游特异引物STPK-CCR3-VIGS-F 和STPK-CCR3-VIGS-R,以感病小麦京411 的普通cDNA 为模板扩增基因片段,在T4 连接酶的作用下,将回收的片段与BSMVγ:载体骨架16 ℃连接18 h 以上,构建方法主要参见文献[11].
提取含病毒载体的质粒 BSMVα、BSMVβ、BSMVγ:GFP、BSMVγ:PDS及 BSMVγ:TaSTPK-CCR3, 线性化后进行酚仿抽提.根据Promega 公司 RiboMAX Large Scale RNA Produc tion-T7 试剂盒使用说明进行体外转录, 获得病毒RNA.待感病小麦京411 第2 叶完全展开时进行摩擦接种.实验设置以下几个组别:GKP Buffer 对照组(以水、GKP Buffer 等体积混合作为摩擦接种介质)、BSMV: GFP 对照组和 BSMV: PDS 对照组、BSMV:TaSTPK-CCR3 实验组.待各组植株长出第 3 叶,BSMV:PDS 组出现叶片白化时说明体系构建成功.用实时荧光定量PCR 技术检测接种白粉菌前对照组和实验组中TaSTPK-CCR3 基因表达水平的变化, 进而确定TaSTPK-CCR3 基因表达是否降低.
1.7 TaSTPK-CCR3基因敲减后对白粉菌孢子发育进行形态学观察
取各组接种白粉菌2、3 和7 d 的小麦叶片,经48 h脱色后,用考马斯亮蓝R-250 染色4~8 h.显微镜(20×)下,随机选取5 个视野(200 个细胞/视野)观察叶片上白粉菌孢子的发育情况,包括分生孢子、喙型附着胞和畸形附着胞(分瓣型和纤细型)等,统计以上数据.计算白粉菌孢子成功侵染率和畸形率,利用Origin 9软件进行分析.计算公式为
白粉菌孢子成功侵染率(%)=喙型附着胞/(喙型附着胞+畸形附着胞+分生孢子)×100;
白粉菌孢子畸形率(%)=畸形附着胞/(喙型附着胞+畸形附着胞+分生孢子)×100.
1.8 TaSTPK-CCR3基因敲减后植株叶片的表型观察
为了进一步讨论TaSTPK-CCR3 基因表达被抑制后,感病小麦京411 对白粉菌的敏感程度变化,选取各组生长情况相同的植株,分别接种新鲜的白粉菌孢子,7 d 后观察白粉菌在各组叶片上的生长状况.
2 结果与分析
2.1 TaSTPK-CCR3基因克隆及生物信息学分析
本研究克隆得到 1 个 TaSTPK-CCR3 基因的cDNA 全长序列,包含开放阅读框1 644 bp,预测编码547 个氨基酸残基, 预计相对分子质量为61.41×103.在NCBI GenBank 上进行Blastx 比对,发现该基因的保守结构域主要包括蛋白激酶超家族类似催化域PKc_like superfamily 和ATP 结合位点等,如图1 所示.在IWGSC(www.wheatgenome.org)网站,利用中国春小麦基因组信息进行基因序列的同源性比对,发现该基因在2D、2B 和2A 染色体上均有同源性较高区段.基因组注释信息表明,2D 染色体上蛋白激酶基因TraesCS2D01G062100.1 与STPK-CCR3 基因同源性最高,推测该基因位于2D 染色体上.
将TaSTPK-CCR3 氨基酸序列与乌拉尔图小麦(Triticum urartu,Tu)、粗山羊草(Aegilops tauschii,Ata)、二穗短柄草(Brachypodium distachyon,Bd)、短花药野生稻(Oryza brachyantha, Ob)、水稻(Oryza sativa, Os)和谷子(Setaria italica,Si)等 6 种植物中的 STPK-CCR3序列进行多重比对分析,结果如图2 所示.
TaSTPK-CCR3 与其他物种STPK-CCR3 同源序列的同源性保持在47%~75%之间,同源性最高达到74.21%, 说明TaSTPK-CCR3 在进化过程中具有较高的保守性.

图1 TaSTPK-CCR3 结构域Fig.1 Domain composition of TaSTPK-CCR3

图2 TaSTPK-CCR3的同源序列比对Fig.2 Alignment of TaSTPK-CCR3 with its homologues
利用MEGA5.0 软件构建系统进化树,结果如图3所示.由图3 发现,TaSTPK-CCR3 与粗山羊草STPKCCR3 的亲缘关系最为接近,说明TaSTPK-CCR3 属于STPK-CCR3 的蛋白家族.
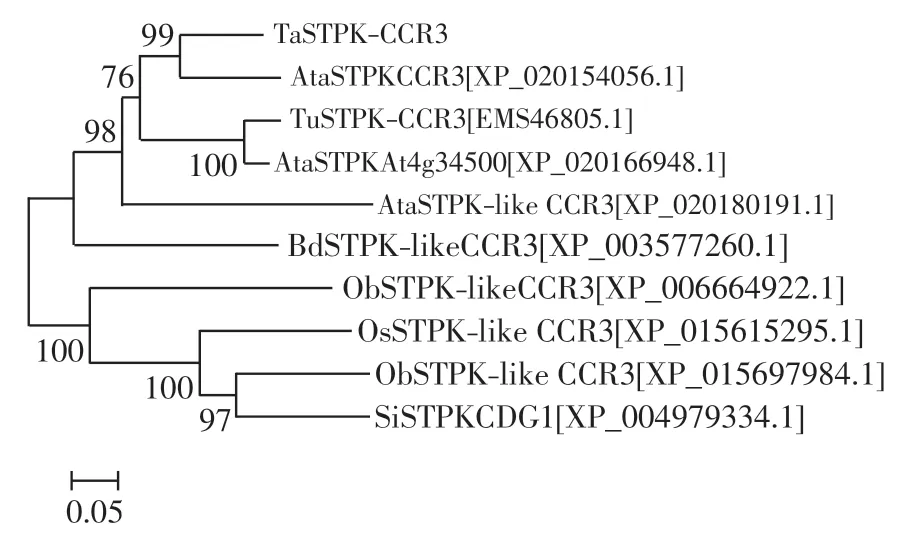
图3 STPK-CCR3蛋白家族的系统发育树Fig.3 Phylogenetic tree of STPK-CCR3 proteins family
2.2 白粉菌诱导下TaSTPK-CCR3表达模式分析
以京411 小麦为实验材料,TaActin 作为内参基因, 分析白粉菌侵染后TaSTPK-CCR3 基因的表达模式,结果如图4 所示.由图4 可以看出,TaSTPK-CCR3基因的本底表达水平较高,随白粉菌侵染时间的增加呈现出一定的波动.白粉菌侵染2 hpi 后表达量迅速下调,侵染4 hpi 后降至最低,之后表达量有所回升但均低于本底表达.
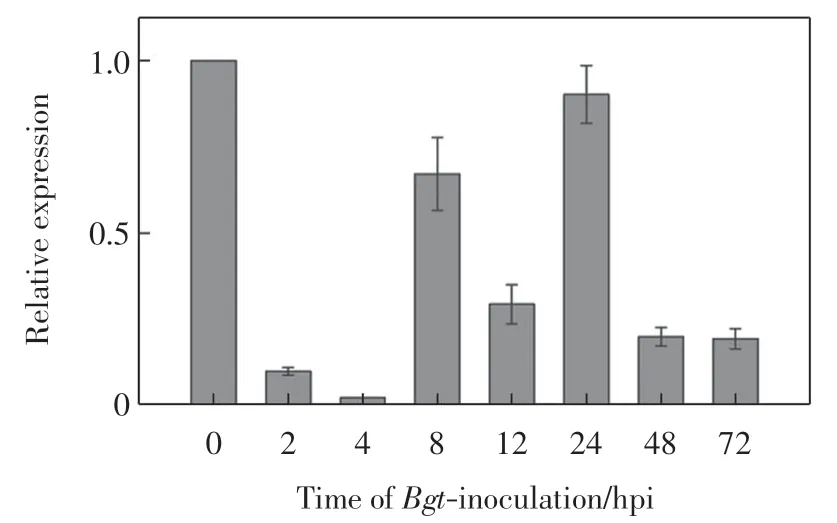
图4 白粉菌侵染后TaSTPK-CCR3 基因的表达模式分析Fig.4 Expression analysis of TaSTPK-CCR3 gene after Bgt inoculation
2.3 TaSTPK-CCR3基因沉默效率检测
以感病小麦京411 为实验材料,待第2 叶完全展开时进行摩擦接种,对各组植株第3 叶进行表型观察.接种病毒RNA 后,BSMV:PDS 对照组叶片出现白化现象,而在其他组中叶片呈绿色,说明沉默体系构建成功.利用实时荧光定量PCR 技术, 检测病毒成功侵染后(未接种白粉菌)TaSTPK-CCR3 基因转录水平变化,结果如图5 所示.由图5 可以看出,同对照组相比,在接种病毒RNA 后,实验组中TaSTPK-CCR3 基因的表达水平明显降低,说明小麦内源基因TaSTPK-CCR3的表达被有效抑制.

图5 TaSTPK-CCR3 基因的沉默效率检测Fig.5 Effectiveness of TaSTPK-CCR3 silenced by VIGS
2.4 TaSTPK-CCR3基因敲减对白粉菌孢子发育的影响
为了检测TaSTPK-CCR3 基因对小麦白粉菌应答反应的贡献, 利用基因沉默技术降低了该基因的表达,对基因敲减后的小麦叶片接种白粉菌,观察接种白粉菌2、3 和7 d 后各组小麦叶片上白粉菌孢子的生长发育情况,结果如图6 所示.由图6 可知,接种白粉菌 2 d 后,实验组(BSMV:TaSTPK-CCR3)小麦叶片上的白粉菌分生孢子萌发情况不佳,出现分瓣型畸形附着胞(lobed appressoria,LA),如图6(c)所示,而 2 个对照组(GKP Buffer 对照组和 BSMV:GFP 对照组)形成大量喙型附着胞,如图6(a)和图6(b)所示,图中AGT为附着胞芽管(appressorium germ tube).白粉菌侵染3 d后,实验组中仅有少量白粉菌分生孢子发育成喙型附着胞,如图6(f)所示,而对照组中形成大量的次级菌丝(sec-ondary hypha,SH),如图6(d)和 6(e)所示.白粉菌侵染7 d 后,实验组中形成少量次级菌丝,如图6(i)所示,而对照组已经出现大量的念珠状分生孢子(beaded conidia,BC),如图6(g)和图6(h)所示.
白粉菌侵染小麦不同时间后,孢子成功侵染率和畸形率的统计结果如图7 所示.由图7 可以看出,实验组叶片上白粉菌孢子成功侵染率明显低于2 个对照组,孢子畸形率则高于2 个对照组.
2.5 TaSTPK-CCR3基因表达量降低对白粉菌生长进程的影响
分别在实验组和对照组叶片上接种新鲜的白粉菌孢子,接种7 d 后,观察各组小麦叶片白粉菌生长情况,结果如图8 所示.由图8 可以看出,实验组小麦叶片上出现少量白粉菌菌斑,而2 个对照组叶片上出现肉眼可见的白粉菌孢子堆.进一步说明抑制TaSTPKCCR3 表达导致白粉菌孢子萌发率降低, 减缓了白粉菌的生长进程.
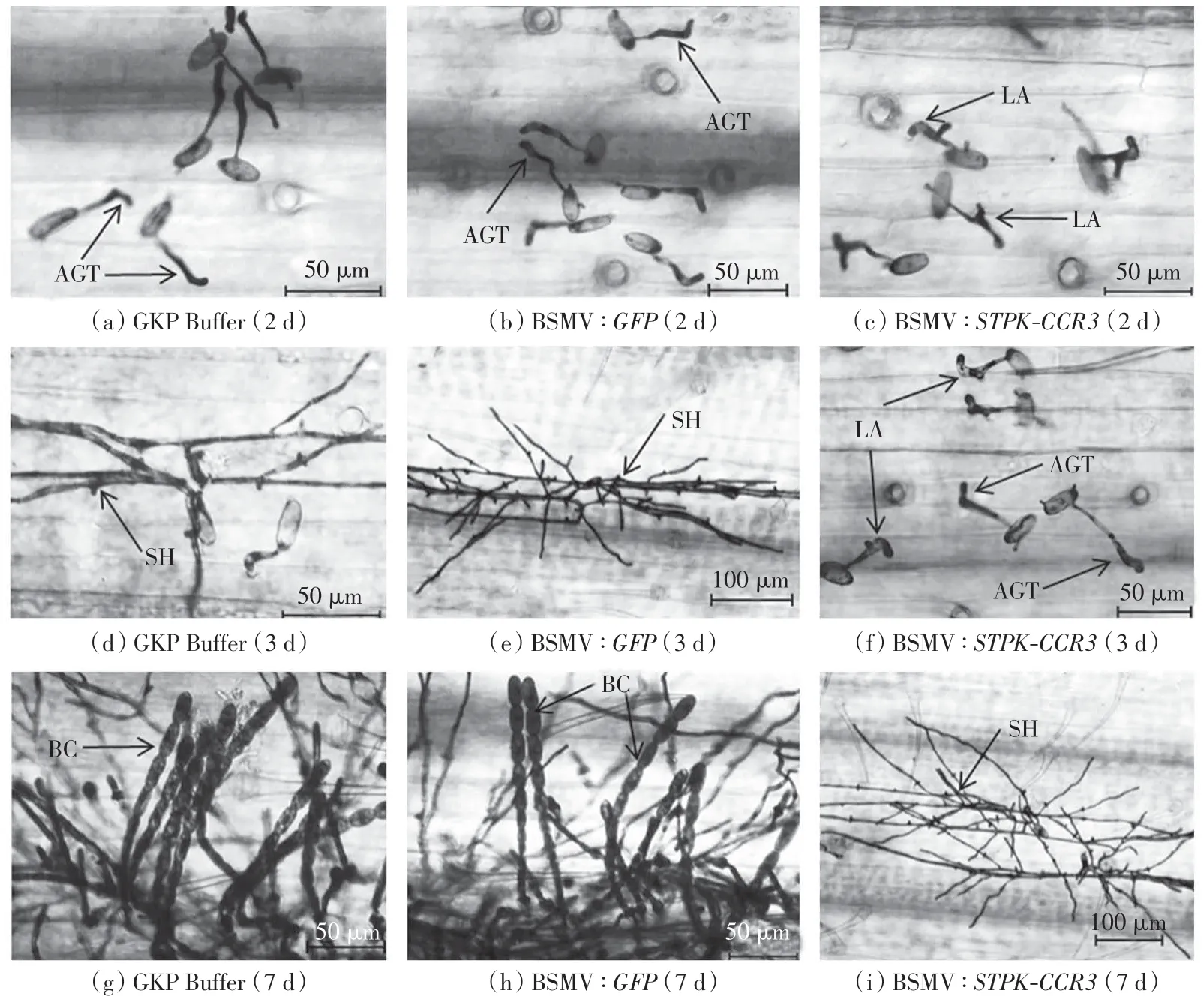
图6 白粉菌发育情况的显微形态学观察Fig.6 Microscopic examination of Bgt infection on leaf of Jing411
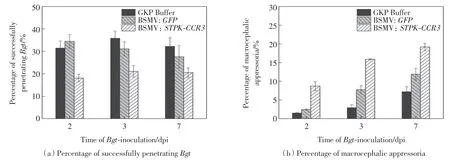
图7 接种白粉菌后植株白粉菌孢子发育统计Fig.7 Statistical analyses of spore development after Bgt infection
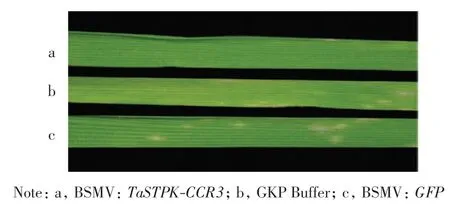
图8 接种白粉菌7 d 后京411 叶片上白粉菌的生长情况Fig.8 Resistant response to Bgt of Jing411 following 7 d of inoculation
3 讨论与结论
3.1 蛋白激酶参与植物防御反应
植物抗病性及其响应机制一直是植物分子育种中研究的热点问题.1971 年,Flor[12]通过对亚麻抗锈性的研究提出了基因对基因假说.该假说认为植物在受到病原菌侵染后,体内抗性基因所编码的产物能够对病原菌的无毒Avr 基因编码的产物进行识别,进而激发植物的防御反应系统.蛋白激酶作为防御系统重要的组成部分,以磷酸化和去磷酸化的方式调节植物生长发育过程、参与抗性反应[13-14].本研究克隆得到了1个STPK-CCR3 基因的cDNA 全长序列,经NCBI/Blastx比对,发现它属于PKc_like 超家族,与粗山羊草AtaSTPKCCR3(XP_020154056.1)具有74.21%的同源性.
3.2 抑制TaSTPK-CCR3基因表达改变京411小麦对白粉菌的敏感度
VIGS 作为一项反向遗传学技术[15-16],现已成为植物基因功能研究的重要手段[17-18].本研究利用大麦条纹花叶病毒感染小麦叶片,病毒在此过程中可能会对植物造成一定伤害[19].为了降低系统误差,设置了GKP Buffer 对照组、BSMV: GFP 对照组、BSMV: PDS 对照组和BSMV:STPK-CCR3 实验组.研究结果显示,病毒侵染后,2 个对照组小麦正常生长,未出现病斑,说明病毒没有对叶片生长产生明显影响.在接种白粉菌2、3 和7 d 后, 实验组白粉菌孢子侵染率低于2 个对照组, 孢子畸形率高于2 个对照组.在接种白粉菌7 d后,实验组叶片上仅有少量白粉菌菌斑,而对照组叶片上有肉眼可见的白粉菌孢子堆.排除系统误差,对比各组叶片表型,表明STPK-CCR3 基因表达被抑制后在一定程度上提高了感病小麦植株的抗病性.
3.3 TaSTPK-CCR3参与小麦-白粉菌互作过程
在小麦抗白粉病的研究中, 已鉴定出多个白粉病的抗性基因.本研究在感病小麦京411 中,对STPKCCR3 基因在白粉菌诱导下的表达模式进行分析,发现该基因受诱导后呈下调表达模式,且应答迅速,推测其很可能与小麦白粉病的发生机制相关.叶春秀等[20]克隆了甜瓜蛋白激酶类基因CmPKC 的全长序列,通过对抗、 感病材料中CmPKC 的相对表达量变化趋势的分析,推测CmPKC 基因可能与感病及开花、生长发育相关, 属于早期应答基因.本研究在小麦中克隆的STPK-CCR3 与上述PKC 具有类似的结构域,属于丝/苏氨酸蛋白激酶,降低该基因的表达,发现白粉菌孢子的萌发受到抑制,菌丝生长缓慢,与已报道的研究结果一致[9-10].结合qPCR 结果,初步推断STPK-CCR3基因很可能参与小麦-白粉菌早期互作过程.本研究对STPK-CCR3 基因的功能分析为小麦分子育种提供了新的基因资源.
