柑橘果皮角质层及其对采后贮藏保鲜影响的研究进展
2020-04-25杨绿竹王馨雨王蓉蓉丁胜华
杨绿竹,王馨雨,王蓉蓉,单 杨,张 群,丁胜华,*
(1.湖南大学研究生 院隆平分院,湖南 长沙 410125;2.湖南省农业科学院农产品加工研究所,果蔬贮藏加工与质量安全湖南省重点实验室,湖南 长沙 410125;3.湖南农业大学食品科学技术学院,湖南 长沙 410128)
陆生植物地上部分器官外覆盖着一层疏水性脂质结构——角质层[1]。植物角质层早期被认为是沉积在表皮细胞壁上但不与之相连的细胞外脂质层,后发现在细胞壁上存在纤维素(多糖)结构域将角质层和细胞壁相连接,目前认为角质层是一种复合的、异质分布的生物聚合物[2],基本结构见图1[3]。角质层主要由角质和蜡质组成。角质是一种由甘油、羟基脂肪酸及环氧脂肪酸组成的聚脂化合物;蜡质分为表皮外蜡和表皮内蜡两部分。外蜡沉积在表皮细胞最外层,主要是脂肪族化合物(烷烃、脂肪酸、初级醇、醛),并可自我组装,形成不同形态的蜡晶;内蜡嵌在角质聚合物基质中,主要是萜类化合物和少量甾醇,呈无定形态,不具备晶体结构[4-6]。部分植物的角质层中还含有胶膜,这是一种脂质生物聚合物,是角质层水解后的残渣部分,可增强角质层疏水性,防止水分蒸发,增强植物对干旱的适应能力[7-11]。此外,在角质层中还检测到了酚类、苯丙酮、黄酮类化合物及木质素成分[12-14]。除地上部分器官有角质层覆着外,最近一项研究发现拟南芥幼苗的根冠中也有角质层存在,这是一种非典型的角质层,它能够在幼苗生长的关键阶段保护根的分生组织、促进侧根生成[15]。角质层的存在有多方面的意义,如:营养器官和花器官中的角质层能够阻碍发育过程中器官融合;胚乳角质层的扩散屏障作用可以调节种子萌发过程,保护胚胎不受各种氧化反应的影响;同时角质层还可控制蒸腾作用和气体交换、控制亲脂物质的运输、调节果实生理紊乱等[16-17]。
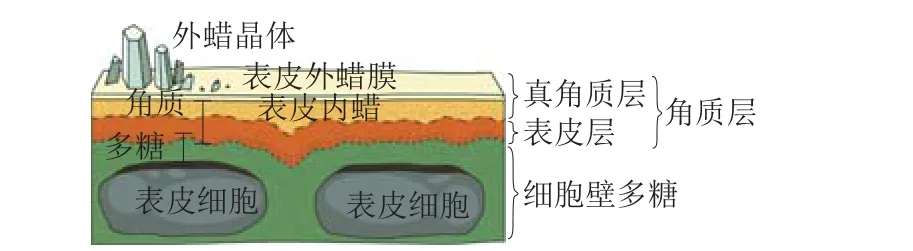
图1 植物角质层组分分布[3]Fig. 1 Distribution of plant cuticle constituents[3]
柑橘是一类非呼吸跃变型水果,是全球水果产业中最重要的水果之一。我国是柑橘生产和消费大国,近年来柑橘总产量保持着上升趋势,大部分用于鲜销,其中宽皮桔产量尤为突出[18]。但柑橘采后处理不当易失水、被霉菌感染或发生采后褐斑等,影响果实贮藏性能和商品价值[19]。而植物表皮角质层作为一层天然屏障,具有减少非气孔性水分损失、保持表面洁净、防止微生物和昆虫入侵及抵御非生物胁迫等功能[20-24]。关于柑橘表皮角质层的研究主要涉及化学组分、合成、转运、形态结构和功能等多个方面[25-28]。基于这些成果,本文综述了角质层的组成、结构、生物合成及其在柑橘贮藏中的作用,以期为角质层的深层研究和柑橘的贮藏保鲜提供理论参考,并讨论其未来可能的发展方向。
1 柑橘果皮角质层的组分
1.1 角质层组分的分离提取
角质层分离包括蜡质分离和角质分离两方面。大多数植物蜡质是疏水化合物,易溶于有机溶剂。最初用有机溶剂浸泡提取表皮蜡质,但提取物中内外蜡杂合,不易区分,并可能含其他杂质[29]。为避免这种现象,可先用机械分离法获取表皮外蜡(机械剥离外蜡法主要有3 种,具体见表1)[30-32],后用有机溶剂萃取法提取内蜡。蜡层厚的植物表皮外蜡可直接刮掉;蜡层太薄则用黏合剂剥离外蜡。柑橘果皮角质层的提取采用阿拉伯树胶剥离外蜡,后将果实浸于氯仿提取内蜡。总蜡提取后,同一果实用酶解法和有机溶剂萃取法相结合提取角质[33-34]。柑橘果皮角质层提取具体方法见图2。
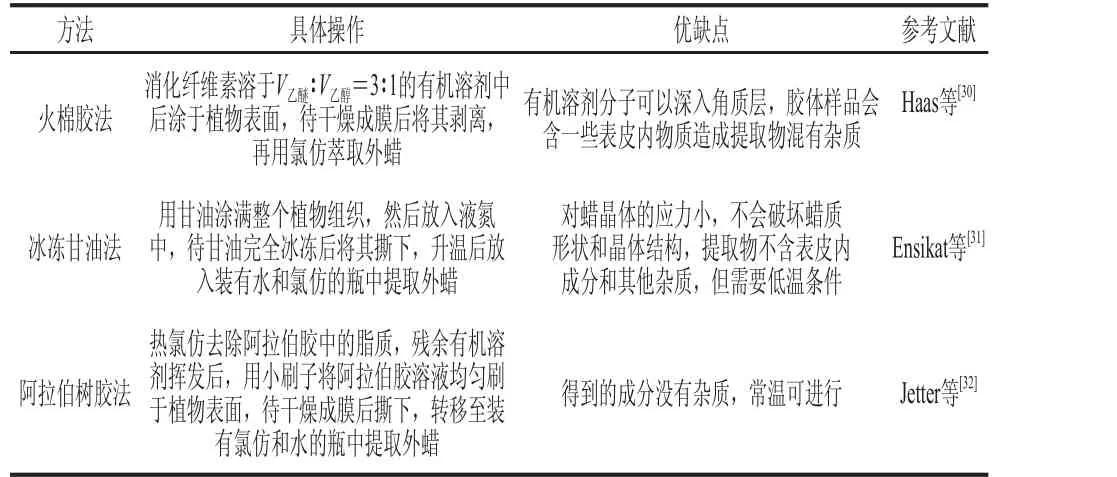
表1 机械剥离植物表皮外蜡的3 种方法Table 1 Three methods for mechanical peeling of plant epicuticularr wwaaxx

图2 角质层组分提取流程图[33--34]Fig. 2 Flow chart of the extraction process of cuticle components[33-34]
1.2 角质层含量与组分分析
植物蜡质和角质化学组分常采 用柱前衍生结合气相色谱-质谱联用(g as chromatography-mass spectrometry,GC-MS)进行定性定量分析。样品用于GC-MS分析前需加入一定体积的吡啶和等体积的N,O-双(三甲基硅烷)三氟乙酰胺衍生含有活性氢的官能团,使角质层组分转化为三甲 基硅基衍生物,以改善峰型,获得更高的分辨率[35]。植物角质单体大多是饱和羟基化脂肪酸,以C16和C18单体为主。蜡质组分主要是特长链脂肪族化合物及其衍生物。柑橘角质层的研究涉及多个品种,表2列举了一些柑橘类果实表皮角质层的主要组分。
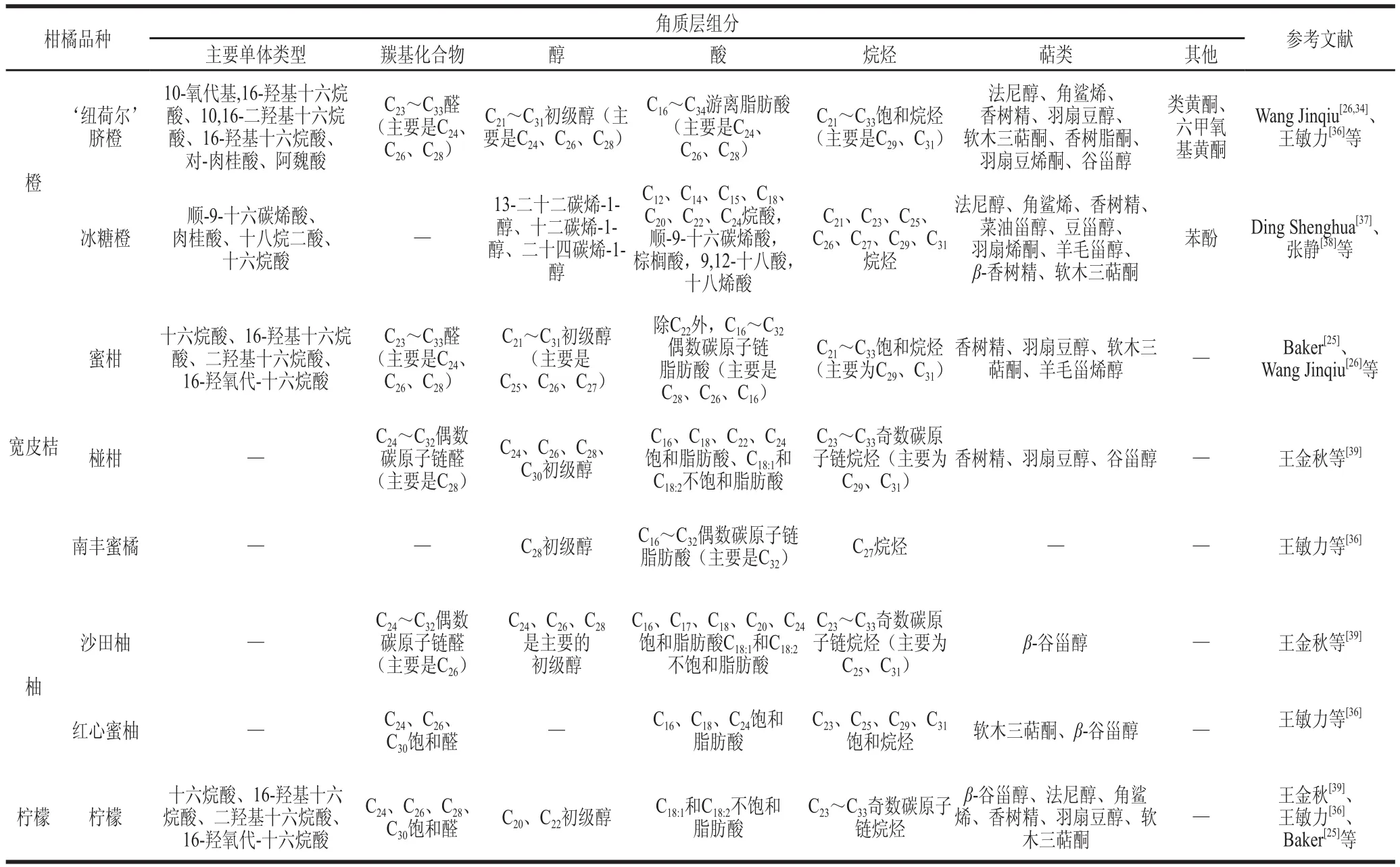
表2 柑橘角质层组分Table 2 Composition of citrus cuticle
柑橘果皮角质单体主要是含羟基的十六烷酸。Baker等[25]报道,柠檬和蜜柑角质单体主要是16-羟氧代基-十六烷酸,分别占其总角质的56%和57%,橙和克莱门氏小柑橘角质单体主要是二羟基十六烷酸,分别占总角质的51%和62%。然而,有研究者发现‘纽荷尔’脐橙表皮角质单体主要是10-氧代基,16-羟基十六烷酸和10,16-二羟基十六烷酸,且角质含量在开花后90~180 d持续增加,从(55.3±13.8)μg/cm2增加到(223.3±43.8)μg/cm2,到开花后2 1 0 d(此阶段果实成熟)下降为(169.6±2.1)μg/cm2,表明角质与果实发育时期有关,且在生长膨大阶段不断积累增加,但到果实成熟阶段含量减少[34]。角质组分的变化还受温度影响。成熟的冰糖甜橙在采收时角质单体主要成分是顺-9-十六碳烯酸和肉桂酸,4 ℃贮藏40 d后,两者含量都下降;但25 ℃下贮藏相同时间,二者含量上升,此外,角质总含量也在低温贮藏时减少,常温贮藏时增加[37]。低温贮藏诱导角质降解,可能是为了生成其他物质来提高果实抵御低温胁迫的能力,而常温下贮藏,更适于病原菌的生长,呼吸强度也较高,因此可通过提高角质含量以提高自身对外界环境不利因素的抗性。目前,具体角质单体组分的作用鲜有明确报道,未来可进行相关方面的研究,探究具体角质单体组分的作用,通过外源手段提高对果实保鲜贡献大的物质含量,延长果实贮藏期,达到更好的保鲜效果。
蜡质层组分的研究在橙、宽皮桔、柚和柠檬 等品种中较多。自柑橘果实发育至成熟阶段,果皮蜡质总量增加[28,34,40]。柑橘表皮蜡质组分主要是脂肪族化合物和萜类化合物。脂肪族化合物主要为C23~C33醛、C20~C31初级醇、C16~C34偶数碳原子链饱和脂肪酸和C18:1、C18:2不饱和脂肪酸,C21~C33奇数碳原子链烷烃。其中C24、C26、C28是主要的醛类物质,而C29和C31在烷烃中占主要地位。研究发现梨表皮蜡质组成[41-42]与柑橘类似,但具体组分在碳原子数上有差异(C16~C18醛类、C17~C41初级醇、C16~C26脂肪酸、C16~C44烷烃),三十一烷(C31)是‘库尔勒’、‘雪花’梨果实表皮蜡中最丰富的烷烃。此外,Sala[43]在‘Fortune’柑橘果实蜡层中检测到丰富的蜡酯和酮,且发现蜡质组分受光照的影响,位于树体北面的果实表皮蜡质中酮含量高,树体南面上的烷烃、酯类、醛类含量高。萜类化合物主要是三萜类(主要包括香树精、羽扇豆醇、软木三萜酮)和甾醇类(主要为谷甾醇),部分还含有角鲨烯和法尼醇。与柑橘不同,‘October Sun’桃角质层主要的三萜化合物是熊果酸和齐墩果酸[44]。此外,不同品种柑橘果实的萜类物质种类和含量都有显著的差异[39],说明品种和环境对角质层有较大影响。同时,在部分柑橘角质层还检测到次级代谢物微量胆固醇和类黄酮物质[28,34],推测目前对于角质层组分的研究手段还存在些许不足,角质层中的微量成分可能被忽略。
柑橘果皮角质层合成受外源乙烯的调控,‘Navelate’柑橘果实经乙烯处理,表皮总蜡量增加,且新合成的蜡质中富含脂肪酸[27]。苹果中也发现类似现象,而乙烯抑制剂(1-甲基环丙烯)则会延迟导致苹果表面产生油腻感蜡质成分的合成[45-46]。这些研究表明乙烯不仅可诱导蜡质积累,还改变蜡质组分。 从已有资料来看,乙烯似乎主要影响表皮外蜡脂肪族化合物的合成,可进一步探究乙烯处理后角质层合成通路的情况,探究角质层对这种外源物的响应机制。大量的研究成果均表明柑橘角质层组分具有多样性,品种、地理环境、贮藏条件和外源物处理都可能影响角质层组分及含量。
2 柑橘果皮形态结构
脂肪族蜡组分可自我组装成蜡质晶体。Ensikat等[47]通过电子衍射、X射线粉末衍射研究了35 种植物表皮蜡质的晶体结构,发现大多数脂肪族蜡具有正交晶型结构。一些扫描电子显微镜观察结果显示大多数表皮外蜡呈三维结构。常见的蜡晶结构为颗粒状、板状、血小板状、管状等[4,48]。血小板状蜡质组分中常含高比例的醛类和烷烃,管状蜡晶体有两种:蜡质含高比例的仲醇或β-二酮[49],也有一些研究发现血小板状蜡晶型表现出较高的形态学和化学变异性[50-51]。
柑橘果实表皮外蜡组分间的差异导致了果皮形态结构不一。成熟柑橘类水果在采收时表皮外蜡通常呈扁平血小板状,冰糖甜橙[37]、‘Foutune’柑橘果实[43]、‘纽荷尔’脐橙[28]表皮形态均为此结构。但突变体表现不同,醛类和烷烃含量显著下降的‘纽荷尔’脐橙突变体果皮蜡晶缺失、表皮光滑[28],相似表型在黄瓜[52]和拟南芥[53]中也被观察到。而蜡质组分中醛类和烷烃含量高的果实,形成的蜡晶分布范围更广泛、尺寸更大[26]。此外,贮藏过程用乙烯处理果实可减少表皮蜡质裂缝和缺蜡区域,使蜡质更紧密、均匀[27]。证明烷烃和醛是形成柑橘表皮血小板状蜡晶的必需物质。
同时,表皮外蜡自组装过程也受温度、光强、湿度等环境因素的影响。较高温度利于形成平行于角质层的结构,如:板状、薄片状;较低温度利于形成垂直于角质层的结构,如:棒状、管状[54]。低温会损害柑橘表皮晶体结构。4 ℃贮藏的冰糖甜橙蜡晶减少、表面起皱开裂,而25 ℃贮藏时蜡晶增多聚合,形成更大的晶体[37];葡萄柚树冠果实外侧向阳面的蜡晶尺寸大于内侧[55];‘Foutune’柑橘果实在低温条件下,果皮外蜡更易损伤裂化,但烷烃含量增加可显著延缓蜡层的裂化[43]。烷烃在柑橘表皮蜡晶形成过程中有较大作用,从相关报道可知,柑橘角质层中的烷烃主要是 C29和C31,虽已证明烷烃含量增加对蜡晶形成有利,但烷烃链长与蜡晶形态的关系未有说明。
3 柑橘果皮角质层组分在采后贮藏期的变化
柑橘类果实发育模式一般分4 个阶段:细胞分化期、分裂期、果实发育膨大期、果实成熟期[56]。角质层组分除果实生长发育期间不断变化外,贮藏期也 有所差异。温州蜜柑冷藏过程中角质层含量先上升后下降,而相同条件下贮藏的冰糖甜橙角质层含量在整个贮藏期持续下降[37,57]。‘纽荷尔’脐橙和温州蜜柑贮藏期蜡质中脂肪酸比例上升,醛类、烷烃比例下降,并在‘纽荷尔’脐橙中检测到了法尼醇和角鲨烯,温州蜜柑中没有[26],这与Liu Dechun等[28]的报道结果一致,表明果皮结构也会影响蜡质成分。此外,还发现‘库尔勒’和‘玉露香’梨在贮藏期间脂肪酸含量也发生了变化[42]。曾有报道,角质层单体C16/C18的比例影响蓟叶子和花角质层的机械性能,C16单体含量高时刚性较强;C16单体和C18单体含量相当时则具有较高的弹性[58],而烷烃和醛类的积累对防止果实水分流失有重要作用[26,59]。贮藏过程中角质层组分的变化影响角质层的性能,进而改变果实特性。脂肪酸比例的上升伴随着醛类、烷烃比例的下降,可能是蜡质组分互相转变的结果。这与随着贮藏期延长,果实成熟度增加、硬度下降、表皮逐渐软化、结构变得疏松、刚性下降相符合。且某些脂肪酸成分还可抑制病原菌生长,对果实起到保护作用。
4 柑橘果实果皮角质层合成途径及基因调控
4.1 蜡质 生物合成及基因调控
植物表皮角质层是由多酶复合物参与一系列酶促反应而合成,关于这方面的研究主要是以拟南芥为材料进行的[60-64],相关基因调控及合成转运途径如图3所示。脂肪族蜡组分合成大体可分为两个阶段。第一阶段是在质体中从头合成C16和C18脂肪酸。首先是乙酰辅酶A与来自丙二酸-酰基载体蛋白(acyl carrier protein,ACP)的C2分子缩合以延长碳链,这一过程的丙二 酸-ACP由丙二酸单酰辅酶A合成。丙二酸单酰辅酶A由乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACCase)催化乙酰辅酶A羧化而来,且此步反应为不可逆反应,并且控制着脂肪酸合成速率,因此ACCase催化反应被认为是脂肪酸合成的限速步骤[63,65];缩合后再经β-酮酰ACP还原、β-羟基酰ACP脱水、反式-Δ2-烯酰ACP还原3 个连续反应,4 个反应构成一个循环。由脂肪酸合酶复合体催化循环反应,每个循环使碳链增加两个碳原子,重复6~7 次,最终生成C16-ACP和C18-ACP。酰基ACP硫酯酶(acyl ACP thioesterase,FATB)催化酰基使其从酰基载体蛋白中释放,再经长链脂酰辅酶A合成酶(long-chain ac yl-coenzyme A synthase,LACS)转化生成C16和C18脂酰辅酶A[3]。‘纽荷尔’脐橙突变体中,CsCAC3、CsCAC1和LACS相关基因表达水平被下调,C16、C18脂肪酸前体和长链脂酰辅酶A的合成受到抑制,最终表皮呈光滑表型[33,60]。Jessen等[66]发现LACS1和LACS4基因双缺失的拟南芥突变体花粉被膜脂质含量显著降低。此外,在缺失FATB基因的拟南芥突变体中观察到茎和叶总蜡量都减少[67]。
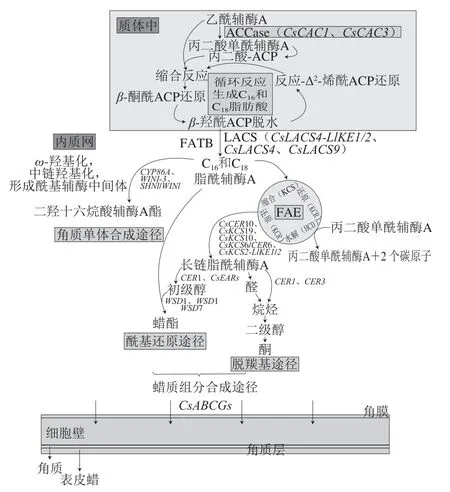
图3 角质层组分合成和转运[3,60--61]Fig. 3 Biosynthesis and export of cuticle components[3,60-61]
第二阶段是C16和C18脂肪酸被转运到细胞质中,由内质网上的脂肪酸延长酶(fatty acid elongase,FAE)复合物延长为C20~C34特 长链脂肪酸(very long chain fatty acids,VLCFAs)及其衍生物。FAE以C16和C18脂酰辅酶A为底物,整个合成过程由β-酮酰辅酶A合成酶(β-ketoacyl-CoA synthase,KCS)、β-酮酰辅酶A还原酶、β-羟基酰辅酶A水解酶和反式烯酰辅酶A还原酶催化的4 个连续反应构成一个循环反应。通过丙二酸单酰辅酶A转移到酰基载体蛋白上,经每个循环在原碳链上增加2 个碳原子。KCS是脂肪酸链延伸的限速酶,决定了最终脂酰辅酶A产物的长度[61]。在‘纽荷尔’脐橙中检测到了CsKCS19、CsKCS6/CER6、CsKCS11-LIKE1、CsKCS10、CsKCS2-LIKE1、CsKCS2-LIKE2等几种KCS基因,且其在突变体果皮中表达水平下调[33,60]。VLCFAs可以通过脱羰基途径转化为相应的醛、烷烃、二级醇和酮,也可以通过酰基还原途径转化为初级醇和蜡酯。研究发现,CER4编码脂酰辅酶A还原酶与初级醇形成有关,克隆拟南芥CER4基因发现其可特异地合成C24~C28的初级醇[68]。相关基因表达量低的柑橘果实蜡质中初级醇含量也低[33]。形成的初级醇可单独存在或与游离脂肪酸形成蜡酯。首先在拟南芥中发现WSD1基因与蜡酯合成有关[69]。最近还发现,WSD2、WSD7参与拟南芥叶和茎的表皮蜡酯生成,且在干旱、盐和脱落酸(abscisic acid,ABA)胁迫下可被高度诱导[70]。在番茄中也发现ABA在干旱条件下可诱导蜡质积累[71]。CER3、CER1基因主要参与烷烃合成,KCS6、CER3和CER1基因表达量高的果实表皮蜡质中醛类、脂肪酸和烷烃含量高,MYB家族基因也参与蜡质合成,MYB96表达水平较高,蜡质含量高,而MYB94和MYB96双缺失则造成蜡质损失严重[26,34,72]。此外,还发现CER22是CER1的等位基因,也可编码烷烃形成[73],而CER2与蜡组分碳链原子分布有关,主要作用是将碳链延长至大于28 个碳原子[26,74]。
蜡质组分中的萜类化合物由C5单元(异戊烯基二磷酸)组成。三萜化合物的合成主要有三步:第一步是由氧化角鲨烯环化酶催化2,3-氧化角鲨烯环化,构建三萜基本骨架;第二步是骨架被修饰成疏水的皂苷元;最后通过糖基化增加三萜的水溶性,改变其生物活性[75]。对柑橘中与萜类物质合成有关的基因研究发现,CsDXP3、CsFKP1、CsFPD2、CsCDPMEK、CsCHX2等基因与萜类化合物的骨架生成有关,ScFDFT1与角鲨烯合成有关,CsLUP4-LIKE1/2与β-香树精的合成有关[60]。
4.2 角质合成相关基因及调控
与蜡质合成一致,角质单体合成也始于质体中脂肪酸的从头合成。C16和C18脂酰辅酶A后形成,在内质网中发生ω-羟基化,中链羟基化和形成酰基辅酶中间体最后生成二羟基十六烷酸辅酶A酯,目前对这3 个反应发生的顺序还未能明显区分,但相关酶作用已有报道。如在拟南芥花瓣中CYP86A酶催化ω-羟基化反应,CYP77A6酶催化碳链中部的羟基化[3]。目前在柑橘中被报道的与角质单体合成有关的基因主要有:WIN1、GDSL1、MYB106、MBY41、SHN1/WIN1、WIN2、WIN3、ZIL1、CYP86A1、CYP86A2、GPADT8、BDG等。且它们大多既参与角质合成,也在蜡质合成中起作用,比如MYB106、MBY41、SHN1/WIN1直接调控角质合成并可间接影响蜡质合成[26,34]。此外,研究还发现WIN1和其相关转录因子过表达除能提高蜡产量外,还可调节角质层渗透性,增强植物适应干旱的能力[76]。
4.3 角质层组分转运及调控
蜡质组分与角质前体在内质网形成后,穿过质膜和细胞壁,最终沉积在细胞壁最外层形成新的角质层。目前的研究认为蜡质和角质前体在质膜上的转运输出主要依赖于ATP-结合盒(ATP-binding cassette,ABC)转运体。拟南芥中,ABCG12/CER5、ABCG32和ABCG13基因为蜡质转运所必需[77-79]。ABC家族转运蛋白在柑橘表皮角质层组分的运输中具有重要作用。Liu Dechun等[33,60]报道了CsABCG15、CsABCG32、CsABCG36、CsABCG11-LIKE1~CsABCG11-LIKE4、CsABCG1~CsAB CG3在蜡含量少的突变体‘纽荷尔’脐橙中表达下调,表明ABC转运蛋白表达水平的减少会导致蜡质从膜内输出受阻,最后造成表皮蜡质含量减少。脂质转运蛋白也参与角质层组分的转运过程,但在柑橘中少有报道。
5 柑橘果实果皮角质层对柑橘采后贮藏的意义
柑橘果实采后会失水或发生青霉病,导致果实皱缩腐烂,影响销售,造成经济损失。我国柑橘产量大,90%以上用于新鲜消费,采后贮藏至关重要[80]。柑橘表皮角质层可阻碍果实水分流失、抵御外界微生物的侵害和调节果实内部环境防止生理紊乱的发生。
5.1 防止水分流失
果皮角质层可以减少果实非气孔性失水,在没有或少有气孔时,角质层的蒸腾作用是水分流失的主要方式,而角质层的疏水性可有效防止水分流失[81]。以前普遍认为,角质层厚度决定表皮透水性。而后研究表明,角质层厚度和蜡质总量与透水性都没有相关性,水扩散主要屏障是一个小范围的富含高度结构化的蜡质区域[82-84]。Parsons等[85]对辣椒角质层的分析表明,水分损失率与角质层组成显著相关。角质层的保水能力主要由蜡质组分中的烷烃、三萜和甾醇含量及比例决定,烷烃可能是最有效的保水组分,还可提高植株抗旱性,而萜类对保水力有反作用[86-88]。角质层沉积的物理结构以及蜡质组分的排列对建立有效的表皮运输屏障必不可少,而蜡质和角质沉积厚度不影响角质层渗透性[89]。
柑橘表皮角质层渗透性的改变影响水分扩散,角质层功能严重受损时,水分渗透性增加,果实失水快[90]。去除表皮蜡质后的柑橘果实在贮藏期间水分损失率显著增加,如:‘纽荷尔’脐橙[26]、温州蜜柑[26,38]、冰糖橙[37-38]。蜡质组分与蜡晶结构对角质层水分运输起关键作用。‘纽荷尔’脐橙和温州蜜柑在贮藏期间随烷烃含量下降,果实失水率增加。温州蜜柑由于蜡质含量低、无定形程度高、晶型结构疏松表现出更高的失水率[26]。Schirra等[91]用不同温度热水浸泡‘Fortune’柑橘果实后观察并检测表面蜡质结构与贮藏性能,也得出了相同结论。由此可见,角质层起保水作用的主要是外蜡组分中能形成晶体结构的烷烃,烷烃含量高,蜡晶结构紧凑、尺寸大,则保水性好,有利于防止柑橘采后水分流失。内蜡似乎对保水并无作用。但水分子在角质层具体如何运输、在非晶体区域与晶体 区域的运输方式有何不同,还需要进一步地研究。此 外,角质层沉积还与环境因素有关。一般在高湿度环境下的植物角质层沉积少,而干旱条件下角质层沉积较多[92]。干旱条件下角质层沉积增加,可能合成更多蜡质晶体结构防止水分散失。
5.2 抵御外界微生物的侵害
果实抗病性随成熟期和贮藏期的延长而降低,某些情况下,真菌可以通过物理作用、酶降解作用或两种结合的方法穿透果实表面,而无法直接穿透果实表皮的病原菌,可以通过皮孔、气孔或自然裂缝感染果实,长期贮藏后,果实对伤口和机械损伤的敏感性逐渐增强,为感染的发生提供了途径。此外,表皮结构可影响病菌孢子的沉积和黏附[93]。角质层对外来物的入侵有防御作用,其他文献中有相关报道[94-95]。因此,角质层对抵御外界微生物入侵 具有重要作用。
柑橘角质层对采后青霉菌感染有抑制作用。乙烯处理后新蜡的合成可有效地阻止外界青霉菌感染‘Navelate’柑橘果实[27]。Dore等[96]用碳酸氢钠处理柑橘果实也有相同效果。虽然蜡质层可以阻碍病原菌入侵,但并非所有组分都可抑菌,具有抑菌作用的主要是蜡质层中的萜类物质。张静等[57]通过体外实验发现,冷藏过程中温州蜜柑表皮外蜡对指状青霉菌落的生长有促进作用,而内蜡则会显著抑制其生长和孢子萌发。此外,更耐贮的‘纽荷尔’脐橙成熟果实角质层蜡中存在法尼醇和角鲨烯[26]。法尼醇可抑制青霉菌的菌丝生长并促进其细胞凋亡,角鲨烯可参与清除自由基和提高氧负荷,两者均有保鲜作用[97-98]。而最近一项研究发现表皮蜡层缺失的‘纽荷尔’脐橙突变体茉莉酸合成显著增加,并对病原菌表现出更强的耐受性[99]。与蜡质一样,茉莉酸也源于 质体中脂肪酸的合成,且二者合成量呈负相关。突变体中茉莉酸合成的增加是对病原菌抗性增强的直接原因,但这种调控机制尚未明确。此外,蜡质中的烷烃组分似乎也与果实自身防御紧密相关。易受感染发生褐斑的‘Navelina’橙在 成熟过程烷烃含量高于非易感品种,这可能是果实抵抗外界干扰的结果[40]。拟南芥中MYB30基因可调节超敏反应,作为细胞死亡信使,其过表达会导致蜡质含量增加,其中C29和C30烷烃含量增加2 倍[100]。烷烃含量与蜡质晶体结构紧密相关,但并未明确指出是其形成的致密晶体结构抵御了病原菌的入侵还是其组分对病原菌有抑制作用。
除果实自身角质层蜡外,人工蜡涂层也可以延缓柑橘果实衰老,添加伊马唑利的蜡涂层可进一步保护果实抵抗青霉病,延长果实贮藏期[101]。同时,使用纳米抗菌剂可提高表皮渗透性,控制柑橘黄龙病的发生[102]。
5.3 柑橘果皮角质层与果实生理紊乱的关系
果实出现生理紊乱现象主要是因为角质层沉积与果实发育膨大之间不协调,一般表现为褐斑和开裂[103]。果实开裂主要在果实接近成熟或成熟期间,西红柿[104]、苹果[105]、西瓜[106]等作物均有开裂现象发生。
表皮厚度和表皮细胞密度与果实开裂程度显著相关,易开裂的果实表皮角质层较薄、结晶蜡较少[107]。通过改变表皮细胞密度、角质层厚度和成分,可控制果实开裂的发生。随着生长发育,柑橘果实尺寸变大,更易开裂,而蜡质组分中烷烃含量高的果实开裂率低[40]。在甜樱桃中也发现,表皮蜡质中烷烃的类型和比例对果实抗裂性至关重要[108]。此外,有新蜡合成、表皮缺蜡区域减少的柑橘,果实开裂程度下降[27]。同时,蜡晶结构受损是‘Fortune’柑橘果实果皮褐斑和凹陷的因素之一。Sala[43]报 道了与健康果实相比,果皮凹陷的柑橘果实表面蜡层更具有非晶性。低温会诱导‘Fortune’柑橘果实表皮细胞破裂,严重发生凹陷的果皮晶体丢失或无晶体结构,表面粗糙,发生冷害的果实角质层渗透性显著增加[90]。蜡质晶体结构与果实生理紊乱及采后病害显著相关,更紧密的蜡质晶体结构在能调控生理紊乱的同时也减少了果实病害的发生率。由于CER1、CER3基因与烷烃合成相关,适量过表达可提高蜡组分中烷烃含量,利于蜡晶形成,提高果实贮藏性。
6 结 语
植物角质层是植物组织与外界环境的屏障,与果蔬表型、采后衰老、病害紧密相关,对提高果蔬耐贮性具有重要意义。角质层组分及结构对其功能起决定性作用,相关基因的表达不同造成组分间的差异,同时引起蜡质晶体结构改变,进而影响其功能。环境因素对角质层也有较大影响,低温环境下角质层受损,而干旱则会诱导角质层含量的增加。目前,对柑橘角质层研究虽涉及了生物合成、组分变化、功能等多个方面,但也存在局限性。首先,现阶段具体研究对象范围较狭窄,大多都集中在角质、蜡质含量和组分的表征,而对胶膜、多糖、酚类等其他组 分的研究较少。其次,角质层具有多种功能,这些功能是否具有相关性并没有说明,基本上都是单独阐述。同时,角质层具体组 分与其功能的关系未有全面深入探究,目前研究得较多的组分是烷烃,已知烷烃在角质层的保水性、控制病害等方面都具有较大贡献,但有关脂肪酸、酮、醇等的报道很少。由于不同角质层组分作用不同,有针对性地研究具体组分及其变化在果实生长发育和采后贮运中的作用是今后研究的重要方向。此外,在多种植物中均发现角质层还具有反射紫外辐射的作用[109],但在柑橘中鲜有相关报道,可以增强这方面的研究。
柑橘采后被病原微生物侵染是主要的病害发生方式,真菌入侵植物表面可通过物理作用、酶降解作用或二者结合的方式,表皮结构可影响孢子沉积,但附着的真菌孢子可通过分泌黏附剂来依附宿主[93]。现阶段的研究主要是表征微生物入侵后蜡质含量和结构上的变化,而对霉菌侵染柑橘果实的机制、角质层对病原菌入侵的防御机制还未可知,因此,可进一步研究明确相关调控机制和通路从入侵源头减少果实采后病害。
在柑橘中还观察到外源处理物会引起角质层的变化[27,70-71],但其机制没有报道,关于角质层组分合成的研究、脂肪族蜡质组分的研究较多,也较为透彻,但有关角质和表皮内蜡的萜类化合物合成研究相对较少。尤其是角质组分合成的研究,还存有疑点,如:某些反应顺序并未能明显区分。同时,最近的研究报道了缺脂肪族蜡质的柑橘果实可以通过茉莉 酸介导调控增强对病原菌的抗性,提示角质层的保鲜作用具有复杂的调控机制,除了可单独起到保鲜的作用外,也与果实内其他组分互相影响,从而影响果实性能,但目前这方面的研究较少。
关于角质层仍有许多尚未解决的问题,而利用自身角质层提高柑橘采后贮藏保鲜效果能减少保鲜剂的使用且更安全经济,有望成为未来柑橘保鲜的新趋势。未来的研究可引入一些生物技术,如:基因编辑技术、转录组学技术、代谢组学技术等根据角质层相关功能,有针对性地表达或沉默某些角质层基因,使各组分合理协调,形成保水、抑菌效果均佳的角质层,提高果蔬的耐贮性。还可开发贮藏性能高的新品种进行培育种植,节约贮藏成本、提高经济效应,对柑橘采后有重要意义,也可为其他果蔬保鲜提供一定的参考。
