基于气相色谱-质谱、液相色谱-质谱技术研究贮藏过程中滩羊肉脂肪代谢通路转换
2020-04-25苑昱东李子欣罗瑞明尤丽琴
苑昱东,李子欣,罗瑞明*,剧 柠,尤丽琴
(宁夏大学农学院,宁夏 银川 750021)
动物屠宰放血后机体死亡,而器官、组织的机能并没有同时停止,细胞仍在进行各种生命活动[1-3]。由于机体呼吸与血液循环中断,细胞内的各种需氧性生化反应停止,代谢与活体产生差异[4-6]。研究宰后代谢差异对了解动物宰后肉成熟机理、改进冷鲜肉加工贮运技术有着积极的指导作用。
目前,国内宰后代谢研究多集中于某个基因调控某个通路变化,如颜新春等[7]研究了动物脂肪酸合成酶(fatty acid synthase,FAS)基因表达的调控,结果表明,生长激素能明显抑制FAS mRNA的丰度,从而影响动物脂肪酸的沉积。胡洪等[8]研究了哺乳动物丙二酰辅酶A(coenzyme A,CoA)的调控与表达,结果表明,丙二酰CoA受多种酶影响,对脂肪酸合成及分解进行调控。以宰后细胞为特殊生命系统,研究当前组学技术可检出的全部代谢的构成及相互作用鲜见报道。滩羊是宁夏优势特色畜种[9-11],本实验以滩羊冷却肉肌细胞为研究对象,以代谢组学研究宰后代谢物变化及其通路转换,揭示滩羊宰后细胞代谢动态演化及其通路转换机制,为滩羊肉品质控制提供理论指导。
段艳等[12]采用速溶剂萃取-耦合溶剂辅助风味蒸发法/气相色谱-质谱联用法(gas chromatography-mass spectrometer,GC-MS)/GC-嗅觉测量法分析德州扒鸡风味化合物,共鉴定出73 种成分,其中醛类15 种、酮类8 种,这些风味物质是由脂肪酸反应生成的。王毅等[13]采用GC-MS研究了伊拉兔肉脂肪酸组成,结果表明,兔胴体内主要脂肪酸有19 种,且各部位脂肪酸含量差异不显著,其中,棕榈酸、硬脂酸、亚油酸、油酸的积累含量占总含量的77%。本实验采用GC-MS、液相色谱-MS联用(liquid chromatograph-MS,LC-MS)技术相结合研究宰后皮下脂肪0~4 ℃贮藏中可检测出的全部代谢物、代谢通路,及其厌氧呼吸条件下的相互关系及联动转化,分析时间推移中代谢网络变化。研究这些特性对了解滩羊肉的性质、改善肉品质,及指导冷鲜肉及其制品加工有着重要的作用。研究代谢途径转化的代谢机制对了解滩羊宰后代谢物与代谢酶种类、丰度变化、调控机理及小分子营养风味物质(或前体)生成提供科学依据,为冷鲜滩羊肉及其肉制品生产技术研发提供理论指导。
1 材料与方法
1.1 材料与试剂
本实验的原料为现宰杀的盐池滩羊(6 月龄,公羊,10~15 kg),采自宁夏盐池县大夏牧场食品有限公司。
甲醇、吡啶、正己烷、O-甲基羟胺盐酸盐(纯度97%)德国CNW公司;氯仿 国药集团化学试剂有限公司;L-2-氯苯丙氨酸 上海恒创生物科技有限公司。
1.2 仪器与设备
超高效液相色谱(ultra performance liquid chromatography,UPLC)仪、ACQUITY UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm) 美国Waters公司;Triple TOF 5600高分辨MS仪 美国应用生物系统公司;Pegasus 4D全二维气相色谱飞行时间MS联用仪(comprehensive two-dimensional gas chromatography/timeof-flight MS,GC×GC-TOF-MS) 美国LECO公司;DB-5MS色谱柱(30 m×250 μm,0.25 μm) 美国J & W Scientific公司。
1.3 方法
1.3.1 样品处理
采集在0~4 ℃、相对湿度85%条件下贮藏的滩羊背最长肌上部皮下脂肪400 mg,封装于灭菌冷冻管中待用。采样周期为4 d,即采样时间点为贮藏0、4、8、12 d,每组样本做8 个生物学平行[14]。
1.3.2 脂肪酸组成的测定
1.3.2.1 样品前处理
采用GC-MS分析样品前处理步骤:精密称取30 mg/组样本,放入1.5 mL的离心管中。依次加入两颗小钢珠,加入20 μL的内标(0.3 mg/mLL-2-氯-苯丙氨酸,甲醇配制)和600 μL预冷的甲醇-水溶液(4∶1,V/V),在-80 ℃冰箱中放置2 min。随即放入研磨机中研磨(60 Hz、2 min),加入120 μL氯仿。再用冰水浴超声提取10 min,4 ℃静置10 min。4 ℃、12 000 r/min离心10 min,取300 μL的上清液装入玻璃衍生瓶中。
采用LC-MS分析样品前处理步骤:精确称取30 mg/组样本于1.5 mL离心管中,加入20 μL内标(0.3 mg/mLL-2-氯-苯丙氨酸,甲醇配制),加入400 μL甲醇-水溶液(4∶1,V/V);加入两颗小钢珠,在-80 ℃冰箱中放置2 min后,放入研磨机中研磨(60 Hz、2 min);冰水浴中超声提取10 min;-20 ℃静置30 min;4 ℃、13 000 r/min离心15 min,用注射器吸取150 μL上清液,使用0.22 μm的有机相针孔过滤器过滤后,转移到LC进样小瓶,-80 ℃保存。
1.3.2.2 GC-MS分析
采用GC×GC-TOF-MS仪进行GC-MS分析。GC条件:DB-5MS毛细管柱(30 m×250 μm,0.25 μm),载气为纯度不小于99.999%的高纯氦气,流速1.0 mL/min,进样口的温度为260 ℃。进样量1 μL,不分流进样。
MS条件:电子轰击离子源,离子源温度220 ℃,四极杆温度150 ℃,电子能量70 eV。扫描方式为全扫描模式,质量扫描范围:m/z30~600。
1.3.2.3 LC-MS分析
LC条件:ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);柱温:45 ℃;流动相:水(含体积分数0.1%甲酸)、乙腈(含体积分数0.1%甲酸);流速:0.4 mL/min;进样体积:5 μL。
MS条件:样品质谱信号采集采用正负离子扫描模式。
1.4 数据处理与分析
将所得的数据导入SIMCA 14.0软件包,先采用无监督的主成分分析来观察各样本之间的总体分布和整个分析过程的稳定性,后用有监督的偏最小二乘法分析区分各组间代谢轮廓的总体差异,找到组间的差异代谢物。为防止模型过拟合,采用7 次循环交互验证和200 次响应排序检验的方法来考察模型的稳定性。
2 结果与分析
2.1 滩羊肉贮藏过程中与脂肪酸代谢相关的差异代谢物分析结果
采用GC-MS、LC-MS法筛选出滩羊肉贮藏过程中含有的饱和脂肪酸有花生酸、硬脂酸、棕榈酸;n-3不饱和脂肪酸有二十碳五烯酸(eicosapentaenoic acid,EPA);n-6不饱和脂肪酸有花生四烯酸;n-9不饱和脂肪酸有油酸、反油酸,具体见表1、2。再结合差异代谢物平均表达量的变化在KEGG数据库中寻找相关差异代谢通路,进行代谢通路差异对比分析。
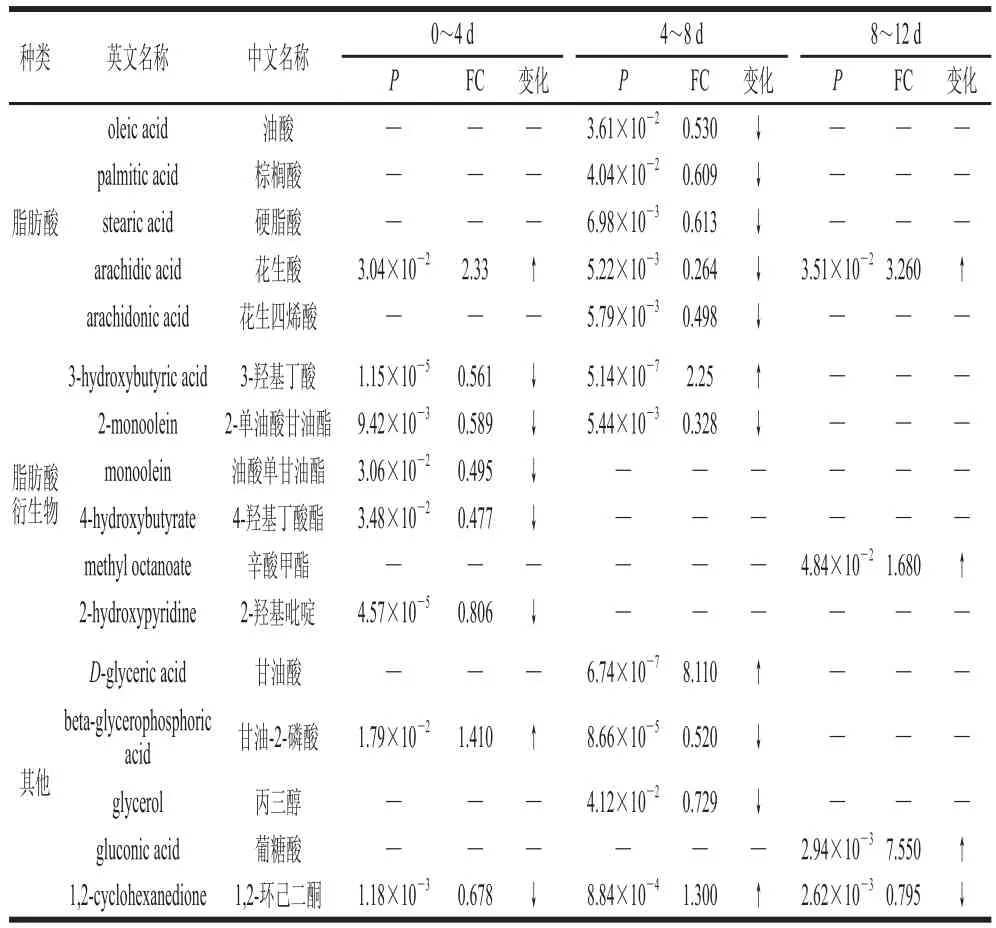
表 1 采用GC-MS筛选的冷鲜滩羊脂肪在贮藏过程中主要差异代谢物种类及平均表达量变化Table 1 Changes in average expression of major differential metabolites during storage of mutton fat determined by GC-MS
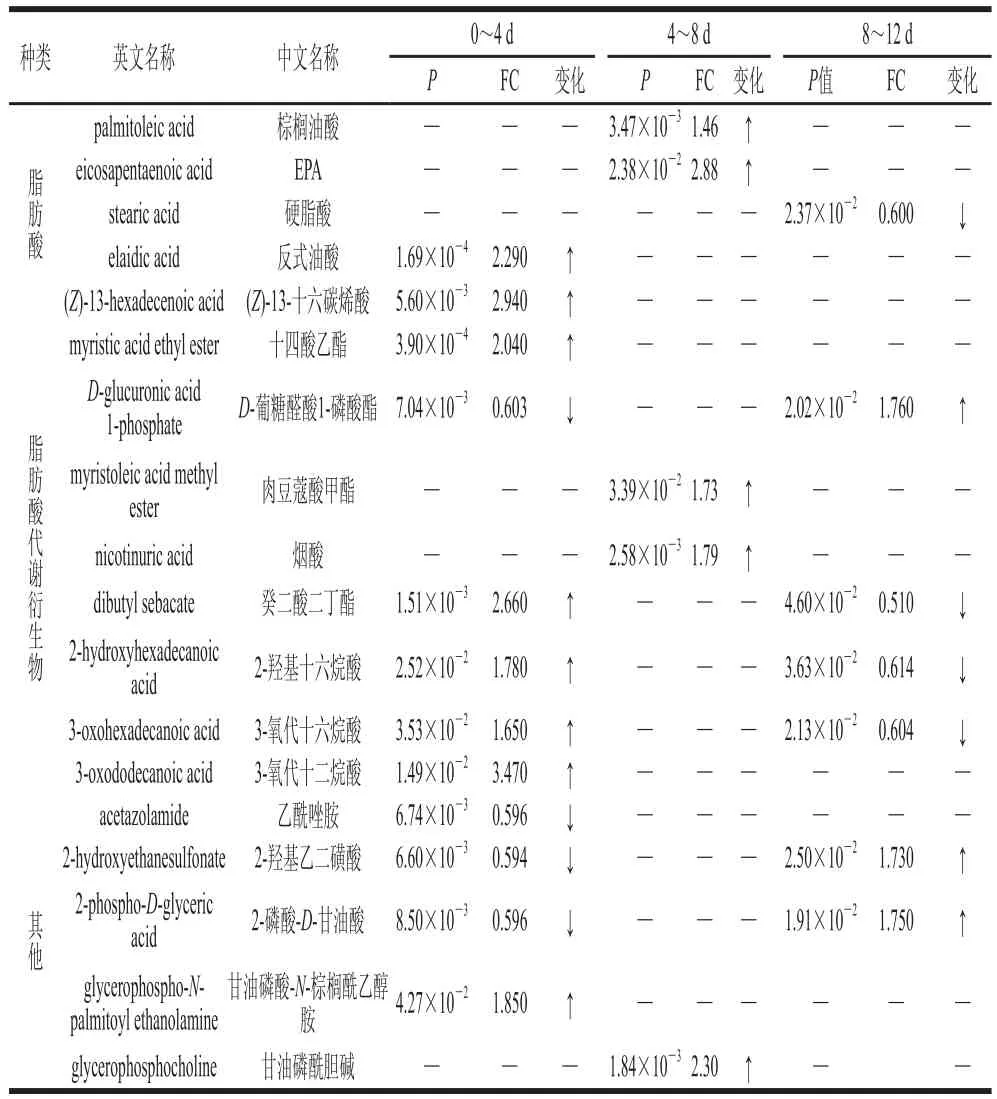
表2 采用LC-MS筛选的冷鲜滩羊脂肪贮藏过程中主要差异代谢物种类及平均表达量变化Table 2 Changes in average expression of major differential metabolites during storage of mutton fat determined by LC-MS
2.2 代谢通路差异性对比分析
采用GC-MS技术筛选出冷鲜滩羊脂肪贮藏4 d和0 d、8 d和4 d、12 d和8 d的差异代谢通路分别为104、108、69 条,而采用LC-MS技术筛选出的结果分别为18、31、15 条。由通路数量的变化可以看出,宰后冷鲜滩羊脂肪贮藏过程中,代谢通路的数量与种类随贮藏时间的延长呈现先增多后减少的趋势。取部分重要的P值小于0.05的差异代谢通路制得表3、4。

表3 采用GC-MS技术得到的冷鲜滩羊脂肪贮藏过程中主要差异代谢通路值对比Table 3 Comparison of -values of major differential metabolism pathways during storage of mutton fat determined by GC-MS
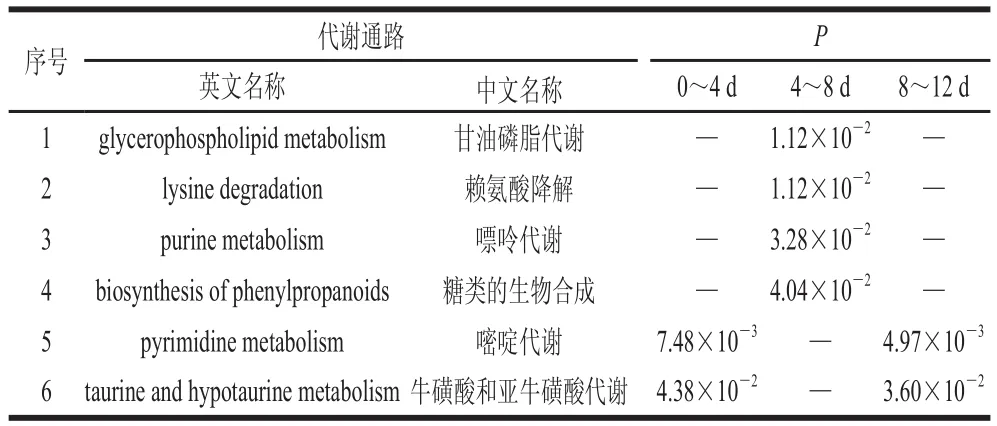
表4 采用LC-MS技术得到的冷鲜滩羊脂肪贮藏过程中主要差异代谢通路值对比Table 4 Comparison of -values of major differential metabolism pathways during storage of mutton fat determined by LC-MS
由表3可知,有关糖代谢的通路在0~4 d内差异显著,而氧化磷酸化通路则未表现活跃,有关脂肪酸生物合成的通路在此阶段也差异不显著,说明宰后机体内很快处于缺氧状态,但细胞仍试图维持其ATP和宰前活体一样处于一个较高水平,机体利用糖酵解代替氧化磷酸化而提供ATP以及利用磷酸肌酸和ADP的转化补充ATP,于是构成了一个宰后供能反应体系[15-21]。在4~8 d内,新增代谢通路主要集中在与脂肪酸、氨基酸的合成及降解的相关代谢通路上,如脂肪酸生物合成、部分氨基酸合成通路。如丙氨酸、天冬氨酸和谷氨酸代谢通路P值由4 d组与0 d组的1.83×10-1(P>0.05)变为8 d组与4 d组的2.12×10-6(P<0.01),甘氨酸、丝氨酸和苏氨酸代谢在8 d组与4 d组时表现出明显差异,其P值(P=6.54×10-4<0.01)较4 d组与0 d组的P值(P=5.16×10-2>0.05)有显著变化(表4中未给出)。说明与第4天相比,部分氨基酸代谢通路、脂肪酸代谢通路在贮藏第8天时表达显著。脂肪酸的生物合成通路在整个冷鲜贮藏12 d过程中仅在4~8 d活跃,这与差异代谢物中风味物质前体油酸、棕榈酸、硬脂酸在8 d时出现一致。说明冷鲜贮藏至8 d时,与脂肪酸合成的相关代谢通路活性提高,在此期间产生大量风味前体物质[22-23]。
2.3 代谢通路演化分析结果
在冷鲜贮藏8 d时,脂肪酸生物合成通路、GnRH信号通路以及甘油磷脂代谢通路变得活跃。不饱和脂肪酸生物合成通路在整个冷鲜贮藏过程中亦呈现出由差异不显著到差异显著再到差异不显著的变化过程。对照KEGG数据库中有关脂肪酸合成、分解的代谢通路,将有关棕榈酸、硬脂酸的合成总体路径绘制成图1。

图1 脂肪酸生物合成通路中有关棕榈酸、硬脂酸的合成路径Fig. 1 Biosynthesis pathways of palmitic acid and stearic acid
再以棕榈酸的具体合成为例,结合KEGG数据库中相关信息绘制棕榈酸合成路径(图2)。
由图2和表1、2可以发现,由GC-MS、LC-MS结果筛选出的3-羟基丁酸、3-氧代十六烷酸分别为棕榈酸合成过程中的两个前体物质,其中3-羟基丁酸是由乙酰CoA及丙二酰CoA共同合成的。在0~4 d内,3-羟基丁酸被消耗,并在一系列酶(如脂肪酸合成酶、烯酰还原酶及β-酮酰基合成酶等)的催化作用下逐步合成为3-氧代十六烷酸,故在此时段内,3-羟基丁酸表达量下调,而3-氧代十六烷酸表达量上调,但此时并未转化为棕榈酸,所以棕榈酸的相对含量无差异。随后在4~8 d内,3-氧代十六烷酸的相对含量无差异,棕榈酸的合成并没有受其前体物质3-羟基丁酸表达量上调的影响,反而其相对含量下降。说明在4~8 d内,棕榈酸氧化分解过程活跃,可能是由于此时段,组织主要由脂肪酸氧化分解供能所致;而3-羟基丁酸的上调并未直接影响3-氧代十六烷酸的相对含量,这一过程可能是此时段催化合成3-氧代十六烷酸的相关酶活性降低所致。

图2 棕榈酸合成路径Fig. 2 Biosynthesis pathway of palmitic acid
因此,丙二酰CoA是脂肪酸合成中的关键物质,其在脂肪酸合成中作为重要的二碳单位提供者存在[24]。丙二酰CoA在脂肪酸合成过程中起关键作用,同时也是抑制脂肪酸氧化分解的物质[25-28]。脂肪酸β氧化路径在4~8 d差异显著,说明此时脂肪酸氧化相关的代谢方式占主导地位。因此,可以推测出丙二酰CoA此时的含量较之前有所减少,其来源主要是由乙酰CoA经乙酰CoA羧化酶的转化,也间接说明了此时乙酰CoA羧化酶的活性降低。
而丙二酰CoA转变为丙二酰-[酰基-载体蛋白]后,分别经由不同酶催化生成棕榈酸、硬脂酸等脂肪的载体蛋白。这说明,在冷鲜贮藏4~8 d时段,机体能量处于相对较低水平,此时多种氧代酰基合酶以及脂肪酸合成酶被激活,从而使得棕榈酸、硬脂酸等脂肪酸合成通路开启。此外,在冷鲜贮藏4~8 d时棕榈油酸表达量上调,但棕榈酸表达量下调,可以看出,虽然脂肪酸生物合成通路开启,但由于在此时硬脂酰基载体蛋白去饱和酶与脂肪酸合成酶及脂肪酰基-[酰基-载体-蛋白质]硫酯酶的活性不同,硬脂酰基载体蛋白去饱和酶将十六烷-[酰基-载体蛋白]转化为十六烯酰基-[酰基-载体蛋白],从而进一步转化成棕榈油酸;这一假设过程也能解释棕榈酸表达量在4~8 d时下调的原因。

图3 GnRH信号通路中脂肪酸的β氧化路径Fig. 3 β-Oxidation pathway of fatty acids in the GnRH signaling pathway
GnRH信号通路中有关脂肪酸β氧化路径绘制如图3所示,其中,环腺苷酸(cyclic adenosine monophosphate,cAMP)对细胞许多代谢过程的调节是通过调节酶的活性来实现的[29-31]。在有ATP存在的条件下,cAMP通过蛋白激酶A(protein kinase A,PKA)激活脂肪蛋白激酶,使脂肪水解关键酶——激素敏感性甘油三酯脂肪酶磷酸化而激活,从而促进脂肪水解为甘油和游离脂肪酸。而过氧化物酶体增殖物激活受体(peroxisome proliferatorsactivated receptor α,PPAR-α)则在能量缺乏的条件下被激活,PPAR-α的激活是通过作用于脂肪酸,使其平均表达量上调,再结合、活化过氧化物酶体和线粒体脂肪酸β氧化的基因参与脂肪酸转运,进一步促进脂肪酸的生成、利用和分解代谢。
经上述分析可知,与脂肪酸代谢的相关通路均在冷鲜贮藏8 d时变得活跃,原因可能是经过一段时间的冷鲜贮藏后,脂肪细胞外部环境发生变化,其能量水平较活体时较低,导致部分酶活性降低或失活而另一部分酶被激活,从而使得一部分代谢通路由无差异到差异显著[32-34]。由图1、2可知,脂肪酸生物合成通路中棕榈酸和硬脂酸的合成路径与GnRH信号通路中脂肪酸β氧化路径同时开启,又因在冷鲜贮藏8 d时,棕榈酸、硬脂酸等差异代谢物平均表达量显著下调,说明脂肪酸的合成要远小于其发生β氧化的程度。说明在贮藏初期,脂肪酸合成通路并未表现出现差异,但有关棕榈酸等脂肪酸合成的前体短碳链化合物的相对含量有所变化。
3 结 论
本研究采用GC-MS、LC-MS技术研究宰后脂肪细胞0~4 ℃贮藏中可检测出的全部代谢物、代谢通路,从代谢层面了解了宰后代谢的整体变化情况。结果表明,两种方法下测出的差异代谢物结果有互补作用,检测出的差异代谢通路从宏观角度反映出了宰后整个代谢趋势的变化。糖酵解通路在0~4 d内活跃,这种现象反映了宰后机体立即进入无氧呼吸阶段,组织内细胞还要维持正常能量代谢水平的这种应激机制。在4~8 d内,脂肪酸生物合成通路、GnRH信号通路开启,乙酰CoA在乙酰CoA羧化酶的催化下转换为丙二酰CoA,丙二酰CoA在脂肪酸生物合成通路的作用是二碳单位提供者,同时也起到抑制脂肪酸β氧化的作用,该酶将丙二酰CoA转换为丙二酰-[酰基-载体蛋白]后又经多种氧代酰基酶及脂肪酸合成酶催化生成棕榈酸、硬脂酸、油酸等风味前体物质。8 d后,大部分通路逐渐关闭、消失,此时直接调控代谢的酶已失去活性。这个由能量变化引起的代谢通路之间的转换过程可以看作是宰后代谢通路的动态演化过程。由脂肪酸代谢产生的风味物质前体也随代谢活动的开启、活跃、消失这一演化过程而发生动态变化。
