冷沉淀析出的原因分析及对策
2020-04-25贾波
贾波
(济源市中心血站质控科,河南 济源459000)
冷沉淀(cryoprecipitate CP)是临床常用的血液成分,主要含有凝血因子Ⅷ (FⅧ)、纤维蛋白原(Fg)、凝血因子 XⅢ(FXⅢ)、血管性血友病因子(vWF)以及纤维连接蛋白(Fn)等成分,广泛应用于手术、创伤、肝移植、产科出血等引起的凝血机制障碍,以及血友病A(儿童和轻型成人型)、血管性血友病、Fg缺乏症等[1-7]。冷沉淀来源于新鲜冰冻血浆(FFP)在1~5℃条件下不溶解的白色沉淀物[8]。其重要特性是37℃融化后呈黄色澄清液体,无色泽异常、破损、析出及重度乳糜[9],否则可导致冷沉淀报废。本文结合实际工作,对2016年以来冷沉淀报废情况进行统计分析,并进一步探讨了冷沉淀析出的原因及对策,报告如下。
1 资料与方法
1.1 一般资料
1.1.1 资料来源 报废冷沉淀来源于临床供血环节,正常对照来源于本站合格库。
1.1.2 试剂与仪器 因子Ⅷ活性测定试剂 (批号547657A)、APTT 测定试剂 (批号 R7027)、Fg测定试剂(批号 R8041)、CaCL2溶液(批号 R6016)、TC缓冲液(批号 R7019)、清洗液(批号 A8007),以上均由SIEMENS公司提供;标准品(批号503259B,德灵公司);室内质控品(自制,采自正常人30人份以上血浆混合分装,-20℃以下保存);瑞氏-姬姆萨染色液(批号418033,Baso);全温控监测智能化血浆解冻仪(Baso);全自动血凝仪(sysmex CA-500);光学显微镜(莱卡DM500、徕卡6000MB);电子显微镜 (型号:VEGA 3 LMU,TESCAN Czech Republic);牛鲍氏计数板(上海医学光学仪器),大容量计数池(Nageotte);血细胞分析仪(BC-5000 迈瑞);细菌培养仪(LABSTAR-50山东鑫科)及配套需氧菌、厌氧菌培养瓶(批号 20180320、20180301)。
1.2 方法
1.2.1 报废率分析 统计2016年1月-2018年5月的冷沉淀报废率(按U计算,1U冷沉淀由400 ml全血以离心法制备),分析引起报废率增高的主要因素。
1.2.2 细菌学检查 目测发生析出的冷沉淀,初步判断有无细菌污染迹象(气泡、混浊等);然后以无菌接驳机留取析出样本10 ml于无菌转移袋中,分别接种需氧和厌氧培养瓶中各5 ml,置细菌培养仪连续监测7d;同步抽取相同批次的库存冷沉淀进行细菌培养。
1.2.3 形态学鉴别 a、不染色检查:取析出样本2 ml于小试管中,将移液器吸头剪掉3 mm(防止吸不到析出物),然后吸取100 μl代表性样本,加入Nageotte计数池,盖上盖玻片,以徕卡6000MB荧光显微镜镜检,200×锁定析出物拍照后再进行630×拍照;b、染色检查:吸取 100 μl代表性样本置载玻片上,轻摇动制成直径约0.5~1.0 cm的涂片,干燥后瑞氏染色,以徕卡DM500显微镜油镜镜检拍照,设正常血涂片和新鲜液体血浆2次离心沉淀物涂片行瑞氏染色为对照;c、电镜扫描:取析出组和未析出组样本经过液氮冷冻10 min后,冷冻真空干燥24 h,两组贴于铜台上经离子溅射仪喷金镀膜,以电子显微镜扫描观察两组的形态,加速电压20 KV。
1.2.4 Ⅷ:C、Fg、PLT检测 对析出样本检测FⅧ:C、Fg、PLT,FⅧ:C、Fg 采用全自动血凝仪检测、即刻法室内质控规则,PLT采用血细胞分析仪和牛鲍氏计数板检测(接近血细胞分析仪检测下限样本以牛鲍氏计数板手工对比检测),并以正常冷沉淀作为对照组,相同方法检查FⅧ:C、Fg、PLT,检测过程严格按照仪器和试剂操作规程执行。
1.3 统计学分析 数据采用SPSS 17.0统计学软件处理,计数资料采用χ2检验,计量资料采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 报废率统计分析 破损χ2值依次为1.625、0.969、2.921(P 均>0.05);乳糜 χ2值依次为 0.042(P>0.05)、6.550 和 7.902(P 均<0.01);析出 χ2值依次为 16.057、1171.261、1121.203(P 均<0.01);总报废率 χ2值依次为 14.214、119.534、1049.531(P 均<0.01),引起报废率升高的主要因素为析出,见表1。
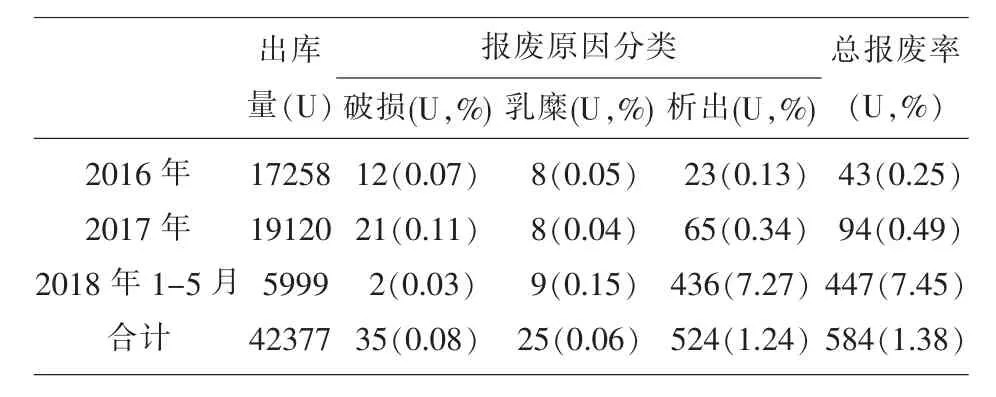
表1 冷沉淀报废率统计分析
2.2 细菌学检查 目测析出冷沉淀无气泡、无混浊;取析出冷沉淀36 U、同批次库存冷沉淀24 U,细菌培养结果均为阴性。
2.3 形态学鉴别 析出物呈白色不规则颗粒漂浮物,轻摇伴云雾状。a、不染色镜检:见条块状聚集物内散在存在颗粒状物质,并且有游离颗粒存在,见图1;b、染色镜检:见紫红色颗粒存在,且大块的紫色条块状由小的紫色颗粒组成,血小板染紫红色,细颗粒、粗颗粒由数量不等血小板聚集形成,有游离血小板及碎片存在,见图2;c、电镜扫描:经冻干扫描,析出组形成一种多孔海绵状结构,表面粗糙,有点状凸起呈现,呈混合物质组成,未析出组为不平整的絮状结构,表面光滑,呈单一结构特征,见图3。

图1 析出物不染色镜检(A 200×,B 630×)结果

图2 析出物瑞氏染色镜检(1000×)结果:A、B分别为正常血涂片、新鲜液体血浆2次离心沉淀物对照,C、D分别为细颗粒、粗颗粒析出

图3 电镜扫描结果:A为析出组,B为未析出组
2.4 Ⅷ:C、Fg、PLT检测 析出组、对照组FⅧ:C比较,t=-2.360,P<0.05;Fg 比较,t=0.257,P>0.05;PLT比较,t=4.509,P<0.01。 见表 2。
3 讨论
结果显示,2016年1月-2018年5月冷沉淀报废率呈上升趋势,其中以析出引起的报废占主要因素,见表1。目测发生析出的冷沉淀无气泡、无混浊,析出物呈白色不规则颗粒漂浮物,轻摇伴云雾状,初步分析认为:细菌污染可能性小,可能为纤维蛋白析出,云雾状是血小板悬液的典型特征。进一步检测:细菌培养结果排除细菌污染导致的析出,对析出物不染色镜检见条块状聚集物内散在存在颗粒状物质,见图1,瑞氏染色镜检见紫红色颗粒存在,且大块的紫色条块状由小的紫色颗粒组成,血小板染紫红色,细颗粒、粗颗粒由数量不等血小板聚集形成,有游离血小板及碎片存在,见图2,电镜扫描见多孔海绵状结构,表面粗糙,有点状凸起呈现,呈混合物质组成,见图3,综合分析析出物应为血小板和纤维蛋白聚集体。

表2 析出组、对照组FⅧ:C、Fg、PLT检测结果
冷沉淀中血小板主要来源于“制备残留”。采集的全血经低温大容量成分离心机分离制备悬浮红细胞和新鲜液体血浆时,大多数血小板随白膜层保留在悬浮红细胞中。因血小板比密 (1.030~1.042)和血浆比密(1.025~1.030)[10]接近,一部分比密低的血小板可保留于血浆中,或者在离心结束后的减速阶段,原本沉降于白膜层的血小板因离心机共振作用,少量血小板会“荡起”混入血浆中并用于制备FFP,在随后以FFP制备冷沉淀的过程,原本存在于总量约为250 ml FFP中的血小板经重离心后混入容量为20-30 ml[11]的冷沉淀中,血小板呈“浓缩性增高”(可增高10倍左右)。表2对析出组、对照组血小板含量比较,两组差异存在统计学意义,提示血小板含量与冷沉淀析出存在相关性。血小板发生聚集与其活化有关。引起血小板活化的主要因素有:⑴储存环境改变。血小板在22±2℃振荡保存[12]不会出现聚集,在4℃静置可以发生一系列分子生物学改变,包括由圆盘形变化为球形,并伸出多个伪足,变成树突型血小板。血小板活化后胞质α-颗粒释放,发生聚集且表面糖残基暴露[13]。再经复杂的变化产生凝血酶,使纤维蛋白原转变为纤维蛋白,并与血小板聚集颗粒缠结成凝块。在冷沉淀制备程序中涉及多个4℃的环节,分别是全血采集后储存、新鲜液体血浆的两次离心、制备冷沉淀前的FFP过夜融化、重离心收集冷沉淀等过程。⑵重离心力。在冷沉淀收集环节,FFP中残留的血小板在重离心力作用下“压实”在冷沉淀底部,可促进活化的血小板更易与互相交织的纤维蛋白缠结凝集成团。⑶冷冻损伤性活化。血小板冷冻损伤最严重的是血小板破裂成碎片,其次是血小板完整而血小板膜和内部的细胞器等超微结构不完整或移位等。根据目前的研究[14],冷冻保存血小板不管是形态完整还是破坏成碎片,输入体内都有止血作用,只不过与新鲜血小板比较,在体内容易被清除。就冷沉淀而言,低温保存是为了保持凝血因子活性,并不针对血小板进行保护性处理,在速冻-复融过程中血小板破裂或碎片形成,所含颗粒物质释出。由于血小板释放出的各种凝血因子仍具有较好的止血作用[15],从而发生“冷冻损伤性活化”。此外,冷沉淀富含FⅧ:C、Fg成分,高浓度的FⅧ:C、Fg与血小板高残留量,多因素叠加后发生析出的几率增高。从表2析出组与对照组FⅧ:C、Fg比较发现,FⅧ:C差异有统计学意义,Fg差异无统计学意义。笔者分析发生析出的冷沉淀其起始FⅧ:C、Fg含量应高于析出后,但在血小板活化聚集及质量检查过程中,因FⅧ:C不稳定,部分FⅧ:C被消耗,且消耗比例高于Fg。
需要注意的是,乳糜样颗粒与析出物在外观上有相似之处,区分的方法是取5 ml可疑样本于小试管中,以3000g离心15 min后观察,乳糜颗粒消失,取而代之在小试管样本表层形成白色粘附物,而血小板与纤维蛋白析出物不会消失。
综合上述我们提出以下对策:⑴降低血小板残留量。适当调整全血分离红细胞和血浆时的离心力、离心时间,降低用于制备冷沉淀的原料FFP中血小板残留量。⑵减少残留血小板活化聚集途径。适当调整重离心收集冷沉淀白色沉淀物的离心力、离心时间,在保证冷沉淀白色沉淀物有效收集(FⅧ:C、Fg含量达标)的前提下,降低血小板残留量并减轻血小板聚集程度。⑶严格原料FFP筛选。对制备冷沉淀的原料FFP进行严格筛选,尤其是外观尚清晰、仅表现为轻微乳糜的血浆不用于冷沉淀制备。⑷方法学调整。采用虹吸法制备冷沉淀的方法无重离心,且容量增加(40~50 ml),FⅧ:C、Fg浓度与血小板残留量均相对降低。⑸控制冷沉淀融化温度、输注时间。冷沉淀融化过程避免超温超时,采用37℃、10min快速融化后应尽快输注,不在室温或4±2℃冰箱中保存过 久,以减少FⅧ:C损耗及血小板聚集机会。
