HbA1c、MMPs、TGF-β1 及 HMGB1 联合检测预防胎膜早破的效果研究
2020-04-25周芹刘丽丽尤晓燕张冬梅
周芹,刘丽丽,尤晓燕,张冬梅
(郑州大学附属中心医院产科,河南 郑州 450000)
胎膜早破 (Premature rupture of membranes,PROM)是围产期常见并发症,主要指临产前出现胎膜破裂,可诱发早产、羊水过少、胎盘早削、胎儿窘迫甚至新生儿呼吸窘迫综合征等并发症,可增加胎儿和孕产妇的感染率,围产儿死亡率显著升高[1]。但由于PROM只存在组织学改变的表现,临床的早期诊断难度较大。
多指标联合检测是PROM诊断的有效方法,高迁移率族蛋白B1(High mobility group protein B1,HMGB1)是近年发现的重要炎性介质,属于多功能细胞因子,与肺炎、败血症和局部感染的发病关系密切[2]。基质金属蛋白酶(Matrix metalloprote-inase,MMPs)对保持胎膜完整性具有重要作用,是以细胞外基质为水解底物的重要酶;转化生产因子-β1(TGF-β1),由多种组织细胞合成,可调节细胞的分化和生长,对细胞外基质的降解具有重要作用并参与哺乳动物的多种病理生理过程[3]。糖化血红蛋白(HbA1c)已被证实与多种妊娠不良结局关系密切[4]。故而, 本研究深入探讨了 HbA1c、MMPs、TGF-β1及HMGB1与PROM发病和联合诊断的临床价值,报告如下。
1 资料与方法
1.1 一般资料 选取我院妇产科2016年10月-2017年10月收治的合并妊娠期糖尿病的胎膜早破患者50例为研究组,研究组患者年龄 20~35岁,平均年龄(25.9±3.4)岁;平均孕周(38.8±1.5)周。另选取同期择期剖宫产健康产妇 50例为对照组,年龄 21~36岁,平均年龄 (26.2±3.1)岁;平均孕周(37.5±1.4)周。两组患者年龄、孕龄比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入排除标准
1.2.1 纳入标准 ⑴研究组:根据妇产科学第七版的诊断标准,采用OGTT,被诊断为妊娠期糖尿病且HbAlc大于6.5%的孕妇。⑵对照组:妊娠 24~28周,无糖尿病且在妊娠终止前后HbAlc小于6.5%的孕妇。
1.2.2 排除标准 排除妊娠28周前终止妊娠或由于其他原因导致不能正常二次采血以测定 Hb A1c的患者。
1.3 观察指标及检测方法 检测研究组与对照组的 HbA1c、MMPs、TGF-β1 及 HMGB1 水平;分别抽取初次测量和血糖控制后所有患者空腹静脉血5ml,离心后分离血清,使用我院7600型自动生化分析仪测定HbA1c水平,相关检测试剂购于德国Roche公司;SP免疫组化法检测胎膜组织中MMPs、TGF-β1及HMGB1蛋白水平,上述蛋白一抗均按100倍稀释并于冰箱(4℃)过夜后滴加二抗,30min的恒温箱(37℃)孵育,辣根酶标记二抗滴加于复合物;DAB显色剂显色,苏木素复染、常规封片并脱水干燥[5]。
1.4 诊断标准[6]以第八版《妇产科学》教科书(谢兴主编)为诊断依据,《妇产科病理学》为亚临床CAM病理标准:轻度为羊膜和绒毛膜组织中每高倍视野中性粒细胞5~10个浸润,中度为11~30个,重度为超过30个,产妇无临床绒毛膜羊膜炎症状仅具有正常的实验室指标。
1.5 统计学方法 选用统计学软件SPSS16.0对研究数据进行分析和处理,计量资料采用均数±标准差(x±s)进行统计描述,计数资料采用 χ2检验;组间比较采用t检验;P<0.05为差异具有统计学意义。
2 结果
2.1 两组HbA1c水平的变化情况 初次测量研究组患者HbA1c水平明显高于对照组,经过血糖控制,第 2次测量研究组HbA1c水平仍明显高于对照组。且第二次测量的HbA1c水平均低于初次测量值,差异均有统计学意义(P<0.05)。
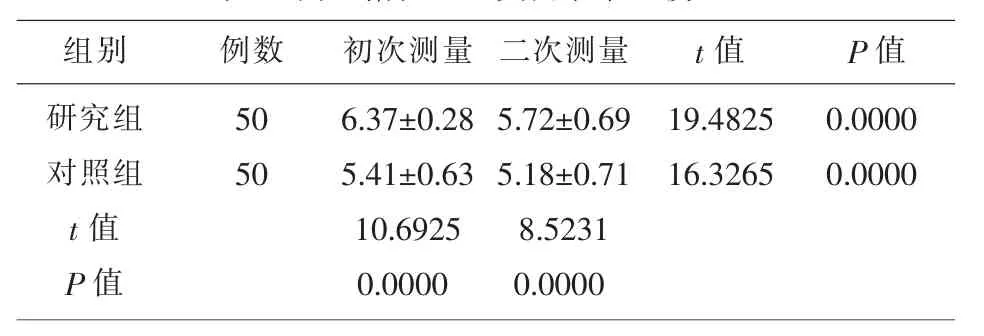
表1 两组糖化血红蛋白水平比较(%)
2.2 两组MMPs、TGF-β1表达水平比较 研究组MMPs表达高于对照组,TGF-β1表达低于对照组,差异均有统计学意义(P<0.05)。
2.3 两组新生儿和孕妇血清HMGB1水平比较 研究组新生儿和孕妇HMGB1水平均高于对照组,且研究组孕妇与新生儿HMGB1水平呈正相关。
3 讨论
PROM是指在临产前胎膜自然破裂,孕龄<37孕周的胎膜早破又称为早产(未足月)胎膜早破[7]。胎膜早破的原因多样,主要包括:创伤,宫颈内口松弛,感染,羊膜腔压力增高,胎儿先露部与骨盆入口衔接不好,胎膜发育不良等[8]。PROM是围生期最常见并发症,可导致早产率、围生儿病死率、宫内感染率及产褥感染率升高。
胎膜主要由绒毛膜、蜕膜和羊膜组成,各层组织细胞外基质富含多种弹性蛋白和胶原,均是保证胎膜完整性的重要组分;MMPs为含Ca2+和Zn2+的蛋白水解酶,能够降解细胞外基质中的蛋白聚糖、糖蛋白及胶原,进而调节细胞外基质含量及胎膜结构[9]。研究[10]发现细胞外基质含量下降和结构弱化是诱发PROM的关键因子之一,而MMPs和其组织抑制物在细胞外基质的破坏生理过程中作用明显;TGF-β1由多种组织细胞合成,属于多功能细胞因子,可参与哺乳动物的多种生理病理过程,具有调节细胞分化和生长的功能,进而降解细胞外基质[11]。
HbA1c因形成缓慢且一般不可逆转,可经糖类物质和血红蛋白的作用生成并维持在红细胞120d的生命周期内,研究[12]证实红细胞周围环境中的血糖浓度和其生成速度具有正相关关系,已成为评价人体一段时间内血糖控制水平的重要指标,能够在人体1~3月内不受多种因素的波动影响并反映平均血糖浓度,为医师提供不良妊娠结局的数据参考。本研究结果显示初次测量研究组患者HbA1c水平明显高于对照组,经过血糖控制,第2次测量研究组HbA1c水平仍明显高于对照组。且第二次测量的HbA1c水平均低于初次测量值,差异均有统计学意义(P<0.05)。上述结果提示胎膜早破患者HbA1c水平存在明显变化,具有成为诊断胎膜早破重要指标的潜力。研究[13]发现妊娠期糖尿病可出现胎膜早破等不良妊娠结局,胎儿长期暴露于高血糖环境中而导致血液呈高渗状态,血糖升高且尿液增加,故而HbA1c水平可出现明显波动。
机体处于正常生理状态时,胎膜组织中MMPs表达水平较低,由于生长因子和炎性因子的刺激,MMPs的表达水平可出现明显升高,进而降解细胞外基质的有效成分,调节细胞间的生物效应,进而诱发PROM;妊娠组织中TGF-β1可广泛表达,具有诱导胚胎发育、胚胎着床和母体间免疫耐受等多种生物作用;研究[14]发现TGF-β1可在正常胎盘滋养细胞和间质细胞中均表达并认为在妊娠晚期的特定条件下具有一定的抑制作用。本研究结果显示研究组 MMPs表达高于对照组,TGF-β1表达低于对照组,差异均有统计学意义(P<0.05),该结果也与先前的研究结果相符。MMPs调节细胞外基质重组的动态平衡可分为以下机制:⑴降解EC M而有利于细胞迁移;⑵改变细胞外基质的微环境,引发细胞形态改变、增生和凋亡;⑶调节生物分子活性,清除抑制物或酶;⑷改变蛋白酶回血平衡。MMPs的活性和表达升高可通过自分泌或旁分泌途径作用于胎盘、宫颈和胎膜,诱发降解细胞外基质,促进软化宫颈而加速产程发展,进而打破胎膜的细胞外基质的动态平衡,使胎膜强度和韧性下降,加速胶原蛋白的降解,诱发PROM。TGF-β1可调节TIMP-1和MMPs基因的生物学表达功能,进而调节细胞外基质的降解和合成。资料[15]显示TG F-β1可促进MMP-9的表达进而加速细胞外基质的降解,促进细胞外基质聚积并加速胶原合成,加速纤维细胞的增生,PORM患者胎膜中TGF-β1表达下降可影响胎膜韧性和厚度进而诱发PROM。
炎性细胞可自动分泌HMGB1并从坏死细胞中释放。病原微生物侵入羊膜腔后激发炎性反应,刺激巨噬-单核细胞分泌炎性因子 (IL-8、HMGB1和TNF-α等)进而侵占胎膜,使胎膜变脆、水肿最终出现裂解。此外HMGB1的正反馈调节可刺激更多的趋化因子MMPs和炎性因子分泌,加速破坏胎膜结构诱发PROM。
本研究结果显示研究组新生儿和孕妇HMGB1水平均高于对照组,且研究组孕妇HMGB1水平与新生儿HMGB1水平呈正相关。上述结果提示HMGB1可能在PROM的发生和发展过程中具有重要的调节作用,可能诱导PROM患者出现对机体不利的炎症反应和感染。
综上所述,检测 HbA1c、MMPs、TGF-β1 及 HM GB1水平有利于胎膜早破的诊断,以便及早采取措施保证母婴安全。
