ASC-US患者HPV感染与Th17/Treg细胞及炎症因子的变化分析
2020-04-25马梅张德阳许德清蒋蕾薛芬薛峰
马梅 ,张德阳 ,许德清 ,蒋蕾 ,薛芬 ,薛峰
(1.南阳市卧龙区计划生育宣传技术服务站妇科,河南 南阳473000;2.南阳市第二人民医院病理科,河南 南阳473000;3.南阳市第二人民医院产一科,河南 南阳 473000;4.南阳市医学高等专科学校第一附属医院放射科,河南 南阳 473000;5.南阳市第一人民医院康复科,河南 南阳 473000;6.南阳市宛城区疾病控制中心,河南 南阳 473000)
流行病学研究证实,非典型鳞状细胞(ASC-US)的发病率可达283~593/1万人左右[1]。临床上ASCUS的发生能够增加患者宫颈高级别病变的发生风险,提高远期宫颈恶性肿瘤的发生率[2]。在探讨A SC-US的发生或者病情进展机制的过程中发现,人乳头瘤状病毒(HPV)的感染,能够通过促进宫颈柱状上皮细胞的损伤和DNA的扩增,进而促进宫颈病变的发生[3];辅助性T淋巴细胞(T17)是T淋巴细胞亚群的重要成员,其能够通过促进体内炎症因子的释放,加剧宫颈上皮组织的炎症性损伤,进而促进宫颈病变的发生[4];调解性T细胞(Treg)是CD4 T淋巴细胞亚群的重要成员,其能够通过对于T淋巴细胞免疫的调控作用导致细胞免疫功能的紊乱,导致免疫抑制和免疫逃逸的发生[5]。部分研究者探讨了高危型HPV病毒感染与ASC-US的关系,认为高危型HPV病毒感染是促进ASC-US病情进展的重要因素[6],但对于Th17、Treg细胞与宫颈病变的关系研究不足。为了深入揭示Th17、Treg细胞与ASC-US的关系,从而为临床上宫颈病变的预防和治疗提供参考,本次研究选取我院妇科门诊2017年3月至2017年12月收集的200例ASCUS患者,探讨了HPV病毒亚型、Th17、Treg细胞表达情况,报告如下。
1 资料与方法
1.1 临床资料 选取2017年3月至2017年12月于我院妇科门诊收集的200例ASC-US患者,根据宫颈活检组织学诊断将其分为宫颈炎性病变患者52例 (炎性组)、宫颈上皮内瘤变患者133例(CIN组)、宫颈癌患者15例(宫颈癌组)。炎性组,年龄29~68岁,平均37.6±11.7岁。CIN组,年龄26~65岁,平均39.0±12.2岁,其中CINⅠ级39例、CINⅡ级60例、CINⅢ级34例。宫颈癌组,年龄31~66岁,平均40.2±10.8岁。三组患者的年龄比较,差异无统计学意义(P>0.05)。纳入标准:⑴宫颈炎、CIN患者、宫颈癌患者的诊断标准参考《妇产科学》人民卫生出版社第八版中的标准;⑵所有研究对象均接受了薄层液基细胞学(TCT)、宫颈活组织病理学检查;⑶纳入研究对象的年龄19~69岁;⑷本研究获得研究对象的知情同意、医学伦理委员会的批准。排除标准:⑴既往具有宫颈手术史;⑵盆腔及卵巢恶性肿瘤;⑶急慢性感染性疾病;⑷免疫系统疾病。
1.2 HPV检测方法 采用美国Digene公司二代杂交捕获试验(hybrid capture,HC-II)的采样工具,宫颈管采集标本,进行HC-II检测操作并作出分析。检测目前已知的13种高危型HPV。HPV≥1.0 ng/L为检测阳性。
1.3 Th17/Treg细胞检测 采集患者清晨空腹血5ml,置于肝素钠抗凝管中,采用流式细胞仪双标法进行CD4+CD25+调节性T细胞的检测。相关标记操作于5ml抗凝管中进行,100μl全血与CD4-FITC/CD25-PE抗体室温反应25min,采用红细胞裂解液optiLYse C溶血素溶解红细胞,PBS液体洗涤三遍,每次5min,生理盐水重新悬浮细胞,上机检测。(FACS calibur流式细胞仪购自美国BD公司,threg检测试剂盒购自罗氏检测公司)。
采用ficoll法分离人外周血T淋巴细胞,取20μl细胞混合液加入锥虫蓝,加入离子霉素后植入培养箱中培养1h,加入莫能霉素,继续培养5h。取200μl细胞悬浮液,加入 10μl固定液,加入 30μl细胞裂解液,反应20min之后1000r/min离心5min(离心半径15cm),加入25μl IL-17 FITC/CD4 PE抗体进行标记,孵育30min后上机检测。(th17检测试剂盒购自南京凯基生物科技有限公司)
1.4 炎症因子检测 采集入院后静脉血,1000r/min离心5min,离心半径10cm,离心后收集上清液,采用免疫发光法检测 IL-17、TGF-β、IL-23水平,加入检测试剂,检测仪器为美国Bio-Bad全自动酶标仪,配套试剂盒购自罗氏检测公司,微型离心机HIT ETIC购自上海精密仪器有限公司。
1.5 统计学方法 数据统计、分析应用SPSS16.0,应用(x±s)表示计量数据,计量数据的比较分析采用单因素方差分析法,组间两两比较采用LSD-t检验;计数资料采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 三组患者HPV感染型别分析 宫颈癌组患者的HPV16型、HPV52型均显著高于CIN组和炎性组(P<0.05),CIN 组患者的 HPV16型、HPV52型均显著高于炎性组(P<0.05);宫颈癌组、CIN组和炎性组患者的HPV18型、HPV58型感染率差异无统计学意义(P>0.05);见表 1。
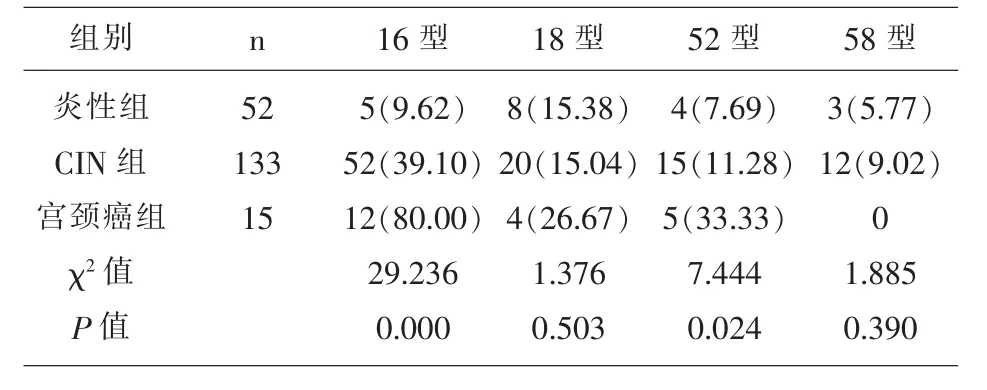
表1 三组患者HPV感染型别分析[n(%)]
2.2 三组患者Th17/Treg细胞比较 宫颈癌组患者的外周血中CD4+IL17+Th17、CD4+CD25+Foxp3+Treg、Th17/Treg细胞均显著的高于CIN组和炎性组(P<0.05),CIN 组患者的 CD4+IL17+Th17、CD4+CD25+Foxp3+Treg、Th17/Treg均显著的高于炎性组(P<0.05);见表 2。
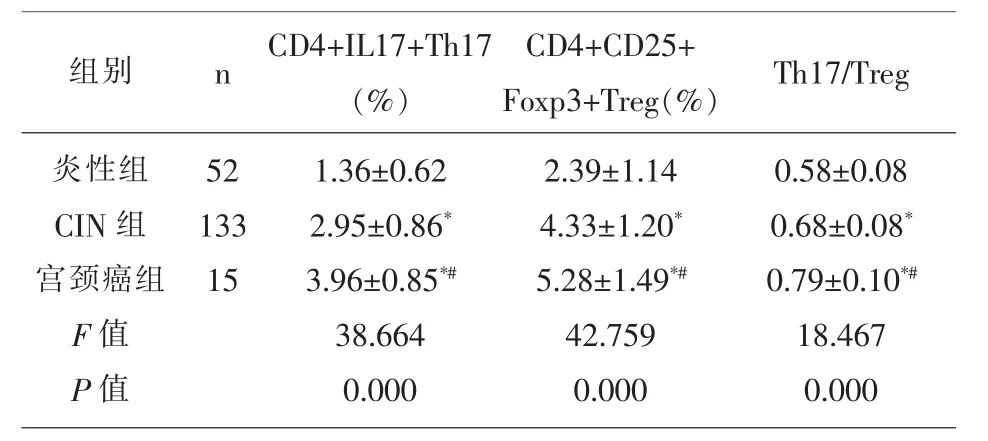
表2 三组患者Th17/Treg细胞比较(x±s)
2.3 三组患者血清细胞因子比较 宫颈癌组患者的血清IL-17、TGF-β、IL-23均显著高于CIN组和炎性组(P<0.05),CIN组患者的血清IL-17、TGF-β、IL-23均显著高于炎性组(P<0.05);见表3。
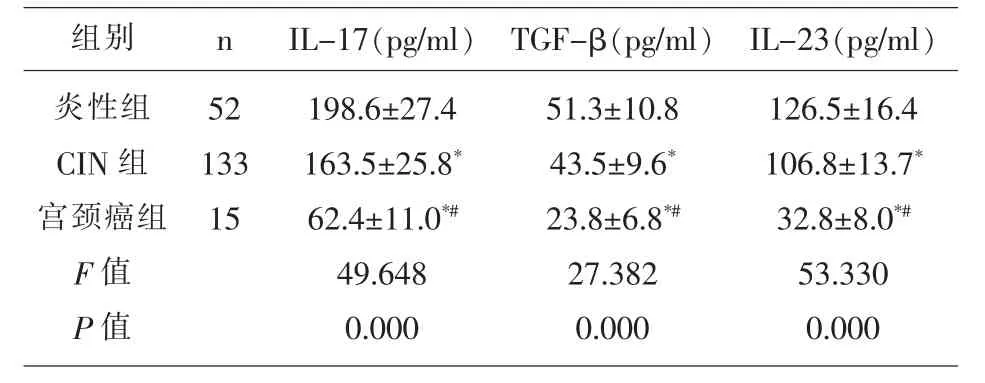
表3 三组患者血清细胞因子比较(x±s)
3 讨论
宫颈柱状上皮细胞的持续性异常分裂,能够促进宫颈恶性肿瘤的发生,特别是在合并有HPV16、HPV18及HPV52等感染的患者中,宫颈癌的发生风险更高[7]。临床上的长期观察认为,宫颈癌的五年生存率不足35%,包括手术在内的相关综合性治疗措施治疗后的无瘤生存时间不足36个月[8]。免疫靶向治疗能够在恶性肿瘤的诊疗过程中发挥重要的作用,其能够抑制肿瘤的复发,提高患者的整体生存预后水平。而本次研究对于宫颈癌患者体内的相关因子的表达分析,能够为临床上宫颈癌的免疫靶向治疗提供理论基础。
HPV16、HPV52等高危型病毒的感染,能够促进癌细胞快速跨越G0期,提高了癌细胞的持续性自我增殖的风险。高危型HPV病毒感染导致的宫颈柱状上皮整合作用,能够提高柱状上皮细胞浸润和突破基底膜组织的能力[9];Th17淋巴细胞能够通过对于炎症性因子的调控和释放,进而促进柱状上皮细胞的病变,Th17细胞分泌的IL-17或者肿瘤坏死因子,均能够促进柱状上皮细胞的持续性DN A扩增,导致癌基因错配修复能力的下降,促进了上皮细胞的异常分化过程[10];Treg细胞是 CD4亚群的重要成员,其对树突状细胞的抗原提呈功能的调控,能够抑制自身T淋巴细胞的免疫能力,降低其对HPV病毒颗粒的清除作用[11]。
本次研究对宫颈病变患者不同高危型HPV亚型的分析可见,在宫颈上皮内瘤变(CIN)及宫颈癌患者中,HPV16型、HPV52型阳性率明显上升,高于良性宫颈上皮组织,其中宫颈癌患者中的HPV 16型、HPV52型阳性率更高,提示了高危型HPV病毒感染对于宫颈病变的影响。但本次研究中并未发现HPV18亚型的差异,这可能考虑与不同地区的流行病学的差异有关[12]。对于免疫性指标的相关研究可见,在CIN及宫颈癌患者中,CD4+IL17+Th17、CD4+CD25+Foxp3+Treg的百分率和 Th17/Treg比例均明显上升,提示了免疫性因素对于宫颈病变发生的影响。通过汇集不同的相关文献,笔者认为这主要与相关免疫细胞的下列作用有关[13]:⑴CD4+IL17+Th17的上升能够通过促进IL-17的合成和释放,促进了其对于宫颈上皮DNA的损伤作用,导致癌基因的扩增速度明显的上升;⑵CD4+CD25+Foxp3+Treg的上升,能够导致th1/th2免疫平衡的紊乱,导致树突状细胞抗原提呈作用的下降,促进了宫颈癌上皮细胞的免疫逃逸过程。徐浩等[14]研究者也认为,在宫颈癌患者中,Th17淋巴细胞的阳性率可平均上升30%以上,特别是在病程较长或者合并有明显的宫旁组织浸润的患者中,其表达阳性率可进一步的上升。Th17/Treg的上升则提示Th17淋巴细胞的上升明显高于Treg的上升幅度,推测Th17淋巴细胞在宫颈病变的过程中发挥了更为显著的促进作用。但部分研究者并不认为CD4+CD25+Foxp3+Treg可明显上升,认为在宫颈癌患者中,存在明显的免疫抑制,CD4+CD25+Foxp3+Treg可明显下降,存在不同的临床结论,考虑可能与宫颈癌患者的临床分期或者指标检测时机的不同有关。白细胞介素17(IL-17)、转化生长因子 β(TGF-β)及白细胞介素 23(IL-23)是炎症性效应因子,在CIN组及宫颈癌患者中,IL-17、TGF-β、IL-23的表达均明显上升,特别是宫颈癌患者中的表达更为明显,提示炎症反应的激活,能够在促进宫颈持续性病变过程中发挥重要作用。这主要由于IL-17、TGF-β、IL-23相关因子的上升,能够影响癌细胞的生物学特征,导致癌细胞的浸润和增殖能力的增强,进而促进了病情的进展[15]。
本次研究的创新性在于探讨了宫颈病变患者中Th17、Treg细胞的表达情况。综上所述,宫颈癌组织中HPV16型、HPV52型感染率较高,体内的Th17、Treg细胞明显上升,同时存在明显的炎症反应激活。
