一种血样中卡托普利的电化学分析方法研究
2020-04-24胡甲元陆浩天翟佳莉葛静如解永岩
胡甲元,陆浩天,翟佳莉,葛静如,解永岩
(1.合肥乐凯科技产业有限公司,安徽 合肥230041;2.安徽医科大学基础医学院,安徽 合肥230032;3.安徽中医药大学药学院,安徽 合肥230012)
卡托普利(Captopril)结构式如图1A,它是一种口服可吸收且能有效控制血压的血管紧张素转化酶抑制剂[1],已经成为医治高血压[2]、心力衰竭[3]、慢性心功能不全[4-5]等心血管疾病的重要药物,但长期或过量使用可能导致经常性干咳、蛋白尿,甚至胆汁淤积等副作用[6-9],因此对血液系统(如血清、血浆甚至全血)中卡托普利的定量分析非常重要。目前已报道的卡托普利的分析方法如毛细管电泳法[10]、高效液相色谱法[11-12]、化学发光法[13]等存在仪器设备昂贵、操作复杂耗时、分析时间长、需要对样品进行衍生等不足。电化学方法具有仪器设备简单、响应迅速、选择性和灵敏度可控等优势[14],因此建立简单快速的卡托普利的电化学分析方法对于指导其临床安全用药,了解其临床上的药效关系等是十分必要的。
8-羟基-1,3,6-三磺酸芘(8-hydroxypyrene-1,3,6-trisulfonic acid trisodium salt,HPTS)(图1B)是一种有机光酸,具有较快的电极过程动力学以及可逆的电化学氧化还原行为,但目前还没有使用HPTS 作为电化学催化剂或者氧化还原电子媒介体对分析物进行电化学分析的报道。
本研究首次采用HPTS 作为卡托普利的电化学氧化的催化剂,建立了一种简单有效的卡托普利的电化学分析方法。本方法具有操作简单、检测速度快等优点,并成功应用于血浆样品中卡托普利的分析检测。
1 实验部分
1.1 药品与试剂
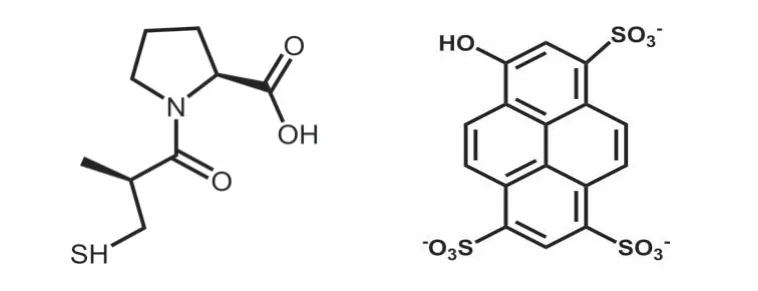
图1 卡托普利(A)和HPTS(B)的化学结构式
卡托普利,阿拉丁化学试剂有限公司;8-羟基-1,3,6-三酸芘(HPTS),阿法埃莎(中国)化学有限公司;Britton-Robinson buffer(B-R buffer)缓冲液由40 mM 磷酸、40 mM 醋酸和40 mM 硼酸组成,用0.2 M NaOH调至不同pH;0.1 M 磷酸盐缓冲溶液(Phosphate-buffered solution,PBS)用磷酸配制调至pH为7.4;实验用水均为超纯水。
1.2 仪器与设备
CHI730E 电化学工作站(上海辰华有限公司);EX125DZH 十万分之一天平(奥豪斯仪器有限公司,常州);PHS-3C型pH计(世纪方舟科技有限公司,成都);超声清洗仪;79-1 磁力搅拌器(国宇仪器制造有限公司,常州)。
1.3 电化学测试
实验采用三电极体系,抛光过后的裸玻碳电极作为工作电极,Ag/AgCl(内参为饱和氯化钾)作为参比电极,铂丝作为对电极。玻碳电极(Φ=3 mm)作为工作电极。使用前首先分别经粒径为3.0 μm、1.0 μm、0.05 μm的Al2O3粉末抛光,然后再置于无水乙醇和水中各超声清洗3 min,N2吹干备用。实验中采用循环伏安(CV)技术和线性扫描(LSV)技术,所有实验均在室温下进行。比较不同pH 条件下HPTS 对卡托普利的电化学催化性能时,为避免不同pH 条件下相同浓度HPTS 自身的氧化电流的不同,数据处理采用归一化处理,即用催化电流比值(ΔI/I)来衡量不同pH 条件下的催化效果。其中ΔI/I=IHPTS+captopril-IHPTS/IHPTS。
1.4 动物手术实验动物
雄性Sprague-Dawley 大鼠3 只(200~250 g),购自安徽医科大学动物实验中心。动物分养于室温和自然光照周期环境中,并自由饮水和取食。实验符合安徽中医药大学生物医学伦理委员会的“实验动物的护理和使用指南”。用3%戊巴比妥钠(1.3 mL/kg)腹腔注射麻醉,从大鼠腹主动脉收集血浆,转移到含有肝素抗凝剂的离心管中,3 000 r/min进行离心,离心15 min,取上清液得到血浆。实验结束后,立即麻醉后断头处死大鼠,动物尸体由安徽中医药大学动物房回收。
1.5 实际样品测试
配制500 μM的HPTS 2 mL(pH为7.4)于烧杯中,分别加入40 μL 的空白血浆(稀释50 倍)和10 μL 2 mM、10 μL 10 mM、10 μL 100 mM 的卡托普利溶液进行实际样品测试,重复三次。采用线性扫描技术(LSV)测定样品溶液,扫描电位0.32~0.68 V,扫速为50 mVs-1。
2 结果与讨论
2.1 基于HPTS卡托普利的电化学催化氧化行为研究
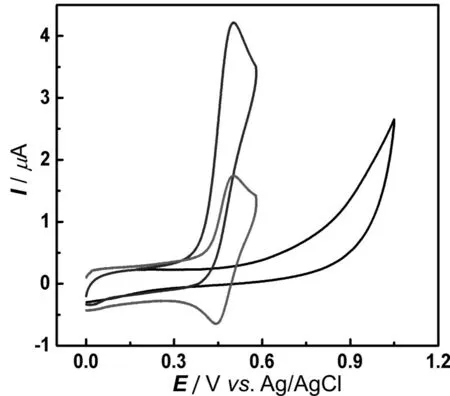
图2 500 μM 卡托普利(黑线)、500 μM HPTS(红线)和500 μM 卡托普利500 μM HPTS混合物(蓝线)在玻碳电极上的循环伏安图(扫描速度:50 mV×s-1)
卡托普利的巯基氧化为二硫键的电化学氧化,具有较大的过电位以及较慢的电极动力学过程,如图2中黑线所示,单独的卡托普利在玻碳电极上从+0.6 V(vs.Ag/AgCl)开始缓慢氧化。HPTS 在pH 7.4 条件下,E1/2为+0.51 V处出现一对可逆的氧化还原峰,对应于HPTS的酚羟基和HPTS 醌自由基的一电子过程[15]。当往HPTS 溶液中加入卡托普利后,可以看到相较于相同浓度单独的HPTS,二者混合物的氧化电流显著增加(图2,蓝线),表明HPTS 对卡托普利的电化学氧化具有明显的催化行为,这为利用HPTS 作为电化学催化剂来建立卡托普利的电化学分析方法提供了先决条件。
2.2 实验条件优化
2.2.1 卡托普利的电化学催化氧化对pH的依赖性考查
以上结果表明,HPTS 可以作为卡托普利电化学氧化有效的电化学催化剂,可以据此建立基于HPTS 的卡托普利的电化学分析方法。由于HPTS 的电化学氧化过程是pH依赖的,因此,我们用CV技术考查了不同pH条件下,HPTS对卡托普利的电化学氧化的催化性能,如图3 所示,溶液pH 从5.0 增大到7.4,HPTS 的E1/2不断负移,随后不再移动。HPTS 氧化电流增加比率(ΔI/I),随着pH 增大不断增加,在pH 为7.4 时,(ΔI/I)达到最大值,而后随着pH 的增大ΔI/I 降低,表明HPTS 在生理条件下(pH 为7.4)对卡托普利的电化学氧化具有最大的催化效果,因此本研究选择pH为7.4作为卡托普利的电化学分析的最优化pH。
2.2.2 卡托普利的电化学催化氧化对HPTS 浓度依赖性的考查
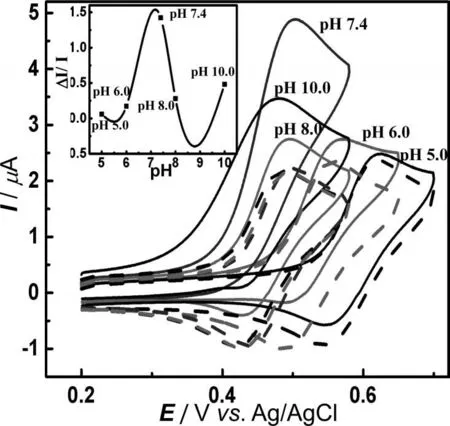
图3 单独的500 μM HPTS(虚线)、500 μM 卡托普利和500 μM HPTS混合物(实线)在不同p H条件下的循环伏安曲线(扫描速度:50 mV×s-1,插入图:催化电流比率(ΔI/I)和溶液pH的关系曲线)
电化学催化剂的浓度大小会直接影响到分析方法的分析性能。我们考查了在最优化pH为7.4下,浓度为200 μM、500 μM、1 mM、2 mM 的HPTS 对不同浓度的卡托普利的电化学催化氧化的影响,结果如图4 所示。在200 μM HPTS 的条件下,卡托普利的电流响应不成线性,这可能是由于较低浓度的HPTS 对卡托普利的电化学催化效果不明显所致。500 mM 的HPTS 的催化电流响应在1~1 000 μM卡托普利的浓度范围成良好的线性关系(I(μA)=0.002 7 C(μM)+1.35,相关系数为0.99)。随着HPTS浓度的增加,灵敏度逐渐降低。基于1 mM HPTS和2 mM HPTS的卡托普利的分析方法灵敏度分别为0.002 5 mA/mM和0.002 3 mA/mM。较高浓度的HTPS 导致方法灵敏度下降,主要是由于高浓度的HPTS 具有较大的氧化背景电流。因此本研究选择500 μM HPTS作为分析卡托普利的最佳实验条件。
2.3 线性考查
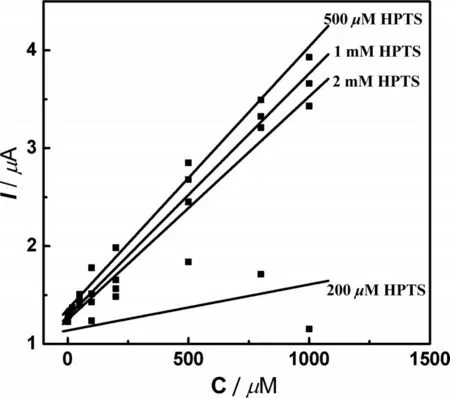
图4 在p H 为7.4条件下,200 μM、500 μM,1 mM、2 mM 的HPTS分别对1 μM、2 μM、5 μM、10 μM、20 μM、50 μM、100 μM、200 μM、500 μM、800 μM和1 000 μM的卡托普利的电化学氧化的峰电流与其相应的浓度之间的线性关系
鉴于上述方法对卡托普利良好的电催化性能,在最优的实验条件下,用线性扫描技术(LSV)对卡托普利电化学分析进行了方法学考查,如图5所示。在1~1 000 μM的浓度范围,氧化电流与卡托普利浓度呈现出良好的线性关系,其线性回归方程为I(μA)=0.002 7 C(μM)+1.35,相关系数为0.99,根据3 σ,计算检测限为0.42 μM。
2.4 实际样品测定
为了评估本方法对实际样品中卡托普利定量分析的有效性,我们用稀释了50 倍的大鼠血浆对本方法进行了验证,结果如图6 所示。结果表明,在最优化实验条件下,空白血浆在本研究建立的基于HPTS 的电化学分析体系中的氧化峰电流响应(红线)与缓冲溶液中获得的氧化峰电流(蓝线)相同,这表明基于HPTS 的卡托普利的电化学方法具有较好的选择性,方法不受血浆中内源性物质电活性物种的干扰。为了进一步验证该方法用于实际血浆中卡托普利定量分析的可行性,对血浆样品进行了加标回收试验。相较于缓冲溶液(蓝线)和空白血浆溶液(红线),加入了10 μM、50 μM 和500 μM卡托普利的血浆,氧化峰电流明显增加。其加标回收实验结果见表1,加标回收率为98.3%,相对标准偏差为2.2%。结果表明,该方法具有较高的准确度和精确度,可以用作卡托普利药物相关的常规检测及临床分析。

图5 浓度为1~1 000 μM的卡托普利和500 μM HPTS混合溶液的线性扫描伏安图(插入图:500 μM HPTS对1~1 000 μM的卡托普利的电化学氧化峰电流与卡托普利浓度之间的线性关系)
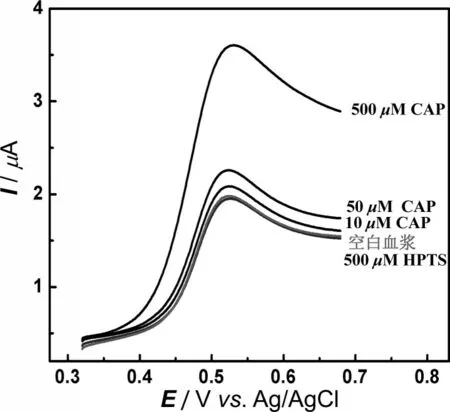
图6 含500 μM HPTS的0.1 M PBS(7.4)溶液(蓝线)、含有50 μM被稀释空白血浆和500 μM HPTS的0.1 M PBS(7.4)溶液(红线)以及在红线溶液中加入10 mM、50 mM、500 mM卡托普利的线性扫描伏安图
3 结论
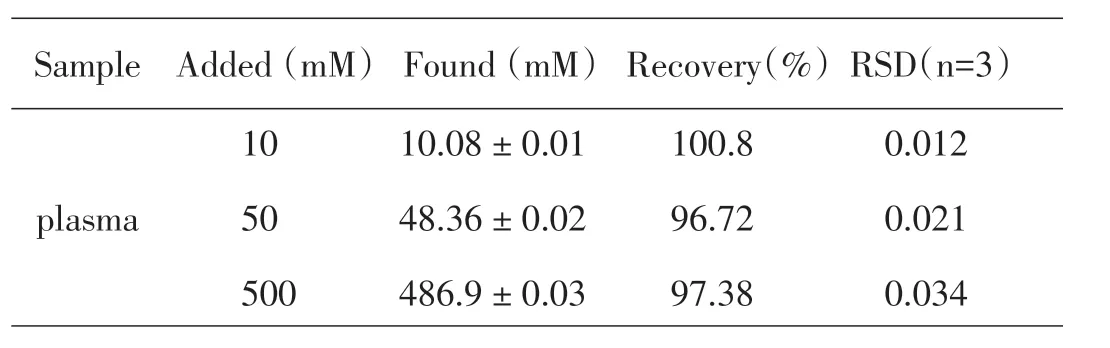
表1 空白血浆的加标回收试验
本研究首次利用HPTS 作为卡托普利电化学氧化的电化学催化剂,建立了一种简单快速、灵敏可靠、选择性好的卡托普利电化学分析方法。结果表明,该方法具有操作简单、响应时间快、选择性好的特点和优势,可有效用于实际血样中卡托普利的定量分析。本研究为卡托普利的临床安全用药以及理解其药效关系提供了有效的手段和方法。
