不同产区葡萄酒中氨基甲酸乙酯产量的比较
2020-04-23王根杰李德美张亚东王宗义
王根杰,李德美,张亚东,辛 闻,王宗义
(北京农学院 食品科学与工程学院/农产品有害微生物及农残安全检测与控制北京市重点实验室,北京102206)
氨基甲酸乙酯(Ethyl Carbamate,简称 EC),是一种已经被认定为具有致癌作用的物质,并广泛存在于发酵食品和酒精饮料中[1][2]。
葡萄酒中EC 的来源有多种途径,而葡萄酿酒酵母代谢产生过量的尿素与发酵产生的酒精结合是生成EC 的主要途径[3][4]。 因此,酵母本身的菌种特性也会影响葡萄酒中EC 的含量。葡萄园土壤中的含氮量是影响葡萄树体及果实中氮素分布的因素之一,葡萄植株通过根系吸收营养物质维持葡萄果实的生长[5]。 葡萄果实中的酵母可利用氮(yeast assimilable nitrogen,简称 YAN)是由游离的NH4+、氨基酸氮和精氨酸代谢产物(主要是尿素和鸟氨酸)3 部分构成[6]。由于尿素是EC 的主要前体物质,因此YAN 的含量会最终影响葡萄酒中的EC 水平[7]。葡萄酒发酵过程中,为避免氮源含量过低而导致发酵受阻,常添加酵母助剂保证发酵完全。 然而,酵母助剂用量过多,也会促进 EC 的生成[8]。
作者选择不同品种、酵母和不同用量酵母助剂进行发酵试验,比较北京房山和河北怀来产区葡萄酒中EC 产量的差异。通过分析比较,筛选出适合该产区生产低EC 产量葡萄酒的工艺条件,为葡萄酒产区鉴别提供可行性,同时也为我国葡萄酒中EC的限量标准提供参考。
1 材料与方法
1.1 材料与试剂
葡萄原料:“美乐”(Merlot) 和 “赤霞珠”(Cabernet Sauvignon)葡萄:采自于河北怀来和北京房山,成熟度良好;葡萄酿酒商业酵母:ST、BO213、F15 以及酵母助剂THIAZOTE:法国LAFFORT 公司产品;铵离子氮试剂盒和氨基酸氮试剂盒:爱尔兰Megazyme 有限公司产品;EC 标准品、EC-d5 内标品:美国Sigma 公司产品;乙腈(色谱级):韩国SK chemicals 公司产品。
1.2 仪器与设备
Agilent 6410 串联液质仪:美国 Agilent 公司产品;双波长紫外分光光度计;北京Lab-Tech 公司产品;超纯水系统:上海Canrex 分析仪器有限公司产品。
1.3 试验设计
选用酵母ST 和BO213 进行发酵试验,研究发酵过程中同种酵母酿造的美乐葡萄酒中的EC 产量在房山和怀来产区的差异。 酵母ST 和BO213 的添加量均为0.2 g/L,在葡萄入罐12 h 后添加。
选择怀来产区的美乐和赤霞珠葡萄进行发酵试验,在均选用F15(添加量为0.2 g/L)为酿酒酵母的条件下,研究同一产区不同品种在添加酵母助剂THIAZOTE 后葡萄酒中的EC 产量差异。 酵母助剂THIAZOTE 的添加量分别为 0.0、0.3、0.6 g/L,记为YNCK、YN0.3、YN0.6。
发酵前期温度控制在20~22 ℃,每12 小时进行一次压帽操作; 发酵中期温度控制在25~28 ℃,每12 小时进行2 次压帽操作; 发酵后期温度控制在22~25 ℃,不进行压帽操作。
1.4 测定方法
1.4.1 土壤中铵态氮和硝态氮含量的测定 土壤中铵态氮含量的测定采用氯化钾(KCl)浸提-靛蓝比色法;土壤中硝态氮含量的测定采用紫外分光光度法[9]。
1.4.2 葡萄中酵母可利用氮含量的测定 采用试剂盒检测氨基酸态氮和铵离子氮含量[10]。
1.4.3 葡萄酒中主要理化指标含量的测定 根据国标GB/T 15038-2006 《葡萄酒、 果酒通用分析方法》测定[11]。
1.4.4 葡萄发酵液或葡萄酒中EC 含量的测定 利用EC-d5 作内标进行测定,可以有效校正整个分析过程产生的误差,使样品处理更为简易,降低了对人员熟练程度的要求[12][13]。
1.4.5 液相色谱-质谱条件 XSELECT HSS T3 色谱柱 (2.1 mm×150 mm,3.5 μm),Zorbax Eclipse Plus-C18预柱(12.5 mm×2.1 mm,5 μm)。 柱温为 40 ℃,进样体积为10 μL,流速为 0.3 mL/min;流动相 A 为体积分数0.1%乙酸水溶液,B 为乙腈; 梯度洗脱顺序如表1 所示。

表1 梯度洗脱程序表Table 1 The sequence of gradient elution
1.4.6 校正标准曲线和回归方程 按照内标法测定EC 含量得到的校正标准曲线如图1 所示,线性回归方程为y=7.9197x+0.006,相关系数R2=0.999 3,方程线性较好,适合本试验中EC 的质量浓度测定。
1.5 数据分析
采用SPSS22.0 进行数据处理与分析,对两个产区葡萄酒中的理化指标含量进行多重比较分析。 利用Excel 绘制发酵过程中的EC 产量变化图。

图1 内标法测定EC 的校正标准曲线Fig. 1 The EC calibration standard curve
2 结果与分析
2.1 土壤中含氮量和葡萄中YAN、葡萄酒中的EC含量分析
氮是植物生长的必需元素[14]。 土壤中的氮素主要通过根系的吸收转移到葡萄树体,维持葡萄植株中氮的正常供应。 土壤中的水解性氮(包括铵态氮、硝态氮)含量与葡萄中的酵母可利用氮含量以及葡萄酒中的EC 含量有着密切的关系[15]。房山和怀来产区“美乐”葡萄园土壤中的铵态氮、硝态氮含量、葡萄原料中的YAN 含量以及葡萄酒中的EC 质量浓度如表2。
由表2 可知,不同产区同一品种葡萄园土壤中的含氮量(主要为硝态氮和铵态氮)、葡萄原料中的YAN 含量和葡萄酒中的EC 质量浓度均不同。 同时,土壤中氮含量高的葡萄原料中的YAN 含量也较高,最终葡萄酒中的EC 质量浓度也较高,这与朱亚楠[15]对葡萄园土壤和葡萄原料中的氮含量与葡萄酒中的EC 质量浓度关系的研究结果一致。

表2 “美乐”葡萄园土壤和葡萄原料中的含氮量和葡萄酒中EC 质量浓度Table 2 The nitrogen of Merlot vineyard and EC content in‘Merlot’ wine
2.2 葡萄酒中理化指标的检测
葡萄酒发酵结束后,葡萄酒经过澄清、分离及稳定性处理后,过滤装瓶。在瓶储室(温度10~15℃,湿度65%~70%)存放2 个月后,取样测定葡萄酒中的理化指标含量。
由表3 可以看出,酵母ST 和BO213 在房山和怀来两个产区酿造的葡萄酒中理化指标含量无明显差异。 葡萄酒中的主要理化指标含量均满足酒精度≥7.0%,还原糖≤4 g/L 和挥发酸≤1.2 g/L 的要求。 葡萄酒质量状况正常,满足葡萄酒中EC 含量的测定要求。

表3 “美乐”葡萄酒的理化指标Table 3 Physicochemical indexes of ‘Merlot’ wine
2.3 葡萄酒发酵过程中EC 产量的变化
葡萄酒发酵是酵母利用营养物质代谢将葡萄汁中的糖转化为酒精和二氧化碳的过程。 适量的无机氮源对酵母生长有促进作用[16]。 在葡萄酒发酵过程中,酵母优先利用的氮源主要是氨基酸和多肽等小分子物质[17]。在葡萄发酵液中氨基酸含量过高时,酵母代谢会产生过量的尿素,尿素排出酵母细胞会与发酵过程产生的酒精结合生成EC。 酵母ST 和BO213 在房山和怀来产区葡萄酒酿造过程中的EC产量变化差异如图 2(a)、(b)。
由图2 可以看出,葡萄酒发酵过程中EC 产量是变化的,发酵初期、中期阶段葡萄酒中EC 产量较低,在发酵末期阶段葡萄酒中EC 产量较高。图2(a)中可以看出,葡萄酒发酵过程中,酵母ST 在房山和怀来产区酿造的美乐葡萄酒中EC 产量的变化趋势一致,且与怀来产区相比,房山产区“美乐”葡萄酒酿造过程中EC 产量更高。在发酵末期阶段,房山产区“美乐” 葡萄酒中的EC 产量积累与怀来产区相比,增加了 28.0%。 图 2(b)中可以看出,葡萄酒发酵过程中,酵母BO213 在房山和怀来产区酿造的“美乐”葡萄酒中EC 产量变化趋势一致。 在发酵中期、末期阶段,与怀来产区相比,房山产区酿造的美乐葡萄酒中EC 产量分别增加了25.6%和24.5%。

图2 同种酵母在不同产区酿造的美乐葡萄酒发酵过程中EC 产量的差异Fig. 2 The comprison of EC content in Merlot wine fermented by the same yeast from different regions
2.4 在发酵过程中添加同种酵母助剂对EC 产量的影响差异分析
葡萄酒发酵过程中,酵母营养物质的缺乏,会导致葡萄酒发酵迟缓甚至停滞。 因此,在葡萄酒发酵过程中常添加酵母助剂保证发酵正常进行。 酵母助剂中的主要成分是磷酸氢二铵,可以加快发酵速率,使发酵完全。 然而磷酸氢二铵含量过高,也会产生EC。 怀来产区“美乐”和“赤霞珠”葡萄酒添加同种酵母助剂不同用量酿造的葡萄酒中EC 产量变化见图3。
由图3 可以看出,在使用同种酵母F15 发酵过程中,不同酵母助剂用量处理酿造的葡萄酒中EC产量差异明显。 添加酵母助剂后,在发酵中期、末期阶段,YNCK、YN0.3、YN0.6 三者相比,“美乐”和“赤霞珠” 葡萄酒中的EC 产量积累高低顺序均为YN0.6>YN0.3>YNCK。在葡萄酒发酵过程中,添加同一酵母F15 助剂酿造的“美乐”和“赤霞珠”葡萄酒中EC 产量相比,“赤霞珠” 葡萄酒中的EC 产量较高。 在发酵末期阶段,与“美乐”葡萄酒相比,YNCK、YN0.3 和YN0.6 在“赤霞珠”葡萄酒中的 EC 产量分别增长了30.0%、24.5%和27.6%。 这可能与葡萄品种本身特性和葡萄细胞内的调控基因有关。

图3 添加同种酵母助剂不同用量在不同品种葡萄酒发酵过程中EC 产量的差异比较Fig. 3 The comprison of EC content in different wines fermented by the same yeast nutrients with different dosages
2.5 “美乐”葡萄酒中EC 质量浓度测定结果
葡萄酒在发酵结束后,怀来和房山产区的葡萄酒放置在相同的条件 (温度10~15 ℃,湿度65%~70%) 下贮存,2 个月后取样测定葡萄酒中的EC 含量如表4。
由表4 可以看出,不同酵母酿造的“美乐”葡萄酒中EC 质量浓度不同,同时可以看出不同产区酿造的美乐葡萄酒中的EC 含量不同。 房山产区 “美乐”葡萄酒中的EC 质量浓度均高于怀来产区,葡萄酒中的EC 质量浓度均低于10 μg/L,符合葡萄酒中的 EC 限量标准[18]。
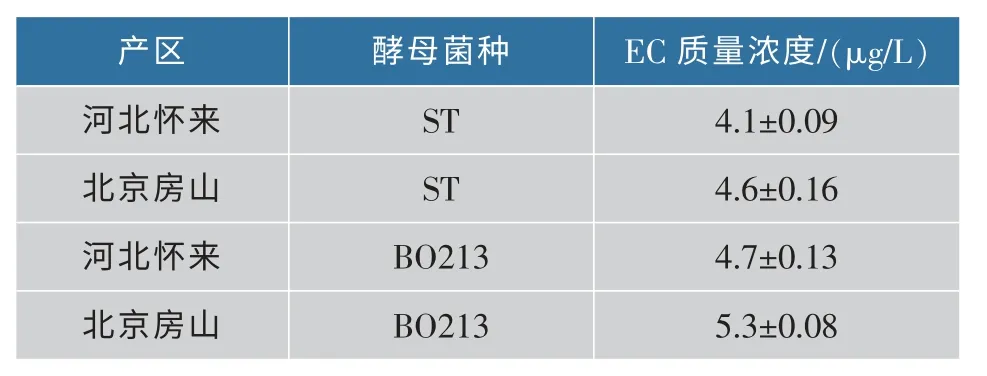
表4 “美乐”葡萄酒中的EC 质量浓度Table 4 EC content in Merlot wine
3 结 语
主要研究了葡萄酒发酵过程中不同产区葡萄酒中EC 产量的差异。 对葡萄园土壤和葡萄原料中的含氮量与葡萄酒中的EC 产量关系表明,葡萄园土壤和葡萄原料中的含氮量与葡萄酒中的EC 产量变化趋势一致。 在“美乐”葡萄酒发酵过程中,结果表明酵母ST 和BO213 酿造的葡萄酒中的EC 产量在怀来和房山产区表现不同,怀来产区葡萄酒中的EC 产量要低于房山产区。 这可能主要与葡萄园土壤环境、葡萄园栽培管理有关。
另外,分析比较了怀来产区“美乐”和“赤霞珠”葡萄酒发酵过程中,添加同种酵母助剂酿造的葡萄酒中EC 产量的差异。结果表明,在葡萄酒发酵过程中,同种酵母助剂在不同品种酿造的葡萄酒中EC产量不同。 在发酵末期阶段,房山产区葡萄酒中EC产量的积累量均高于怀来产区。
试验测定的葡萄酒为发酵过程中的发酵液和发酵结束的原酒,葡萄酒中的EC 含量测定结果范围为 1.0~7.4 μg/L,均低于 10 μg/L,符合葡萄酒中EC 限量标准,这也朱亚楠等对葡萄原酒中测定的EC 含量较低的结果一致。 通过试验,可以说明在现有的生产工艺条件下,酿造的葡萄酒中的EC 产量处于较低水平,不会造成葡萄酒在EC 方面的安全问题。
