超声波对鸡骨蛋白酶解产物的影响及机理研究
2020-04-23刘亚萍
万 婕,张 慜 *,刘亚萍
(1. 江南大学 食品学院,江苏 无锡 214122;2. 广东嘉豪食品有限公司,广东 中山 528400)
鸡骨架是鸡肉类加工过程中的副产品,是所有畜禽骨肉中蛋白质含量最高的原料,蛋白质质量分数可达16.3%,与等量鸡胸肉相似。鲜鸡骨架质量占整鸡质量的比例约为20%~22%,大致由71%的鸡骨,22%的鸡骨肉及6%的鸡皮构成。 新鲜鸡骨中含有丰富的营养素,尤其是蛋白质和矿物质,此外鲜骨内含有大量骨髓,主要由水分、粗蛋白质、粗脂肪和微量元素等物质构成[1]。 目前,工业生产上对鸡骨架的利用还存在利用途径少、产品价值低等问题,其主要经过粉碎烘干后作为宠物饲料,甚至直接丢弃[2]。
随着科学技术的进步,食品加工、设备制造等技术的发展给骨类食品的产业化发展带来了新的机遇,鲜骨加工产业的原料利用率和产品附加值有所提高,研究表明,骨蛋白酶解后释放的氨基酸及多肽具有如下特点:加工性能提高,表现在酶解产物的溶解性、吸水性、保水性、乳化性、起泡性及持油性等方面[3,4];功能性显著,胶原多肽具有降血压[5]、抗氧化[6]、促进皮肤胶原代谢等生物活性与功能[7];风味增强,骨蛋白经酶解后,具有肉的特殊鲜味与香味,可作为肉味香精的前体,通过后期的美拉德反应可制备出各种风味的香精调味料[8,9]。 因此,探究鸡骨架的深加工技术和应用,提高其产品附加值,对于充分利用低值蛋白资源具有重要意义。
近年来,有不少研究探讨和报道了低值畜骨的综合利用,其主要是利用蛋白酶酶解低值蛋白,实现低值蛋白源的高值化。 为了提高其酶解速率,一些研究者探索将部分新技术引入其中。 超声波属于一种弹性机械波[10],其频率范围在 2×105~2×109Hz之间,在介质中传播时,可能产生热效应、机械效应和空化效应等,其中空化作用被认为是影响超声波在液体介质中反应速度和产率的主要原因。 空化作用可引起多种次级效应,如湍动效应、微扰效应、聚能效应等[11],这些效应能够改变蛋白质的构象和特性,强化提取过程、加速反应进程。 超声波在反应过程中产生的气泡经过挤压破裂,能在瞬间产生较强的机械剪切力,对液体介质中的大分子产生机械性断键作用,从而促使更多亲水基团的暴露,有利于底物与酶的结合,提高蛋白质的水解程度[12-14]。
作者以鸡骨架为原料,采用Alcalase 碱性蛋白酶和Flavourzyme 风味蛋白酶水解鸡骨蛋白,以水解度、多肽含量等作为测试指标,研究超声波处理应用于双酶分步酶解鸡骨蛋白,探讨不同超声条件对鸡骨蛋白的酶解效果的影响,并针对其结果进行机理初探。
1 材料与方法
1.1 材料与试剂
原料:鸡骨架,超市购买,冷冻贮藏保存备用。
Alcalase 蛋白酶、Flavourzyme 蛋白酶:诺维信公司产品;甲醛溶液、三氯乙酸、氢氧化钠、硫酸铜、牛白蛋白、溴化钾等试剂均购置于国药集团化学试剂有限公司。
1.2 仪器与设备
2-16PK 型高速冷冻离心机:Sigma 公司产品;JY98-3D 超声波细胞粉碎机:宁波新芝生物科技股份有限公司产品;UV2600 型紫外分光光度计:Techcomap 公司产品;FA1004 型电子分析天平:上海舜宁恒科学仪器有限公司产品; 实验室pH 计Starter 3100:奥豪斯仪器(上海)有限公司产品;8S-1型磁力搅拌器:江苏省金坛市金城国胜实验仪器厂产品;SSW-420-2S 型电热恒温水槽:上海博迅实业有限公司医疗设备厂产品;真空冷冻干燥机:作者所在实验室设计组装。
1.3 试验方法
1.3.1 鸡骨蛋白酶解液的制备方法 将鸡骨架解冻后清洗除去多余的血渍,去除鸡皮及油脂,用粉碎机粉碎成鸡骨泥,将鸡骨泥与去离子水以1∶2 的质量比混合,充分搅拌后,经过110℃ 30 min 高温高压预处理,调节温度和pH 值,酶解总时间为3 h,酶解完毕后沸水浴灭酶10 min,4 500 r/min 下离心15 min,过滤除去悬浮物与碎骨渣,即得酶解液。
酶解过程中采用超声波辅助酶解的处理方式,即酶解鸡骨蛋白的同时进行超声处理,超声功率分别为 200、400、600、800、1 000 W,超声工作时间/间歇时间2 s/2 s,超声总时间分别设置为 20、40、60、80 min。
双酶分步酶解的具体操作过程为:先用NaOH溶液和稀盐酸调节鸡骨泥匀浆的pH,首先调节pH值至8.5,向其中添加质量分数为0.2%的碱性蛋白酶,搅匀,55℃下恒温酶解1.5 h 后;再将pH 值调节至7,向其中添加质量分数为0.2%的风味蛋白酶,搅匀,50℃下恒温酶解1.5 h,制得酶解液。

图1 超声波辅助酶解装置示意图Fig. 1 Schematic diagram of ultrasound-assisted enzymolysis equipment system for chicken bone
1.3.2 水解度的测定 采用中性甲醛滴定法,即甲醛滴定出氨基氮质量分数 (具体参见国标 GB/T 5009.39-2003 中所述方法),凯氏定氮法测定出总氮质量分数 (具体参见国标 GB 5009.5-2010 中所述方法),两者的百分比记为水解度。

1.3.3 多肽质量浓度的测定 采用双缩脲法[15]测定多肽含量,以牛白蛋白(BSA)作为标样,分别配置成0.5、1、2、3、4 mg/mL 的溶液,取 2 mL BSA 溶液与 3 mL 双缩脲试剂均匀混合,静置 30 min 后,于 540 nm 下,测定标样的吸光度值,并绘制标准曲线。 样品中多肽质量浓度测定时,取2 mL 的多肽酶解液,加入等体积的体积分数10%三氯乙酸,均匀混合后于4℃、4 000 r/min 高速冷冻离心20 min 得到上清液,取上清液,按照标准曲线测定方法,测定出相应的吸光度值,按以下公式计算多肽质量浓度。

式中:A 为吸光度值,n 为稀释倍数。
1.3.4 电子舌分析 取酶解液70 mL,分别倒入电子舌专用测试杯中,使液面低于刻度线0.5~1.0 mm,机器自动测试4 次,分析时取后3 组实验的平均值,并转化为各味觉的响应值数值再输出。 响应值差异越大表明差异越大,正值表明该味觉比对照组强,负值则相反。
1.3.5 氨基酸组成测定 用10 g/dL 三氯乙酸等体积稀释,放置1 h,保证溶液体系中TCA 终质量分数为5%,双层滤纸过滤后,取1 mL 澄清滤液于1.5 mL离心管内,10 000 r/min 下离心 15 min,后取 400 μL上清液于液相样品瓶内,置于氨基酸分析仪上测定。
1.3.6 傅里叶变换红外光谱(FT-IR)分析 采用溴化钾(KBr)压片法制片后置于配有DTGS 检测器的IS 10 型傅里叶红外光谱仪上进行检测。
将酶解液冻干后磨粉,再放入玛瑙研钵中磨为细粉,加入适量的KBr 搅磨均匀,然后压片待测。
2 结果与分析
2.1 超声作用对酶解产物水解度及多肽含量的影响
由图2 可知,随着超声功率的增加,鸡骨蛋白酶解液的DH 及其多肽含量均呈现先上升后下降的变化趋势。 超声波功率为200~600 W 时,鸡骨蛋白的 DH 有显著提高(P<0.05),且在 600 W 时达到最大值,为17.99%,当超声波功率超过600 W 时,鸡骨蛋白的DH 开始下降,1 000 W 时下降至14.13%;而超声功率为200~800 W 时,鸡骨蛋白酶解液的多肽质量浓度呈上升趋势,且在800 W 时达到最大值2.91 mg/mL,1 000 W 时酶解液的多肽质量浓度下降至2.73 mg/mL。这可能是因为,鸡骨蛋白的空间结构在适当功率的超声波作用下会发生改变,蛋白质内部的活性部位暴露出来,与酶更好的结合,此外,超声波的振荡作用可以使酶与底物的碰撞几率增大,促进二者的结合,从而提高酶解产物的DH。 但当超声波功率过大时,蛋白分子的活性部位、蛋白酶的分子构象均会被损伤,导致酶解产物DH 的下降[11]。
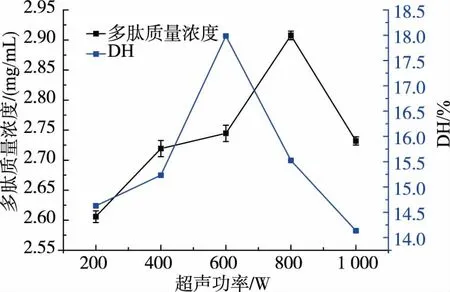
图2 超声功率对鸡骨蛋白酶解液多肽质量浓度及水解度的影响Fig. 2 Effect of ultrasonic power on the peptides content and DH of chicken bone hydrolysate
图3 表示的是超声处理时间对鸡骨蛋白酶解产物特性的影响。 随着超声时间的延长,鸡骨蛋白酶解液的DH 及多肽含量同样呈现先上升后下降的变化趋势,这与超声功率所述规律一致。 当超声时间为30 min 时,DH 达到24%,多肽质量浓度达到2.14 mg/mL,此后,延长时间DH 及多肽质量浓度反而下降。 这可能是因为超声时间适宜时,超声改变了蛋白质结构,加大了酶与底物的结合速率和产物的释放速率[13],从而促进了酶解过程的进行。然而随着超声时间的延长,超声的空化作用和扰动作用有可能使已游离的蛋白质分子重新聚合,形成大分子物质,底物分子构象的改变进而使其对酶解的促进作用减弱[16]。

图3 超声时间对鸡骨蛋白酶解液多肽质量浓度及水解度的影响Fig. 3 Effect of ultrasonic time on the peptides content and DH of chicken bone hydrolysate
由于酶解过程中同时存在着两个过程:蛋白降解成肽和氨基酸;多肽被进一步降解成小分子肽和氨基酸。 两个过程同时存在并产生“竞争”关系,最终产物中肽的含量取决于谁在“竞争”占得优势。 如果蛋白降解成肽的速度快于肽降解成氨基酸的速度,那么肽的质量浓度则增加,若肽释放成氨基酸的速度快于蛋白质降解成肽的速度,则水解产物中的肽质量浓度降低。 由图2~3 可知,超声作用可能会促进蛋白质降解为多肽及多肽进一步降解为氨基酸的过程。

表1 电子舌传感器检测不同超声功率下的鸡骨蛋白酶解液响应值Table 1 Senor outputs of chicken bone hydrolysate obtained by the electronic tongue at different ultrasonic power
2.2 超声作用对鸡骨蛋白酶解液滋味的影响
表1 和表2 所示,在一定的超声强度和时间内,酶解液的滋味增强。 以酶解液的苦味响应值来看,随着超声波功率的增强和超声时间的延长,苦味的变化趋势呈现先增大后减少的趋势,这基本与超声对酶解液DH 的影响趋势相同,而鲜味的规律趋势与苦味大致相反。 研究表明,影响酶解液苦味的主要是苦味肽而不是游离氨基酸[17]。 有学者认为[18],DH 持续增大,苦味肽浓度增高,酶解产物的苦味越来越强,当水解增大到一定程度,苦味肽被水解成小分子肽和游离氨基酸,它们难以满足苦味形成的条件,所以酶解产物的苦味强度反而降低。 与苦味不同的是,酶解产物的鲜味主要受酶解过程中鲜味氨基酸的影响,所以呈现相反的趋势。

表2 电子舌传感器检测不同超声时间下的鸡骨蛋白酶解液响应值Table 2 Senor outputs of chicken bone hydrolysate obtained by the electronic tongue at different ultrasonic time
由图4~5 可以看出,在最适超声条件(800 W,30 min)下会引起苦味值增强,鲜味值下降,但就酶解液中两者的阈值来看,鲜味值远远大于苦味值,且鲜味肽对苦味具有遮蔽作用[19-20],继续增强超声强度虽然会使苦味值下降,鲜味值上升,但会引起酶解液的水解度及多肽含量下降。
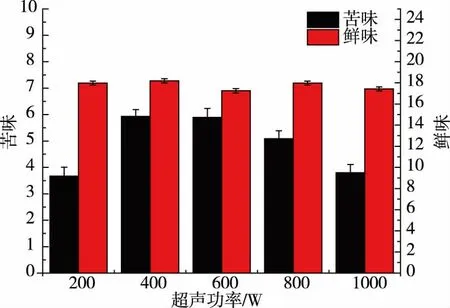
图4 鸡骨蛋白酶解液在不同超声功率下的苦味值和鲜味值Fig. 4 Bitterness and umami values of chicken bone hydrolysate at different ultrasonic power

图5 鸡骨蛋白酶解液在不同超声时间下的苦味值和鲜味值Fig. 5 Bitterness and umami values of chicken bone hydrolysate at different ultrasonic time
2.3 超声作用对鸡骨蛋白酶解液氨基酸的影响
从表3 中可以看出不同处理方式的鸡骨蛋白酶解产物的氨基酸组成和总量的差异,虽然色氨酸没有测出,但必需氨基酸(包括组氨酸)占到了总氨基酸质量分数的40%以上,其中对照组比例(没有加入超声波进行辅助酶解)为49.51%,超声波处理组的比例为51.52%。 酶解过程中,鸡骨蛋白被逐渐分解成小分子肽和游离氨基酸,这些游离氨基酸包括鲜(甜)味氨基 酸 ,如 Glu、Asp、Ser、Thr、Gly、A1a等,苦味氨基酸,如 Phe、Val、Leu、Ile、Tyr、His、Arg、Lys 等,这些呈味氨基酸的含量和所占比例会影响酶解产物风味的形成。 由表3 中可以看出,经过超声处理后,鲜味氨基酸和苦味氨基酸质量分数均有所提高,虽然苦味氨基酸质量分数的增加(尤其是苯丙氨酸、亮氨酸)有可能增添酶解产物的不愉悦风味,但由于苦味氨基酸的呈味阈值远远高于鲜味氨基酸,所以对酶解液呈味评价的负面影响降低。

表3 酶解产物的氨基酸组成Table3 Amino acid composition of hydrolysate from chicken bone %
2.4 超声作用对鸡骨蛋白结构影响的探究
由图6 比较可得,鸡骨蛋白在酶解前和酶解后的吸收峰出现了较大的差异,主要表现在:3 300 cm-1附近的酰胺A 带(表征N-H 伸缩振动)、3 100 cm-1附近的酰胺B 带 (被认为是酰胺Ⅱ带的一次泛频,费米共振)、1 660 cm-1附近的酰胺Ⅰ带 (表征C=O伸缩振动)、1 570 cm-1附近的酰胺Ⅱ带(表征N-H 面内弯曲振动和C-N 伸缩振动)以及1 300 cm-1附近的酰胺Ⅲ带(表征C-H 伸缩振动和N-H 面内弯曲振动)。 另外,对比图6 中酶解液有无超声处理得到的吸收峰值(EH 和EHUS)可知,超声处理组使得其吸收峰值蓝移,其原因可以由酰胺 A 带(3400~3440 cm-1)蓝移现象为例进行解释:酰胺A 带是 N-H 或 O-H伸缩振动的吸收峰,超声处理破坏了蛋白分子间的氢键,而N-H 基团的分子肽段参与了氢键形成,所以造成蓝移现象[21]。

图6 鸡骨蛋白及其酶解产物结构分析Fig. 6 The infrared spectrogram of chicken bone and the hydrolysate from chicken bone
为进一步探究超声处理对其结构的影响,图7对上述4 种样品光谱图中的酰胺Ⅰ带(1 700~1 600 cm-1)进行曲线拟合。酰胺Ⅰ带对于蛋白质二级结构的研究具有重要意义,其主要对与肽键有关的氢键敏感。 有研究表明,超声波的机械作用和空化作用会破坏蛋白质的网络结构,打乱蛋白质分子不同化学键之间的联系。 表4 显示,超声处理会使鸡骨蛋白紧密的α 螺旋结构打开,其质量分数由未处理前的30.71%降为处理后的23.86%,这与黄丹丹等人[21]研究的超声预处理使金枪鱼皮胶原蛋白α 螺旋降低的变化趋势一致。 这可能是因为超声波使得蛋白质分子间的氢键断裂,蛋白分子活性位点被更多的暴露,从而使得酶解产物的DH 和活性肽段释放效率得到提高。

图7 鸡骨蛋白及其酶解产物的酰胺I 带曲线拟合Fig. 7 Curvefitted results of amide I bands

表4 鸡骨蛋白的二级结构质量分数分析Table 4 The secondary structure of chicken bone
3 结 语
超声波处理有助于促进鸡骨架的水解,超声辅助鸡骨蛋白水解的最适条件为:超声功率800 W,超声时间30 min,此条件下,DH 可达24%。 氨基酸和电子舌分析表明,超声处理使得酶解液中鲜味氨基酸含量提升,鲜味增强。 蛋白质结构分析表明,超声会破坏蛋白质分子的网络结构,使其活性位点被更多的暴露,从而提高了酶解过程中的DH 和活性肽段的释放效率。
研究结果表明,超声波处理虽然可以提升酶解产物的多肽含量及氨基酸含量,但提升幅度较小。超声处理在提高水解度的同时也会使苦味增强,但相较于鲜味,苦味响应值较小且呈味阈值较高,所以其负面影响有限。
