大米蛋白-酪蛋白共架体构建及其自乳化行为研究
2020-04-23陈正行徐鹏程李亚男
岳 明 ,陈正行 ,徐鹏程 ,王 涛 ,李亚男 ,王 韧 *
(1. 粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡214122;2. 江南大学 食品学院,江苏 无锡214122)
大米蛋白的氨基酸配比合理,营养价值优于其他谷物类蛋白[1]。但是,较差的水溶性严重限制了其大米蛋白的应用范围。 在食品体系中,大米蛋白常作为固体营养物添加于运动类食品中,或作为低敏性食物添加到婴幼儿食品中[2]。 徐兴凤[3]等人通过生物酶解改性大米谷蛋白,陆钫[4]等人采用化学糖基化改善大米蛋白功能特性,此类方法在一定程度上提高了大米蛋白的水溶性[5,6],但不可避免的是,改性过程造成营养物质流失,或者化学物质的引入。 近年来,国内不断有进行改善大米蛋白溶解度的研究,但在如何提高大米蛋白溶解度的同时又保持其独特的营养特性却鲜有报道。
大米蛋白具有良好的乳化性、起泡性以及凝胶性等特性。 其中,蛋白乳化特性在食品体系中起到稳定体系、促进分散相形成等作用。 食品中常见的纳米乳液有油包水(W/O)和水包油(O/W)两种,为了避免乳液出现蛋白质聚集、油滴絮凝、贮藏稳定性较差等问题[7,8],相关研究主要采用在乳化过程中加入多糖、凝胶等乳化剂的方法,增强蛋白质乳化性和乳液稳定性[9],但乳化剂的引入限制了乳液在食品体系的应用。 目前,国内针对自乳化的研究多面向于药物运载的应用[10,11],而在食品体系中研究大米蛋白自乳化行为的报道更是空白。 作者以大米蛋白为原料,通过结合酪蛋白改善其溶解度并进行水相与油相丁香酚自乳化,探究乳液对丁香酚的控释效果。
1 材料与方法
1.1 材料与仪器
大米:中粮食品营销有限公司提供;丁香酚,8-苯胺-1-萘磺酸(ANS),考马斯亮蓝 R-250:购自1Sigma-Aldrich 公司; 酪蛋白,十二烷基硫酸钠(SDS),氯化钠等其他试剂:分析纯,购自上海国药集团化学试剂有限公司。
POLY 15 磁力搅拌器,美国 Thermo Scientific公司产品;D-37520 Osterode 小型高速离心机:德国Sigma zentrifugen 公司产品; 等温滴定量热仪(PEAQ-ITC):英国 Malvern Instrument;纳米粒度及ZETA 电位仪 (Zetasizer nano ZS):英国 Malvern Instrument 公司产品;F-7000 荧光光谱仪:日本Hitachi 公司产品;全自动表面张力仪(DCAT21):德国Dataphysics 公司产品;UV-3200 紫外-可见分光光度计:上海美普达仪器有限公司产品;原子力显微镜(Dimension ICON):德国 Bruker 公司产品。
1.2 实验方法
1.2.1 大米蛋白-酪蛋白共架体的制备 将大米蛋白分散于去离子水中形成1 g/dL 的蛋白质分散液,用4.0 mol/L NaOH 将样品调至pH 12.0 并搅拌1 h。加入相同质量的酪蛋白持续搅拌1 h 后,逐滴加入0.05 mol/L HCl,调节样品 pH 至 7.0。 在 4 ℃,7 000 g下离心样品10 min,上清液用MD 45 透析袋在去离子水中透析12 h,去除溶液中的盐分,随后将样品进行冷冻干燥。
1.2.2 凝胶电泳实验 蛋白质相对分子质量的测定采用 Laemmli 法[12]。 配置 pH 为 6.8,含 0.125 mol/L Tris-HCl、质量分数10% SDS、20%甘油以及体积分数2%的巯基乙醇(2-ME)的上样缓冲溶液。 取5 mg/mL 得样品和标准蛋白质分别溶解于其中,95 ℃下加热 5 min,冷却,10 000 r/min 转速下离心30 s。 在电泳凝胶中加入 10 μL 上清液,100 V 恒压下分离1 h。 分离结束后将电泳凝胶放入考马斯亮蓝染色液质量分数 0.05%,(v(甲醇)∶v(乙酸)∶v(水)=25∶10∶65)中着色,随后在 v(甲酸)∶v(乙醇)∶v(水)=1∶1∶8 的脱色液中脱色 24 h。
1.2.3 溶解度的测定 蛋白质溶解度的测定采用凯氏定氮法(GB 5009.5-2010)。
1.2.4 表面疏水性的测定 采用ANS 荧光探针法测定蛋白质表面疏水性[13]。取0.1 g 样品分散于10 mL pH=7 的磷酸盐缓冲溶液中(10 mmol/L),将样品溶液分别稀释成质量分数0.001 5%、0.003%、0.006%、0.012%以及0.015%5 个浓度梯度。取10 μL 新鲜配置的 ANS 溶液(8 mmol/L)置于 4 mL 稀释后的样品中,振荡混匀。 在激发波长390 nm 和发射波长484 nm 下,测定样品荧光强度。 以测定的荧光强度与相应蛋白质浓度作图后进行线性拟合,将所作线性回归曲线的斜率作为蛋白质表面疏水性。
1.2.5 表面张力测定 采用有Du Noüy 探针环的全自动表面张力仪进行油水表面张力的测定。 取25 mL 丁香酚与等体积的去离子水或共架体蛋白溶液置于 100 mL 烧杯中,将 Du Noüy 探针环浸没在密度较大的一相,通过表面张力仪自动调节,将探针环调节到靠近两相界面的位置,以恒定速度使探针环拉过界面,同时测定在此过程中探针环上作用力的变化。 将探针环在拉过相界面过程中的最大作用力作为两相的界面张力γ。
1.2.6 等温滴定量热实验 等温滴定量热法(Isothermal titration calorimetry,ITC):配质量分数为0.1%的大米蛋白质和2 mg/mL 丁香酚水溶液,过膜后高速离心去除气泡。 通过PEAQ-ITC 等温滴定量热仪分析25 ℃条件下样品的反应模式。 将样品预先脱气,取 400 μL 蛋白液于样品池,50 μL 丁香酚水溶液于注射器。 样品针转速为350 r/min,待仪器平衡后,向样品池滴入丁香酚水溶液,程序设定为每8 s 滴入3 μL 丁香酚并平衡反应150 s。 以超纯水与蛋白液的反应过程为对照。
1.2.7 自乳化实验及乳液成分测定 自乳化实验,取7 份0.01 g 共架体蛋白分别溶于10 mL 去离子水(质量分数 0.1%),并分别加入 5、10、30、50、100、200、300 μL 丁香酚,置于 POLY 15 磁力搅拌器以600 r/min 转速乳化 1 h,分别作为 A、B、C、D、E、F、G共7 种乳液后续实验原料。
乳液成分分析实验,取上述乳液各1 mL,用乙醇稀释10 000 倍,用紫外-可见分光光度计在281 nm 下测定相应吸光值,通过吸光值与丁香酚质量分数的标准曲线,计算丁香酚质量分数。 乳液中蛋白质质量分数的测定将采用1.2.3 中凯氏定氮法。
1.2.8 乳液的粒径分布、多分散系数(polydispersity index,PDI) 及 Zeta-电位的测定 将 1.2.7 所制备的乳液用去离子水稀释100 倍后,取1mL 样品放入Zeta-电位比色皿中用纳米粒度及Zeta-电位仪在室温条件下分别对乳液的粒径分布、Zeta-电位及多分散系数进行测定。
1.2.9 贮藏实验 将制备的乳液放置于25 ℃恒温箱贮藏28 d,以7 d 为一周期,取样稀释100 倍进行粒径分布和Zeta-电位的测定。
1.2.10 丁香酚控释实验 取10 mL 乳液于MD44型号透析袋中,放置于5 000 mL 去离子水透析8 h。不同时间段取样,采用方法1.2.6 测定丁香酚释放量,以饱和丁香酚水溶液为对照。
1.2.11 数据分析 试验结果均取3 次平行结果平均值,采用 origin 8.9 作图,SPSS 21.0 进行 ANOVA方差分析。
2 结果与分析
2.1 大米蛋白/酪蛋白共架体蛋白质的表征
2.1.1 复合体蛋白一级结构的测定 通过凝胶电泳分析蛋白质相对分子质量,对比复合体蛋白与原蛋白一级结构差异。 由图1 所示,大米蛋白质相对分子质量分布于 2.5×105、2.5×104~3.7×104以及1 000~2 000 范围内,酪蛋白的主要相对分子质量分布在 2.5×104~3.7×104区域内,复合体蛋白相对分子质量分别在 2.5×105、2.5×104~3.7×104以及 1 000~2 000 内,且 2.5×104~3.7×104内的条带变粗颜色加深,表明该范围内的蛋白质亚基含量增多。 通过对比可得,溶于去离子水的复合体蛋白未发生水解并保持了大米蛋白和酪蛋白良好的一级结构,与Wang[14]等人研究结果一致。

图1 凝胶电泳图像Fig. 1 Gel electrophoresis image
2.1.2 共架体蛋白溶解度测定 由表1 所示,未经处理的大米蛋白在水中的溶解度仅为1.65%,这与崔莎莎[15]等研究结果一致。经与酪蛋白复配处理后,大米-酪蛋白共架体的溶解度显著提高至91.01%,说明酪蛋白与大米蛋白结合促进了大米蛋白在水中的溶解性。 鉴于酪蛋白在复配过程中添加量,大米蛋白溶解度的提高幅度至少为49 倍,具有极显著的改性效果,说明本研究所采用的改性方法是一种高效、绿色的物理改性手段。
2.1.3 共架体蛋白疏水性表征 从图2 可知,大米蛋白表面疏水性过高导致大米蛋白难溶于水[16],与酪蛋白结合后,共架体蛋白表面疏水性显著降低,是由于大米蛋白与酪蛋白结合过程中三级结构展开,并发生一系列的结构折叠变化,从而将大量疏水基埋藏在蛋白体内部,表明酪蛋白与大米蛋白之间通过疏水作用结合[17]。

图2 3 种蛋白质表面疏水力对比Fig. 2 Contrast surface hydrophobic of the three type proteins
2.2 共架体蛋白的自乳化行为研究
2.2.1 共架体蛋白自乳化的形成 油水两相发生自乳化行为所必须的两个条件为:1)具有较低的表面张力;2)乳化剂在界面形成结构韧性高且流动性强的界面膜。 当同时具备这两个条件时,较低的能量输入能够引起不溶相快速乳化,形成平均粒径较小的乳液[18]。 图3 比较了在界面拉伸过程中,Du Noüy 上作用力变化。 从中可知,丁香酚与水之间的界面张力γ 高达9.0 mN/m,而共架体蛋白使γ 降低至2.8 mN/m。 此外,共架体蛋白延缓了两相之间界面崩塌的发生,表明共架体蛋白在油水界面形成弹性加高、而结构韧性较强的界面膜,为自乳化的发生提供所需的结构条件。 因此,有必要对共架蛋白与丁香酚的作用进行进一步表征。

图3 界面拉伸过程中Du Noüy 上作用力的变化Fig. 3 Variation of force during the Du Noüy stretching interface
2.2.2 共架体蛋白与丁香酚的相互作用 通过蛋白质构象变化前后数据对比,ITC 能够测定蛋白质-配基间热力学变化[19]。 共架体与丁香酚反应过程中热量变化如图4 所示,通过对此程热量变化相对配体-配基摩尔比作图,并采用Independent 模型拟合得出配体-配基反应的热力学参数。 共架体蛋白与丁香酚的结合过程中,ΔG<0,ΔS<0,表明反应为自发放热过程,同时ΔS>ΔH,表明此过程为熵驱动[14]。通过对此反应过程进一步分析,发现首滴丁香酚(2 μL)与共架蛋白体反应信号峰最强,表明反应过程放热量大,反应最剧烈。 当滴入第三滴丁香酚后,随着丁香酚含量的增加放热峰减弱趋势变缓,表明在滴入第三滴配体后蛋白质-丁香酚之间反应达到饱和。 以上结果表明,共架蛋白能够与丁香酚产生剧烈的作用,这是共架蛋白能够自发乳化丁香酚的重要因素。

图4 丁香酚滴定共架蛋白质放热过程Fig. 4 Exothermic process of eugenol titration coprotein
2.3 乳液特性分析
2.3.1 乳液成分分析 从表1 可得,随着丁香酚添加量的增加丁香酚的装载效率下降,质量分数0.1%共架体蛋白溶液形成的乳液对丁香酚的最大装载量达28.52 μL/L,该值远高于丁香酚在水中的溶解量(3.3 μL/L)。乳液中蛋白质利用率高达76%以上,共架体蛋白质对丁香酚的结合量最高可达0.34 mL/g,表明共架体蛋白与丁香酚的自乳化方法高效、可行。

表1 蛋白质利用率、丁香酚装载效率及蛋白质与丁香酚的结合量Table 1 Utilization of CPS and efficiency of encapsulating eugenol and the binding capacities between CPS and eugenol
2.3.2 改变丁香酚含量对乳液特性的影响 由图5可得(图中样品A~G 为共架体蛋白与丁香酚质量体积比(g∶mL)分别以 1∶0.5、1∶1、1∶3、1∶5、1∶10、1∶20 以及1∶30 比例自乳化所得乳液,下同),不丁香酚形成的乳液平均粒径均<200 nm,且PDI<0.5,表明共架体蛋白与丁香酚在自乳化过程中形成了纳米级、均匀分布的纳米乳,进一步证明共架体蛋白通过降低油水界面间的表面张力使乳液液滴间间的乳化层增加,形成稳定的乳液。 其中在样品C 中,即当共架体蛋白质与丁香酚比例为1 g∶3 mL 时,平均粒径最小(102.5 nm),且 PDI 最低(0.278),表明当共架体蛋白与丁香酚以1 g∶3 mL 比例进行乳化时形成的乳液最稳定,粒子形态分布最为均匀。 由zeta-电位表征图可知,该乳液体系的Zeta-电位<-30 mV,与徐兴凤等[3]酶法改性大米谷蛋白中的稳定性较好的乳液电荷特性结果一致,由此可知乳液液滴间通过静电排斥作用保持稳定[20]。以上实验表明,共架体蛋白质与丁香酚发生分子相互作用,并在油水界面形成具有一定韧性、结构强度的界面膜,使得丁香酚与水的界面张力大大下降,在低速搅拌的过程中能够降低油滴粒径并形成纳米级乳液。
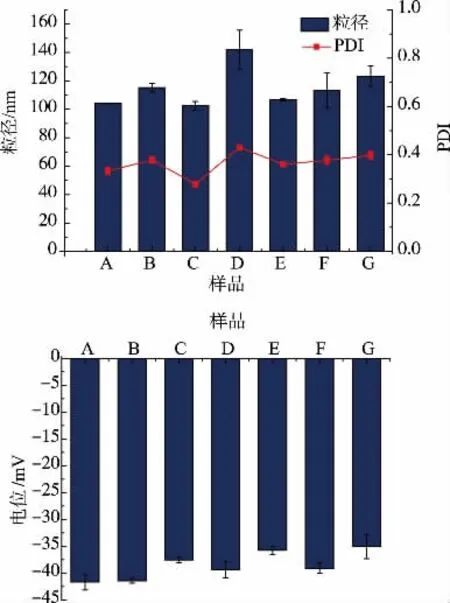
图5 丁香酚平均粒径、PDI 以及Zeta-电位的影响Fig. 5 Effects of eugenol content on average particle size、PDI and Zeta-potential
2.3.3 乳液的贮藏稳定性 由于丁香酚自身对细菌、霉菌以及真菌具有良好的抑制作用[21],本研究中将自乳化乳液置于25℃条件下储藏并对其粒径变化进行表征。 由图6 可知,7 种乳液在贮藏28 d 后平均粒径均<300 nm,在贮藏28 d 后平均粒径变化范围在100 nm 内。 以样品C 为例,研究其贮藏1、14、28 d 天粒径体积分布变化(图 6)。 结果表明,乳液粒径主要分布于10~100 nm 之间,随着贮藏时间的增长粒径分布曲线向右移,乳液中粒径>100 nm左右的粒子增多,但乳液液滴间仍保持着稳定的相互作用,未见絮凝现象发生。当贮藏到28 d 时,乳液中出现少量粒径大于1 μm 的聚集体。 在贮藏过程中由于丁香酚会从乳液中析出,导致平均粒径出现略有降低的现象[13]。 由图7 对比贮藏28 d Zeta-电位变化可知,贮藏期间Zeta-电位强度值均大于25 mV,进一步说明乳滴之间通过静电相互作用维持体系稳定,使乳液具有良好的贮藏稳定性。 贮藏过程中乳液中丁香酚的析出减少了乳滴上的带电荷,致使Zeta-电位强度值略有降低,但未从本质上破坏纳米乳的稳定状态。

图6 25 ℃贮藏28 d 乳液储藏平均粒径和粒径体积分布变化Fig.6 Variation of the average particle size and distribution of Storing emulsion during 25 ℃storage 28 days

图 7 25 ℃贮藏28 d 乳液电位变化Fig.7 Variation of emulsion potential during 25 ℃storage 28 days
2.4 乳液中丁香酚的控释研究
生育酚、芹菜素等生物活性小分子在人体消化过程中,由于其难溶性且稳定性差等缺陷而难以被机体有效利用[22]。为探究共架体蛋白-丁香酚形成的乳液是否具有缓释作用,作者对丁香酚体外释放行为进行表征。图8 为丁香酚的释放曲线,采用Liu 等[23]的研究模型式(2)对其释放过程进行描述。

式中:Q 为丁香酚在时间t 上的释放率,%;k 为释放速率常数
以丁香酚水溶液为对照,发现其在120 min 时丁香酚释放量接近100%。 与之不同的是,在同等条件下乳液中的丁香酚释放量均低于50%。 同时,从一级释放动力学对数拟合曲线图可知,随着时间延长乳液对丁香酚的释放速率变缓,释放速率常数k随着丁香酚含量的增大而增大,表明丁香酚改变了共架体蛋白结构,并产生微孔结构。 因而,我们可以根据这个现象进行乳化层结构的可控设计,并建立具有不同结构强度乳化层的控释体系,并利用其不同的释效果进行油溶性生物活性物质的递送与释放研究。

图8 乳液中丁香酚释放动力曲线和一级释放动力学拟合曲线Fig. 8 Release kinetics of eugenol from emulsions and the fitting data according to the first order release kinetics
3 结 语
通过大米蛋白和酪蛋白间疏水作用制备了溶解度高于90%的纳米级共架体蛋白。 鉴于大米蛋白良好的疏水特性,共架体蛋白能够与丁香酚进行疏水结合,极大地降低油-水界面间的表面张力,从而自发形成纳米级乳液,其粒径小于200 nm。 贮藏28 d后纳米乳未发生明显的颗粒聚集现象,说明其具有良好的贮藏特性。 乳液控释研究结果表明,丁香酚的释放符合一级释放动力学模型且纳米乳对丁香酚具有良好控释作用。
