HBx基因对HepG2.2.15细胞MICA-A5.1表达及侵袭、迁移的影响
2020-04-23李沛,刘宇
李 沛, 刘 宇
南华大学附属第一医院 a.检验科; b.急诊科, 湖南 衡阳 421001
肝癌是世界范围内发病率第三位的恶性肿瘤疾病[1],发病率髙,预后差,病情进展快,易侵袭转移,生存期短。据报道[2-3],在全球每年新增肝癌病例中,约一半发生在我国,已成为威胁我国人群健康安全的主要原因。研究[4]表明,HBV感染是引发肝癌的重要因素,HBV携带者罹患肝癌的风险极大提高,HBx蛋白作为HBV基因编码的7个蛋白之一,可调节相关癌基因、抑癌基因表达,从而诱导肝癌发生[5],HBx蛋白可通过下调miR-200a-3p表达而调控HBV感染患者肝癌细胞活力和细胞周期,进而促进其增殖及侵袭转移[6]。主要组织相容性复合体(MHC)Ⅰ类链相关基因A(MHC classⅠ chain-related gene A,MICA)是人类MHC基因Ⅰ类亚区的一种基因亚型[7],MICA-A5.1是其第5外显子的等位基因,可转录翻译产生可溶性MICA(soluble MICA,sMICA)分子,其与肝癌发生相关,sMICA水平高的肝硬化患者发生肝癌的风险最高[8],有研究[9]表明,sMICA可促使人骨肉瘤的侵袭及免疫逃逸,抑制其表达,可恢复抗肿瘤免疫,并抑制肿瘤进展,但HBx基因对HepG2.2.15细胞MICA-A5.1表达及侵袭、迁移的影响目前尚不清楚,本研究通过体外培养HepG2.2.15细胞系实验对此进行探讨。
1 材料与方法
1.1 试剂与材料 人肝癌细胞HepG2.2.15(宁波明舟生物科技有限公司,货号:MZ-1350);HBx过表达质粒、HBx空载质粒、HBx siRNA、HBx siRNA阴性对照由上海吉玛基因有限公司构建合成;MEM培养基(武汉纯度生物科技有限公司,货号:CD-100044GM);胎牛血清FBS、胰蛋白酶、青链霉素(美国Gibco公司,货号分别为:10099-141、15050057、10378016);sMICA 酶联免疫吸附法试剂盒(上海联硕宝为生物科技有限公司,货号:AE90082Hu);兔源GAPDH、HBx、E-cadherin、MICA及Vimentin一抗、羊抗兔二抗(美国Abcam公司,货号分别为:ab181602、ab39716、ab76319、ab62540、ab193555、ab150077);伊红染色液、蛋白裂解液、CKK-8试剂盒、BCA试剂盒(上海碧云天公司,货号分别为:C0109、P0013K、C0037、P0011)。
1.2 主要仪器 Olympus CKX41显微镜(德国Leica公司);Centrifuge 5424R低温高速离心机(德国 Eppendorf 股份公司);Model 680酶标仪、1659001蛋白电泳仪、Trans-Blot SD转膜仪、CFX96 Touch Deep Well荧光定量PCR仪(美国Bio-Rad公司);凝胶成像仪(日本尼康公司)。
1.3 伦理学审查 本研究方案经由南华大学附属第一医院伦理委员会审批通过(批号:LL201700008)。
1.4 方法
1.4.1 细胞培养及分组处理 将购买的人肝癌细胞HepG2.2.15快速解冻复苏,以完全培养基(含10%胎牛血清、100 U/ml青链霉素的MEM培养基)重悬,接种于25 cm2培养瓶中,并置于37 ℃、5%CO2、95%湿度的恒温培养箱中培养,待细胞长至85%左右时,以胰蛋白酶消化后传代培养。
传代培养的细胞接种于24孔板中,随机分为对照组、HBx过表达质粒组、HBx空载质粒组、HBx siRNA组、HBx siRNA阴性对照组,置于恒温培养箱中培养24 h后,参照LipofectamineTM2000的说明书步骤,将转染质粒及siRNA(质粒及siRNA浓度参照各自说明书)分别以50 μl Opti-MEM 减血清培养基溶解混匀,同时以50 μl Opti-MEM减血清培养基溶解混匀1 μl LipofectamineTM2000,均静置20 min,将 LipofectamineTM2000溶液分别与质粒及siRNA溶液合并后轻轻混匀,然后按组别分别处理细胞,以Opti-MEM减血清培养基培养细胞6 h后,将其更换为完全培养基继续培养。
1.4.2 CKK-8实验 取传代培养的HepG2.2.15细胞以0.6×105个的细胞密度接种于96孔板中,按照1.4.1中的方法分组处理,分别在12 h、24 h、48 h后加入CKK-8试剂,继续培养2 h,于全自动酶标仪中振荡混匀后检测450 nm波长下各孔吸光度(optical density,OD),计算各组细胞活力,实验重复3次。公式为:细胞活力(%)=实验组 OD 值/对照组 OD 值 ×100%。
1.4.3 Transwell侵袭实验 取传代培养的HepG2.2.15细胞接种于24孔板中,按照1.4.1中的方法分组处理,于12 h后收集各组细胞,加入无血清的MEM培养基分别重悬后计数,将细胞液浓度调整为5×105个/ml,取200 μl加入基质胶包被过的Transwell上室,在其下室加入含有10%FBS的完全培养基,继续培养24 h后,取出小室,以PBS漂洗细胞后,加入4%多聚甲醛于室温下固定,然后以棉签轻轻擦除基质胶及上室内细胞,加入500 μl 0.5%伊红染液,于室温下染色,最后用Olympus CKX41显微镜观察穿膜细胞,并任选5个视野拍照,对其计数并记录,以此作为评判细胞侵袭能力的指标。
1.4.4 细胞划痕实验 取传代培养的HepG2.2.15细胞以5×105个/ml的密度接种于6孔板中,按照1.4.1中的方法分组处理,于12 h后以200 μl枪头在六孔板中心划一条直线(以无菌直尺作为标尺),使用PBS将划痕中的细胞漂洗干净,然后加入完全培养基继续培养24 h,在Olympus CKX41显微镜下观察迁移细胞数目,任选5个视野拍照,对其计数并记录,以此作为评判细胞迁移能力的指标。
1.4.5 免疫印迹实验 取传代培养的HepG2.2.15细胞接种于24孔板中,按照1.4.1中的方法分组处理,于12 h后收集各组细胞,以蛋白裂解液及BCA试剂盒提取各组细胞总蛋白并测定其浓度,具体操作步骤参照说明书,制备SDS凝胶,各组取含相同质量蛋白的样品液进行电泳,然后湿转将分离蛋白转移至硝酸纤维膜上,以5%的脱脂奶粉室温封闭1 h后,分别经兔源HBx、E-cadherin、Vimentin、MICA、GAPDH一抗4 ℃孵育过夜,羊抗兔二抗室温孵育2 h后,最后以增强型化学发光法显色,使用凝胶成像仪观察结果并拍照,以Image Lab软件对条带进行分析。
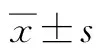
2 结果
2.1 HBx基因对细胞活力的影响 与对照组比较,HBx过表达质粒组细胞活力在24 h、48 h均升高,差异均有统计学意义(q值分别为8.268、12.680,P值均<0.001);HBx siRNA组细胞活力在24 h、48 h均降低,差异均有统计学意义(q值分别为4.365、7.523,P值分别为0.036、<0.001);为保证侵袭迁移实验的准确性,避免HBx基因对细胞活力的影响,故选择药物作用时间为12 h(表1)。

表1 HBx基因对细胞活力的影响(%)
注:1)与对照组比较,P<0.05。
2.2 各组细胞HBx、MICA-A5.1蛋白表达及细胞培养基中sMICA水平的检测 与对照组比较,HBx过表达质粒组细胞HBx及MICA蛋白表达水平、细胞培养基中sMICA水平升高,差异均有统计学意义(q值分别为9.427、6.697、5.042,P值分别为<0.001、0.001、0.006);HBx siRNA组细胞HBx及MICA蛋白表达水平、细胞培养基中sMICA水平降低,差异均有统计学意义(q值分别为8.133、8.828、7.673,P值均<0.001)(图1,表2)。

注:A,对照组;B,HBx空载质粒组;C,HBx过表达质粒组;D,HBx siRNA阴性对照组;E,HBx siRNA组。

表2 各组细胞HBx、MICA-A5.1蛋白相对表达水平及细胞培养基中sMICA水平
注:1)与对照组比较,P<0.05。
2.3 HBx基因对细胞迁移的影响 与对照组比较,HBx过表达质粒组迁移的细胞数目升高,差异有统计学意义(q=22.740,P<0.001);HBx siRNA组迁移的细胞数目降低,差异有统计学意义(q=5.391,P=0.007)(图2,表3)。




注:a,对照组;b,HBx空载质粒组;c,HBx过表达质粒组;d,HBx siRNA阴性对照组;e,HBxsiRNA组。
图2HBx基因对细胞迁移的影响

表3 HBx基因对细胞迁移的影响
注:1)与对照组比较,P<0.05。
2.4 HBx基因对细胞侵袭的影响 与对照组比较,HBx过表达质粒组侵出Transwell小室的细胞数目升高,差异有统计学意义(q=15.720,P<0.001);HBx siRNA组侵出Transwell小室的细胞数目降低,差异有统计学意义(q=7.694,P<0.001)(图3,表4)。
2.5 HBx基因对细胞上皮间质转化(EMT)标志蛋白E-cadherin、Vimentin的影响 与对照组比较,HBx过表达质粒组细胞E-cadherin表达降低,Vimentin表达升高,差异均有统计学意义(q值分别为5.258、10.500,P值分别为0.008、<0.001);HBx siRNA组细胞E-cadherin表达升高,Vimentin表达降低,差异均有统计学意义(q值分别为6.226、7.616,P值分别为0.002、<0.001)(图4,表5)。
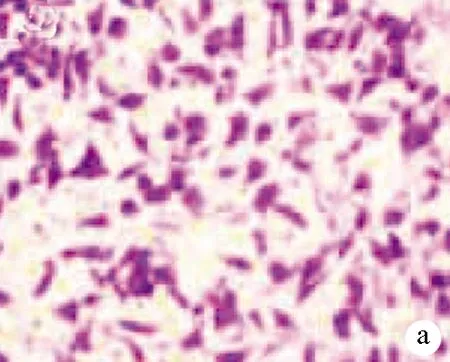

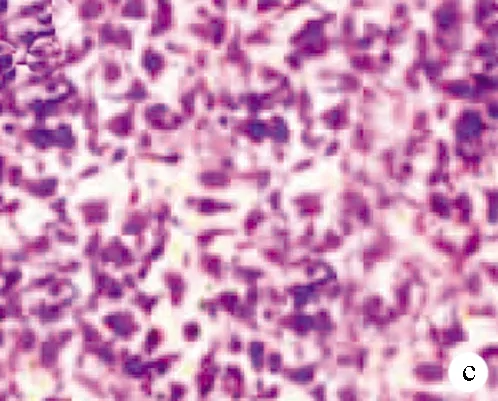


注:a,对照组;b,HBx空载质粒组;c,HBx过表达质粒组;d,HBx siRNA阴性对照组;e,HBxsiRNA组。
图3HBx基因对细胞侵袭的影响
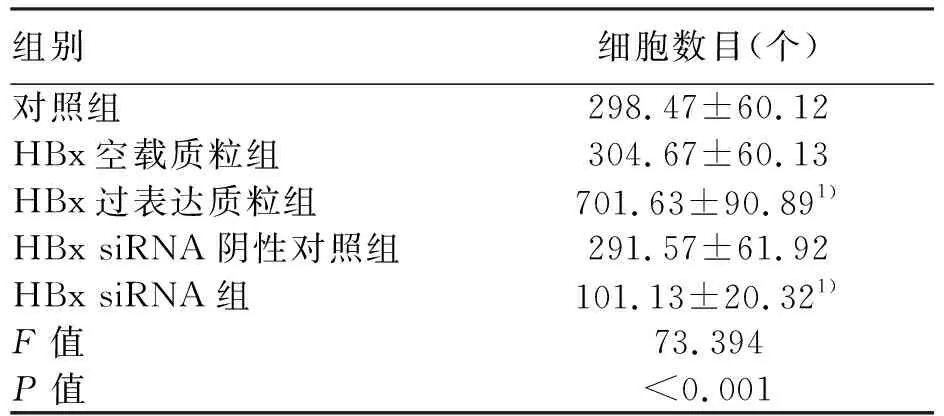
表4 各组侵出Transwell小室的细胞数目比较
注:1)与对照组比较,P<0.05。

注:A,对照组;B,HBx空载质粒组;C,HBx过表达质粒组;D,HBx siRNA阴性对照组;E,HBx siRNA组。
图4EMT标志蛋白E-cadherin、Vimentin的免疫印迹检测结果

表5 各组细胞EMT标志蛋白E-cadherin、Vimentin的相对表达水平
注:1)与对照组比较,P<0.05。
3 讨论
肝癌的治疗以手术后放化疗为主,但因早期肿瘤的转移及术后复发,其治疗效果不能令人满意,提高对肝癌发生及侵袭转移分子机制的理解对于肝癌的临床治疗具有重要意义。肝癌的发生机制复杂,是病毒感染、饮食习惯、遗传等多因素长期相互作用的综合结果[10-12],其中,HBV感染是肝癌的主要致病因素[13],合并HBV感染的肝癌患者病情进展快、生存期极短[14]。研究[15]发现,肝癌细胞Huh-7感染HBV后,HBV基因编码的HBx蛋白在Huh-7细胞中表达,且其迁移侵袭能力增强,IFNα可通过促进其表达抗病毒蛋白而减少细胞迁移及侵袭,进而减轻HBV相关性肝癌的发生发展。因而,HBx基因可能调控HBV感染的HepG2细胞HepG2.2.15的侵袭、迁移。本研究以插入HBV全基因组并持续表达的HepG2细胞系HepG2.2.15作为研究对象,探讨HBx基因对HepG2.2.15细胞侵袭、迁移的影响,以CKK-8检测HBx基因对HepG2.2.15细胞活力的影响,结果显示,过表达HBx基因可提升细胞活力,下调HBx基因可降低细胞活力,在HBx siRNA处理HepG2.2.15细胞24 h后其细胞活力约为59.36%,为保证侵袭迁移实验的准确性,避免HBx siRNA对细胞活力的影响,故本研究选择药物作用时间为12 h进行后续实验。研究结果表明,EMT是癌细胞发生转移,向机体别处侵袭的关键病理过程[16],期间细胞极性逐渐消失,上皮细胞表型逐渐转化为具有较高迁移与侵袭能力的间质细胞表型,同时上皮细胞标志蛋白E-cadherin表达降低,间质细胞标志蛋白Vimentin表达升高[17]。本研究以HBx过表达质粒上调HBx基因可使细胞Vimentin蛋白表达、迁移细胞数目、侵出Transwell小室的细胞数目升高,E-cadherin表达降低;以HBx siRNA下调HBx基因可使细胞Vimentin蛋白表达、迁移细胞数目、侵出Transwell小室的细胞数目降低,E-cadherin表达升高,表明HBx基因可介导HepG2.2.15细胞的侵袭转移,抑制其表达,能够降低HBV感染的HepG2.2.15细胞侵袭转移能力,进一步证实了HBV基因能够促进肝癌细胞迁移侵袭及癌症进展。
MICA基因含有6个外显子,MICA-A5.1作为其第5外显子等位基因,可使蛋白质翻译提前结束,从而相比其他外显子更易形成sMICA分子,当其被肿瘤、病毒或细菌等刺激时,可表达上调,产生更多的sMICA分子。研究[18-19]发现,MICA基因型及sMICA水平与慢性丙型肝炎相关肝细胞癌的发生显著相关,降低sMICA水平对治疗索拉非尼耐药的肝细胞癌有效。此外,sMICA水平在胰腺癌组织中的表达水平异常且与肿瘤的侵袭转移有关,可作为判断胰腺癌预后的重要生物标志物[20],因此,MICA-A5.1基因是调控HepG2.2.15细胞侵袭转移的潜在作用靶点,但HBV基因是否可调控其表达,进而影响HepG2.2.15细胞侵袭的转移,目前还未见研究。本研究对此进行了探讨,结果显示,上调HBx基因可升高HepG2.2.15细胞HBx、MICA蛋白表达水平及细胞培养基中sMICA水平,促使HBV感染的HepG2.2.15细胞侵袭转移;下调HBx基因可降低细胞HBx、MICA蛋白表达水平及细胞培养基中sMICA水平,抑制HepG2.2.15细胞侵袭转移,表明HBx基因可上调HepG2.2.15细胞中MICA-A5.1基因表达,进而促进其侵袭转移,揭示了HBx基因促进HBV感染的HepG2.2.15细胞的侵袭迁移的作用机制可能是下调MICA-A5.1基因。
总之,HBx基因可调控HBV感染的HepG2.2.15细胞中MICA-A5.1基因表达,介导细胞侵袭转移,上调该基因可促进HepG2.2.15细胞表达MICA-A5.1基因,进而增强其侵袭转移能力,表明调控MICA-A5.1基因表达可能是HBx基因介导HBV感染的HepG2.2.15细胞侵袭转移的分子机制之一。但本研究只是进行了初步研究,未通过上调及下调MICA-A5.1基因进行对照验证,也未涉及HBx调控MICA基因的具体分子机制,需要后续进一步深入研究。
