快速角膜胶原交联术治疗圆锥角膜的安全及有效性研究△
2020-04-22李彩红赵宏贾博马时光郭慧娟
李彩红 赵宏 贾博 马时光 郭慧娟
圆锥角膜是一种以角膜扩张为特征的进行性角膜病变,致使角膜基质层变薄,中央部向前突出呈圆锥形并产生高度不规则散光。角膜胶原纤维在决定角膜形态和生物力学方面起着重要作用。圆锥角膜患者中胶原纤维的弹性较正常人群下降36%,伴随纤维层间的错位及滑动,黏合力下降[1]。角膜胶原交联技术(corneal collagen crosslinking,CXL)是应用核黄素在紫外光A作用下,诱导相邻的胶原纤维发生化学交联反应,形成新的共价连接键,增加角膜基质的机械强度和抵抗角膜扩张的能力,从而阻止圆锥角膜形成的病理进程。
2003年,Wollensak等[2]最早发表的研究结果显示,所有进展期圆锥角膜患者经过CXL治疗后保持稳定,此方案被称为标准Dresden方案。但Dresden方案耗时较长,特别对于低龄患者难以配合。为了更好地提高患者依从性,减少并发症,以Bunsen-Roscoe法则为理论基础的快速角膜胶原交联术(accelerated corneal collagen crosslinking,A-CXL)应运而生[3]。诸多研究均认为,A-CXL与Dresden提出的标准角膜胶原交联术(standard corneal collagen crosslinking,S-CXL)具有相同的有效性[4-6]。然而近来有研究对A-CXL提出了不同观点,与简单的无机反应不同,CXL过程中的生化反应更复杂,超过一定的能量水平,CXL的光化学反应会完全改变,产生于暗室摄影学领域的Bunsen-Roscoe法则不一定适合于角膜的生物环境[7]。因此,尚需要更多的临床研究来评估A-CXL的安全性及有效性。本研究对我院行A-CXL治疗的37例(61眼)圆锥角膜患者进行观察分析,评估A-CXL治疗进展性圆锥角膜的疗效,现报告如下。
1 资料与方法
1.1 一般资料收集2017年4月至2018年3月于郑州市第二人民医院接受核黄素/紫外线A诱导的A-CXL治疗的圆锥角膜患者37例(61眼)纳入本研究。其中男22例(36眼),女15例(25眼);年龄12~31(19.7±2.6)岁。纳入标准:年龄<40周岁;患有原发性圆锥角膜;角膜厚度>450 μm;无眼部手术史或其他眼病;无眼部相关的全身疾病。排除标准:其他眼部活动性病变者,既往有角膜手术史、角膜瘢痕以及角膜厚度低于450 μm者。本研究所有操作和资料收集均符合赫尔辛基宣言,并经本院伦理委员会批准。所有患者及其监护人均被告知手术风险并签署知情同意书。术后随访12个月以上。
1.2 治疗方法及术后处理术前3 d滴用3 g·L-1妥布霉素滴眼液,每天4次。所有术眼采用快速角膜胶原交联系统(美国Avedro公司)接受A-CXL。术眼消毒后置开睑器,盐酸奥布卡因滴眼液滴眼,体积分数18%乙醇浸泡20 s,待角膜上皮疏松后,去除角膜中央直径9 mm区域的上皮组织,使用1 g·L-1核黄素滴眼液滴眼,每90 s滴1次,持续10 min,裂隙灯显微镜下用钴蓝光检查确定核黄素已渗透整个角膜基质层并进入前房房水中呈饱和状态。选择波长(370±5)nm的紫外线A照射4 min,辐射强度为30 mW·cm-2,总能量为7.2 J。照射过程中适时滴用人工泪液滴眼液,以维持角膜表面湿度。手术结束后,妥布霉素地塞米松滴眼液滴眼,配戴角膜接触镜直至角膜上皮愈合。术后左氧氟沙星滴眼液每天滴眼4次,2 g·L-1氟米龙滴眼液每天滴眼4次,逐周减量;玻璃酸钠滴眼液每天滴眼4次,使用1~3个月。术后1 d、1周仅行裂隙灯显微镜检查上皮愈合情况,分别于术后1个月、3个月、6个月及12个月时进行随访,记录最佳矫正视力(best corrected visual acuity,BCVA)、等效球镜度(spherical equivalent,SE);pentacam三维眼前节分析仪测量角膜前后表面形态,包括角膜前表面最大曲率(maximum keratometry,Kmax)、角膜后表面高度(posterior corneal elevation,PCE)、最薄点角膜厚度(thinnest corneal thickness,TCT);眼前段光学相干断层扫描检查观察角膜光反射信号;角膜内皮细胞密度仪测量角膜内皮细胞密度(endothelial cell density,ECD)、角膜内皮细胞面积变异系数(coefficient variation of cell size,CV)及六边形角膜内皮细胞比例(percentage of hexagonal cells,Hex)。

2 结果
2.1 视力及角膜形态术后12个月时,BCVA及SE分别由术前的(0.43±0.21)logMAR和(8.85±4.66)D提高至(0.31±0.25)logMAR和(8.35±4.78)D,差异均有显著统计学意义(均为P<0.01);Kmax及TCT分别下降(2.06±2.51)D和(8.9±10.8)μm,差异均有显著统计学意义(均为P<0.01);PCE保持稳定,与术前相比差异无统计学意义(P>0.05)。见表1。

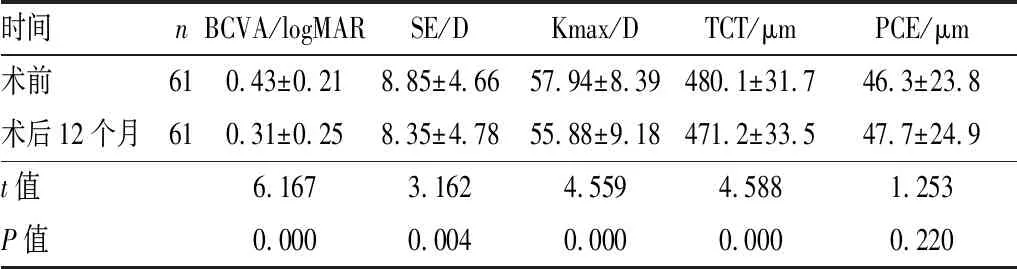
时间nBCVA/logMARSE/DKmax/DTCT/μmPCE/μm术前610.43±0.218.85±4.6657.94±8.39480.1±31.746.3±23.8术后12个月610.31±0.258.35±4.7855.88±9.18471.2±33.547.7±24.9t值6.1673.1624.5594.5881.253P值0.0000.0040.0000.0000.220
2.2 眼前段光学相干断层扫描结果39眼(63.9%)患者A-CXL术后2周开始出现角膜前中基质层信号增强,可见明显的分界线,深度为(278.2±45.6)μm,至术后1个月最为明显,3个月之后失去连续性呈片段化改变,继而逐渐消失。见图1。
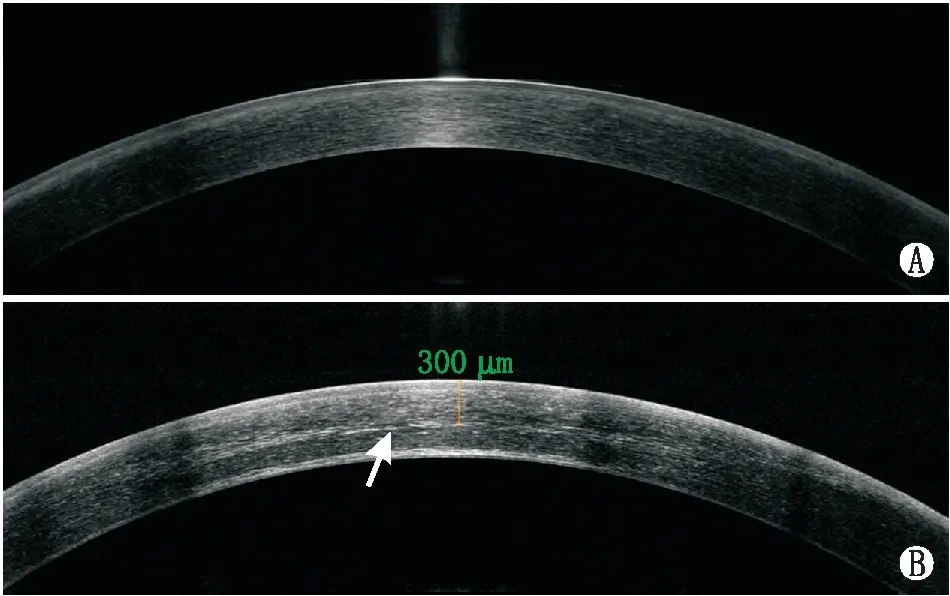
图1 A-CXL术前及术后1个月眼前段光学相干断层扫描检查结果 A:术前;B:术后1个月,箭头示角膜前中部基质内信号增加,基质间可见分界线
2.3 角膜内皮细胞检查结果术后1个月时角膜ECD和Hex分别较术前下降(97.6±138.6)个·mm-2和(7.8±14.8)%,差异均有统计学意义(t=3.726,P=0.001;t=2.782,P=0.010);二者均于术后3个月时恢复至术前水平(t=0.810、0.335,均为P>0.05)。角膜CV由术前(35.6±8.0)%增加至术后1个月的(40.6±7.1)%,差异有显著统计学意义(t=5.154,P=0.000);术后3个月时下降至(37.3±6.8)%,与术前相比差异仍有统计学意义(t=2.653,P=0.013);术后6个月时恢复至术前水平,与术前差异无统计学意义(t=0.820,P>0.05)。见表2。

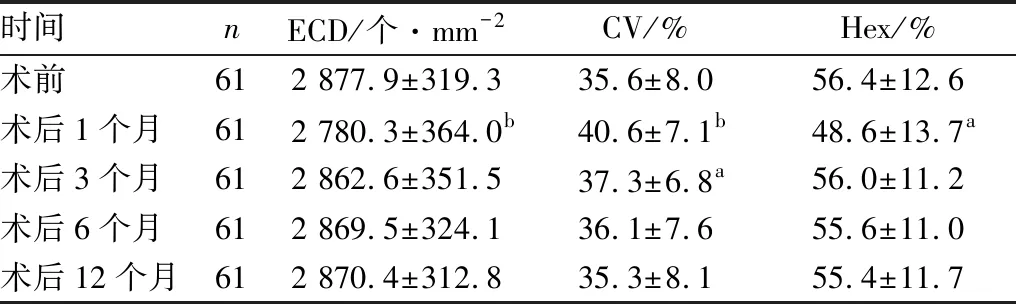
时间nECD/个·mm-2CV/%Hex/%术前612 877.9±319.335.6±8.056.4±12.6术后1个月612 780.3±364.0b40.6±7.1b48.6±13.7a术后3个月612 862.6±351.537.3±6.8a56.0±11.2术后6个月612 869.5±324.136.1±7.655.6±11.0术后12个月612 870.4±312.835.3±8.155.4±11.7
注:与术前相比,aP<0.05,bP<0.01
2.4 并发症术后1 d所有患者均有不同程度疼痛、异物感、流泪等不适,所有患者角膜上皮均在 1周内修复。3眼术后1个月出现角膜上皮下雾状混浊,于术后6个月逐渐消退。1眼术后2 d出现角膜周边无菌性浸润,经皮质类固醇滴眼液滴眼后,于术后2个月逐渐消退,遗留浅层云翳。所有患者均未见感染性角膜炎、激素性青光眼、角膜内皮失代偿等并发症。
3 讨论
圆锥角膜是一种角膜基质进行性变薄的角膜扩张性疾病。自CXL出现以来,全球很多临床研究均证实CXL可有效阻止圆锥角膜的进展,提高裸眼及BCVA,改善角膜形态,减少高阶像差[8-9]。全球圆锥角膜专家共识认为CXL是目前唯一可阻止或延缓圆锥角膜进展的方法[10]。
A-CXL以Bunsen-Roscoe法则为理论基础,即认为增加UVA辐射能量减少照射时间可以达到同样的治疗效果。诸多临床研究发现,A-CXL与S-CXL在稳定角膜形态及视力方面具有相似的效果[11]。Shajari等[12]研究认为,在视力、屈光度、角膜形态、生物力学及角膜内皮细胞方面,A-CXL与S-CXL均没有明显差异。此外,研究还认为,A-CXL更短的治疗时间可以避免角膜过度脱水,减少术中角膜变薄;另外,暴露时间短可以降低感染风险[4]。然而,也有一些文献提出了不同的观点。Chow等[13]发现,A-CXL术后12个月角膜形态没有明显改善。Hammer等[14]对猪角膜的研究显示,超过一定限度的高强度辐射及更短的治疗时间反而使角膜变硬及手术效果减弱,生物力学减小。因此,高强度辐射的A-CXL治疗效果尚存争议,需要更多的临床研究来证实。
本研究中,患者术后12个月平均BCVA与SE均得到明显改善。BCVA由术前的0.43±0.21提高至0.31±0.25,与以往研究结果相近。Badawi等[15]报道,术后12个月BCVA由术前的0.36±0.20提高至0.17±0.13。Toker等[16]的研究也显示,在30 mW·cm-2照射4 min的A-CXL治疗后BCVA提高了-0.10±0.20。SE由(8.85±4.66)D降至(8.35±4.78)D。Ng等[17]的研究也显示,术后1 a SE较术前改善了(0.98±3.81)D。但也有研究显示术后SE没有明显变化[16]。Kmax在圆锥角膜诊断、分级及监测进展方面都有重要意义,也是衡量CXL有效与否的一个重要参数。本研究中,Kmax值术后12个月平均下降2.1 D。Kmax的下降与角膜纤维板层和基质重排有关,交联后基质压缩,导致角膜曲率降低,圆锥扁平化。TCT术后12个月与术前相比减少了8.9 μm。角膜厚度变薄主要发生在两个过程:一是手术中核黄素浸泡和UVA照射过程中的角膜脱水[18];二是术后纤维层间及纤维束内部共价键连接增多,纤维间距减小引起的角膜胶原凝聚。此外,角膜细胞凋亡以及黏多糖成分的改变也可能导致角膜厚度减小。PCE的变化可以有效评估角膜膨隆的发展,本研究中,PCE术后1 a同术前相比没有明显差异,证实A-CXL可有效阻止圆锥角膜的进展。
CXL术后眼前段相干断层成像检查可见角膜基质中一条高反射线,称为“交联线”,被认为是交联基质与未交联基质的分界线,代表了CXL治疗的深度[19]。多数研究发现,A-CXL交联线较浅,Bouheraoua等[20]的研究中,S-CXL交联线深度为(302.8±74.6)μm,A-CXL(30 mW·cm-2,3 min)中为(184.2±38.9)μm。我们的研究中有39眼(64%)术后2周开始出现交联线,深度为(278.2±45.6)μm。部分术眼术后并没有出现明显的交联线,但依然有较大的角膜形态及视力改善。也有观点认为,交联线并不是评估交联有效性的合适指标。Mesen等[21]经过2 a的随访认为,交联线深度与角膜形态改变没有关系。Bouheraoua等[20]发现,交联线深度与术后视力、Kmax及角膜厚度改变等没有相关性。而Ng等[17]认为,交联线深度与Kav的改变呈明显正相关,但与Kmax无明显相关性。因此,关于交联线是否代表交联手术的有效性尚存争议,需要更多的临床研究来证实。
紫外光的照射以及氧自由基的产生能够引起角膜细胞的损伤及凋亡,内皮细胞也可能发生同样的损伤。有研究发现,A-CXL术后会出现短暂内皮细胞改变[22-23]。一项对大鼠角膜的研究发现,使用高强度UVA辐射进行CXL后出现了可逆性内皮细胞损伤及角膜细胞活性下降[24]。研究认为,只评估角膜ECD不足以全面反映角膜内皮的状态,角膜CV及Hex才是角膜内皮氧化应激下的敏感指标[22-24]。本研究结果显示,术后早期角膜ECD及Hex均较术前下降,角膜CV增加,在术后3个月及6个月时恢复至术前水平,这与以往的研究结果相近[22]。Cingu等[22]采用UVA辐射能量18 mW·cm-2照射5 min的方法进行A-CXL手术,术后1个月角膜ECD下降,角膜CV增加,角膜Hex下降,但在术后6个月时恢复至术前水平。尽管术后早期出现了角膜ECD及形态的改变,但研究中未出现角膜内皮失代偿等严重并发症,显示A-CXL仍是一种安全的治疗措施。
总之,本研究结果显示,A-CXL术后视力及角膜形态均得到明显改善,尽管术后早期出现了角膜ECD及形态的改变,但无明显严重并发症,A-CXL仍然具有良好的安全性及有效性。2015年的圆锥角膜全球共识认为,应该把CXL作为圆锥角膜的一线治疗方案[10]。而A-CXL手术时间短,患者依从性高,辐射能量丢失少,可以有效延缓或者阻止圆锥角膜的进展,给角膜扩张性疾病带来了新的希望。本研究局限性在于未观察手术前后角膜生物力学强度变化,这也是我们下一步的研究方向。
