穿透性角膜移植术后发生继发性青光眼的影响因素及治疗方法△
2020-04-22尹文惠李素霞董春晓冯莉娟刘敏王欣史伟云
尹文惠 李素霞 董春晓 冯莉娟 刘敏 王欣 史伟云
近年来,穿透性角膜移植术(penetrating keratoplasty,PKP)是治疗角膜疾病的主要术式之一,尤其针对严重的角膜溃疡、粘连性角膜白斑、角膜全层化学伤及烧伤等角膜全层受累的患者。PKP术后继发性青光眼是最常见的并发症,会造成不可逆的视力丧失,也是造成角膜植片内皮功能失代偿或诱发免疫排斥反应的一个重要原因。有文献报道,PKP术后早期继发性青光眼发病率为9%~31%,晚期发病率为18%~35%[1],总发病率为10%~53%[1-2]。这种差异来源于整个围手术期多方面的影响。PKP术后继发性青光眼的存在对患者及术者都造成了极大的困扰,所以有效地防治术后继发性青光眼是角膜移植手术成功的关键。本研究通过对PKP术后继发性青光眼患者进行回顾性分析,探讨PKP术后继发性青光眼的相关影响因素及治疗方法,以期有效预防及避免损害。
1 资料与方法
1.1 一般资料回顾性分析2016年1月至2018年11月在山东省眼科医院行PKP的573例(589眼)患者的临床资料,术后出现继发性青光眼患者共60例60眼(10.5%),其中男36例、女24例,年龄(56.23±13.19)岁。角膜移植术后早期因角膜植片水肿、前房炎症反应以及晶状体混浊等因素,无法对眼底的状态进行准确测定,因此术后早期青光眼的诊断主要依据临床表现及眼压。使用Tono-Pen眼压计(Reichert公司)测量患者眼压,每次测量均使用同一个眼压计,测量3次,以3次测量平均值作为眼压测量值,测量眼压>21 mmHg(1 kPa=7.5 mmHg)为主要诊断依据,同时建议将眼压计和手触诊眼压相结合以提高诊断精准度。大部分患者可伴有眼胀、头痛及恶心、呕吐等自觉症状;部分患者裂隙灯下可见角膜植片雾状混浊、水肿,前房浅或消失,虹膜广泛粘连等[3]。
1.2 方法
1.2.1 手术方法所有患者的PKP均由我院3位经验丰富的眼科医师操作完成。供体角膜植片直径大于受体植床0.25~0.50 mm或等大,术中用黏弹剂保护角膜内皮并形成前房,选用10-0尼龙线间断缝合,术后给予抗感染、抗排斥及促修复药物治疗,根据缝线松弛情况择期拆线。
1.2.2 术后继发性青光眼的治疗根据发病原因而采用不同的治疗方法。首选药物治疗,使用一种或多种降眼压药物联合控制眼压,如20 g·L-1盐酸卡替洛尔滴眼液,每12 h滴1次;2 g·L-1酒石酸溴莫尼定滴眼液,每天3次;布林佐胺噻吗洛尔滴眼液,每天2次,联合10 g·L-1布林佐胺滴眼液,每天3次。此外,严重感染的患者术后前3 d局部应用短效散瞳剂,如复方托吡卡胺滴眼液每5 min 1次,滴4次,或考虑球结膜下注射散瞳合剂(1 g·L-1盐酸肾上腺素注射液,肾上腺素20 g·L-1盐酸利多卡因注射液1 g·L-1硫酸阿托品注射液=111,每次注射约0.1 mL)。针对眼前房内黏弹剂过多,可临时口服醋甲唑安片或行前房穿刺放液术。合理的药物治疗后眼压仍超过21 mmHg,尽早行手术治疗。针对病因选择有效的手术方法,如虹膜粘连分离术(瞳孔成形术)、前房重建术、激光虹膜周边切除术或小梁切除术,对于个别复杂的青光眼患者可行青光眼阀植入术或者睫状体冷冻术。
1.2.3 资料收集(1)患者一般资料:每位入组患者的年龄、性别、术前眼压、角膜原发病、眼部既往史等;术后复查视力、眼压,行裂隙灯显微镜眼前节检查、眼B超以及超声生物显微镜(UBM)或眼前节光学相干断层扫描(AS-OCT)等辅助检查;(2)与青光眼相关的其他因素:移植物直径大小、手术方式、晶状体状态、虹膜情况、术后并发症、术后激素类药物使用及青光眼处理方法等。
1.2.4 分组(1)根据青光眼发生时间分为术后早期组(≤术后1个月)(n=35)与术后晚期组(>术后1个月)(n=25);(2)根据术后青光眼发生次数分为单次发作组(n=47)、多次发作组(n=13);(3)根据术前有无青光眼病史,将患者分为术前青光眼组(n=23)与术前正常组(n=37)。

2 结果
2.1 一般结果60例患者的角膜原发病分为:(1)感染相关性角膜病变50例(包括角膜植片溃疡2例):真菌感染31例,单纯疱疹病毒感染6例,细菌感染4例,棘阿米巴感染1例,病原学不明者8例;(2)非感染相关性角膜病变10例:包括角膜植片混浊5例,角膜基质炎2例,角膜肿物1例,角膜内皮功能失代偿1例,ICE综合征1例。
在60例患者中,38例术前有前房积脓;14例术前为人工晶状体眼或无晶状体眼;23例患者术前有青光眼病史;52眼采用单纯PKP治疗角膜原发病;20眼属于大直径PKP治疗(植片直径≥9 mm);植片-植床直径差值大于0.5 mm者4例。
2.2 术后继发性青光眼的相关因素分析
2.2.1 不同发病时间组患者临床资料比较术后早期组35例(58.3%,35/60),主要发生在术后5 d内,即首次眼压升高出现时间在术后1个月内,不包括一过性高眼压即术后出现眼压增高且在48 h内通过抗炎或药物降眼压治疗而缓解;引起术后早期青光眼的原因包括:前房炎症反应重及虹膜粘连19例(54.3%),浅前房5例(14.3%),瞳孔阻滞3例(8.6%),前房积血3例(8.6%),黏弹剂过多3例(8.6%),虹膜萎缩致房角压迫2例(5.7%)。术后晚期组25例(41.7%,25/60),多在术后9个月内出现;引起术后晚期青光眼的原因有糖皮质激素诱发15例(60.0%),其中5例发生于角膜植片免疫排斥反应后,外周虹膜粘连6例(24.0%),联合手术2例(8.0%),新生血管性青光眼1例(4.0%),外伤1例(4.0%)。
两组患者术前前房积脓情况和治疗方式差异均有统计学意义(χ2=6.898,P=0.009;χ2=4.000,P=0.046),患者性别、年龄及其他临床特征的组间差异无统计学意义。对患者一般资料及眼部因素进行Logistic回归分析显示,术前前房积脓是术后早期继发性青光眼发生的影响因素(OR=10.751,95%CI:1.354~85.337;P=0.025)。见表1。
表1 术后早期组和术后晚期组临床资料比较
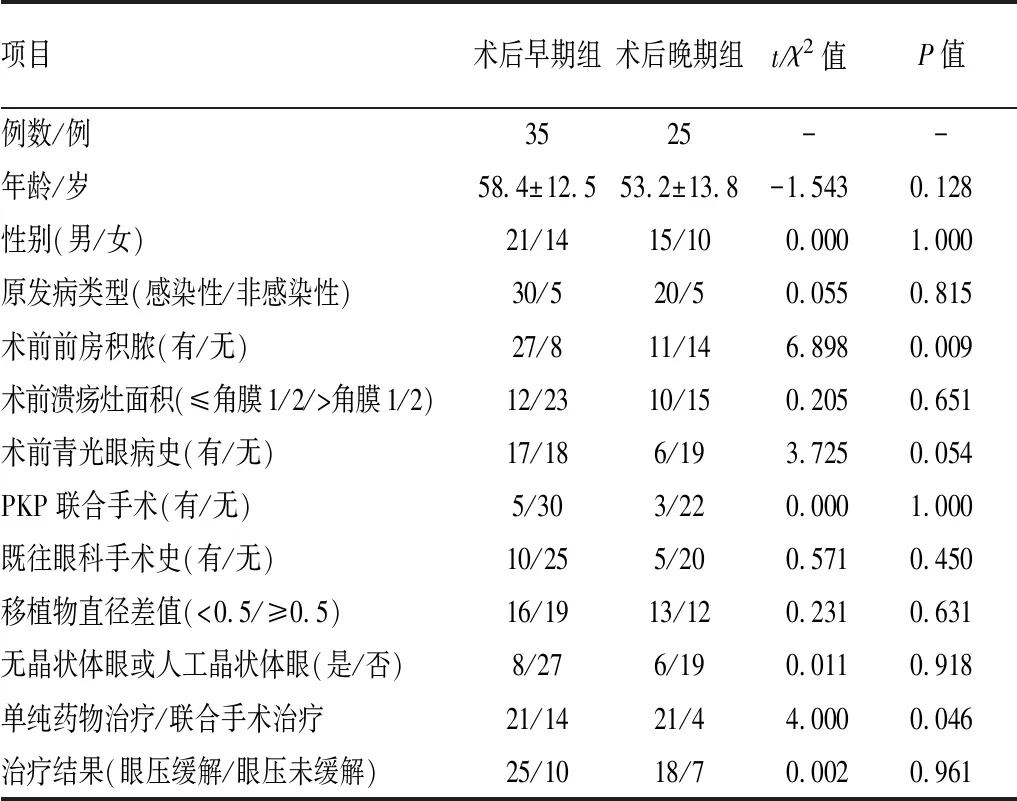
项目术后早期组术后晚期组t/χ2值P值例数/例3525--年龄/岁58.4±12.553.2±13.8-1.5430.128性别(男/女)21/1415/100.0001.000原发病类型(感染性/非感染性)30/520/50.0550.815术前前房积脓(有/无)27/811/146.8980.009术前溃疡灶面积(≤角膜1/2/>角膜1/2)12/2310/150.2050.651术前青光眼病史(有/无)17/186/193.7250.054PKP联合手术(有/无)5/303/220.0001.000既往眼科手术史(有/无)10/255/200.5710.450移植物直径差值(<0.5/≥0.5)16/1913/120.2310.631无晶状体眼或人工晶状体眼(是/否)8/276/190.0110.918单纯药物治疗/联合手术治疗21/1421/44.0000.046治疗结果(眼压缓解/眼压未缓解)25/1018/70.0020.961
进一步分析发现,术后早期组不同角膜原发病类型及病灶大小对术后眼压差异有影响(t=2.599,P=0.014;t=-2.525,P=0.017),术前青光眼病史对术后晚期组眼压差异有影响(U=89.500,P=0.036)。
2.2.2 不同发作次数组患者临床资料比较术后青光眼多次发作组13例(21.7%),即第一次青光眼发作控制后出现第二次术后青光眼发作;单次发作组47例(78.3%)。术前有青光眼病史在单次发作组和多次发作组所占百分比分别为40.5%、69.2%,差异有统计学意义(χ2=5.137,P=0.023);2组一般情况及其他临床特征比较差异无统计学意义。Logistic回归分析结果显示,术前青光眼病史OR值为8.607(95%CI:1.482~49.979,P=0.016),可认为术前存在青光眼病史是PKP术后青光眼多次发作的影响因素。见表2。
表2 术后继发性青光眼单次发作组和多次发作组临床资料比较
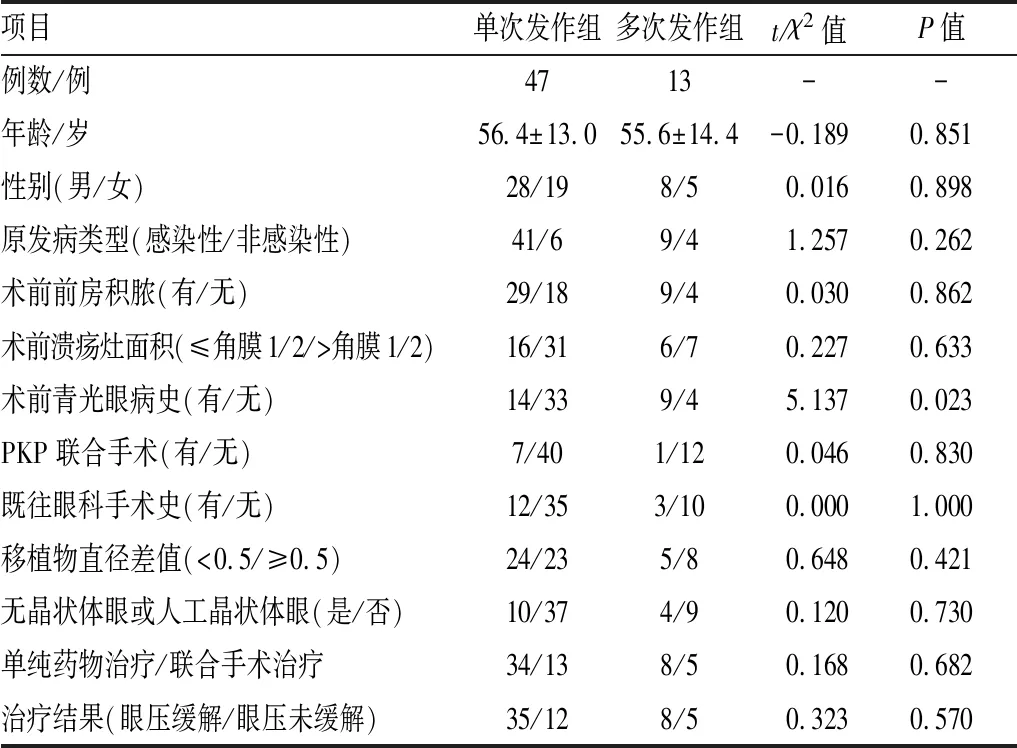
项目单次发作组多次发作组t/χ2值P值例数/例4713--年龄/岁56.4±13.055.6±14.4-0.1890.851性别(男/女)28/198/50.0160.898原发病类型(感染性/非感染性)41/69/41.2570.262术前前房积脓(有/无)29/189/40.0300.862术前溃疡灶面积(≤角膜1/2/>角膜1/2)16/316/70.2270.633术前青光眼病史(有/无)14/339/45.1370.023PKP联合手术(有/无)7/401/120.0460.830既往眼科手术史(有/无)12/353/100.0001.000移植物直径差值(<0.5/≥0.5)24/235/80.6480.421无晶状体眼或人工晶状体眼(是/否)10/374/90.1200.730单纯药物治疗/联合手术治疗34/138/50.1680.682治疗结果(眼压缓解/眼压未缓解)35/128/50.3230.570
在术后多次发作组中,第一次与第二次青光眼病程差异有统计学意义(t=-3.706,P=0.003),先后两次发作期间的眼压及用药数量比较,差异均无统计学意义(t=-1.560,P=0.147;t=-1.076,P=0.305)。
2.2.3 有无术前青光眼病史组患者临床资料比较60例患者中,术前青光眼组23例(38.3%),术前正常组37例(61.7%)。术前青光眼组和术前正常组PKP术后眼压分别为(29.85±3.59)mmHg、(26.87±2.92)mmHg,差异有统计学意义(U=190.50,P=0.001)。术前青光眼组患者术后(19.7±45.2)d开始出现眼压升高,术前正常组患者术后(75.3±99.3)d开始出现眼压升高(U=595.500,P=0.005)。2组间的治疗方式、治疗效果差异均有统计学意义(χ2=3.951,P=0.047;χ2=5.396,P=0.020)。
2.3 治疗效果及转归60例术后继发性青光眼患者随访(16.0±11.0)个月,随访结束时眼压恢复率达71.7%。术后早期青光眼患者中,药物治疗者21例,其中前房穿刺放液术联合药物治疗5例;药物联合手术治疗14例,包括小梁切除术8例,EECE联合瞳孔成形术2例,前房成形术2例,激光虹膜周边切除术1例,睫状体冷冻术1例。最终25例患者眼压得到控制。随访期间出现角膜植片免疫排斥反应5例,多次角膜植片上皮缺损4例,角膜植片翘起1例,1例患者术后因葡萄肿行眼球摘除术。术后晚期青光眼患者中,单纯药物治疗者21例;药物联合手术治疗4例,包括小梁切除术1例,EECE联合瞳孔成形术1例,睫状体光凝术1例,激光虹膜周边切除术1例。最终18例患者眼压得到控制。角膜植片免疫排斥反应5例,反复角膜植片上皮缺损2例。
3 讨论
青光眼是PKP术后严重并发症之一,有研究显示术后继发性青光眼的发生率高达13%~38%[3-8],可导致术后不可逆性视力丧失,诱发排斥反应甚至最终造成移植失败[3-4]。本研究对在我院接受PKP术后发生继发性青光眼的患者进行分析,旨在引起广大眼科工作者对PKP术患者的关注,避免严重术后并发症,提高手术成功率。
本研究发现,术前角膜溃疡感染越重,术后越早出现青光眼,眼压也相对较高;另外也发现,前房积脓是发生PKP术后早期继发性青光眼的危险因素。前房积脓、虹膜粘连等都可以影响房水循环引起眼压升高[9-11],高眼压和角膜溃疡相互作用又会加重病情,使移植直径增大,影响术后植片恢复和排斥反应发生率[12]。术后早期组中眼压升高的原因大多是前房炎症重或虹膜粘连,周边虹膜前粘连是渐进发展的过程,也会诱发术后晚期青光眼。长期随访结果表明,早期干预可有效维持正常眼压[13],建议术前抗炎抗感染,使病灶局限化、炎症减轻后再行相关手术治疗;术中操作轻柔,避免损伤虹膜,尽可能清除病灶、冲洗前房,减少术中及术后并发症。术后全身应用高效抗生素及激素治疗,前3 d要积极活动瞳孔防止粘连。
国外研究显示,术前有青光眼的患者与无青光眼患者相比,术后出现青光眼的相对风险增加了4倍,移植物存活率存在显著差异[8,14-17],这与本研究结果一致。本研究发现术前青光眼的患者术后高眼压出现早,多选择联合手术治疗,预后较差,在术后晚期组内,有青光眼病史者的眼压更高,青光眼容易频繁发作,可能这类患者具有青光眼特征性解剖结构或者术前使用过抗青光眼药物,在激素类药物等刺激下易出现青光眼[18]。在术后继发性青光眼第二次发作期间,减少激素用量并使用降眼压药物后,眼压基本正常,因此术前有青光眼的患者在术前积极进行降眼压治疗后再行PKP,对于非感染性患者可考虑联合青光眼手术治疗,术后及时使用降眼压药物。
本研究中患者的角膜原发病以真菌性感染为主,可能与术前前房炎症重、术后激素类药物使用不及时有关。糖皮质激素可以抗炎抗感染,局部合理使用可预防免疫排斥反应[19],但是使用不当也会带来高眼压或青光眼的风险。术后晚期青光眼患者中,激素导致继发性青光眼15例,有5例发生于免疫排斥反应治疗后。本研究认为,非真菌性感染患者术后即可局部及全身使用激素类药物,睡前给予妥布霉素地塞米松眼膏涂眼,待上皮恢复完整后,可添加激素类眼液,如10 g·L-1醋酸泼尼松龙滴眼液或0.2 g·L-1、1 g·L-1氟米龙滴眼液等;真菌性感染患者术后2周无明显复发迹象可以开始使用激素类药物,这与之前的研究略有不同[3]。随着术后时间的延长,激素的浓度、频率均应降低,最终眼液可每天使用1次,眼膏1周使用2次或停用。发生免疫排斥反应时,激素类药物局部联合全身冲击治疗1周后,也要逐渐减少使用量。若使用糖皮质激素后出现眼压增高,可临时停用或使用低浓度激素药物代替,多数患者眼压可恢复正常。因此,在患者管理中应更多关注术后随访,不仅监测激素类药物对其眼压的影响,而且要防治免疫排斥反应,针对青光眼易感人群,可定期电话监督就诊情况。
国外有研究表明,无晶状体眼患者行PKP后因房水排出障碍及房水代偿性分泌增多增加继发性青光眼发生率[13,15],但是植片-植床直径大小差值及缝合方式、联合手术对继发性青光眼的影响存在争议[15,20]。Karesh等[21]研究显示,角膜移植物大小与术后青光眼无显著相关性,也有研究认为,不同尺寸的移植物对房水循环结构可产生不同影响[14,16,22],张文佳等[9]认为,进行PKP联合其他手术后,青光眼发病率可达50%。本研究未发现无晶状体眼、移植物相对过大、缝合方式以及联合手术与术后发生继发性青光眼的相关性。未来仍需要关注以上因素对术后继发性青光眼的影响,可能与改变前房结构、促进炎症因子释放有关。这也提示在术前合理选择移植物大小、个体化实施手术对预防术后青光眼有重要影响。
术后早期组治疗方式为药物联合手术者相对较多,因术后早期青光眼诱因以前房炎症重、虹膜粘连为主。若药物治疗欠佳,可考虑前房冲洗或前房成形术,多数瞳孔阻滞的患者行激光虹膜周边切除术治疗后眼压可得到良好控制,它对预防急性闭角型青光眼有确切的临床疗效,并发症也较少;小梁切除术可考虑用于难治性继发性青光眼,这两种手术方式适用范围较为广泛。青光眼引流装置(GDD)可以有效控制难治性PKP术后青光眼的眼压,如球结膜瘢痕广泛或眼前段组织炎症明显者[23]。睫状体冷凝术可用于其他抗青光眼手术无效或滤过手术难以建立有效通道的患者,而且手术操作简单、方便,并发症较少[24]。本研究结果显示,单纯药物治疗和联合手术治疗后眼压控制效果无明显差异,因此在青光眼治疗过程中分析原因,及时采取合理治疗可对青光眼的预后和转归产生积极作用。
综上所述,本研究中术后继发性青光眼发生率为10.5%,术后早期发生率略高于晚期,与国内外其他文献报道相比明显降低。PKP术后继发性青光眼的影响因素主要是严重的感染性角膜原发病、术前青光眼病史以及激素类药物使用不规范,尤其前房积脓和青光眼病史分别是PKP术后早期继发性青光眼、术后青光眼多次发作的危险因素。对于可能出现术后继发性青光眼患者,应及时、有针对性地进行药物或联合手术防治,并严格进行术后随访,可有助于获得正常的眼压,改善患者预后。本研究尚存在不足之处,术后随访时间有限且为单中心研究,导致样本量较少,为更全面了解术后继发性青光眼的影响因素、治疗方式的差异,尚需要对此类病例资料进行多中心大样本的随访研究。
