金针菇菌根α-半乳糖苷酶在豆乳粉中的应用
2020-04-22李贞蓉常明昌徐丽婧孟俊龙
李贞蓉 ,常明昌 ,2,徐丽婧 ,2,孟俊龙 ,2
(1.山西农业大学食品科学与工程学院,山西太谷030801;2.黄土高原食用菌提质增效协同创新中心,山西太谷030801)
豆乳是将大豆经水浸泡后进行碾磨、过滤和煮制而成的一种植物蛋白饮料,其营养丰富且不含乳糖和胆固醇,利于人体消化吸收,为乳糖不耐症人群提供选择,而且还是防治高血脂、高血压和动脉粥样硬化等疾病的理想食品[1-2]。但大豆中含有1.9%的棉子糖和5.2%的水苏糖[3],这些寡糖又称胃肠胀气因子,不能被人体消化道的内源酶降解,而肠道内的产气微生物却可以利用其发酵产气,从而引起腹胀、消化不良等症状[4-5]。据报道,嗜热真菌费氏新萨托菌(Neosartorya fischeri P1)中的α-半乳糖苷酶添加于豆乳中,可以有效降解棉子糖家族寡糖,降低豆乳中的寡糖含量[6]。
金针菇(Flammulina velutipes)[7]是一种具有很高营养价值和药用价值的真菌[8-9],是世界六大主要食用菌之一[10-11],具有极高的经济价值,2016年年产量已达266.9万t[12]。随着金针菇产量的提高,产生的废弃物包括金针菇菌根也越来越多。目前,针对金针菇菌根的研究主要集中在多糖[13-14]、蛋白质[15]、膳食纤维[16-17]、核苷酸[18]的提取上,而针对金针菇菌根α-半乳糖苷酶的提取和应用还鲜有报道。此外,金针菇菌根的食品研发相对较少,不能充分利用金针菇资源和提高其附加值。
山西农业大学食品科学与工程学院食用菌实验室初步发现,金针菇子实体、菌根及发酵液中含有大量α-半乳糖苷酶,因此,本研究通过在豆乳中添加金针菇菌根粗酶液来制作金针菇菌根豆乳粉,检测其降解豆乳中寡糖生成的还原糖的量,旨在为金针菇菌根的精深加工提供一种新思路。
1 材料和方法
1.1 试验材料
金针菇新鲜子实体由山西农业大学食用菌中心提供,大豆购自山西省太谷县。
1.2 试剂
单甘酯、麦芽糊精为食品级,购自河南万邦实业有限公司;3,5-二硝基水杨酸,购自Sangon Biotech公司;4-硝基苯基-α-D-吡喃半乳糖苷,购自天津希恩思生化科技有限公司;无水碳酸钠、无水乙酸钠、冰乙酸、氢氧化钠、四水酒石酸钾钠、苯酚、无水亚硫酸钠,均为分析纯,购自天津市凯通化学试剂有限公司。
1.3 仪器与设备
LS-75HD型立式压力蒸汽灭菌器,江阴滨江医疗设备有限公司;CHB-202型金属浴,杭州博日科技有限公司;UV9100 A紫外可见分光光度计,北京莱伯泰科仪器股份有限公司;TDL5M-II型离心机,湖南凯达科学仪器有限公司;GJJ-2/40型均质机,上海诺尼轻工机械有限公司;SPRAY-2000型喷雾干燥机,上海熙扬仪器有限公司;DE-200g万能高速粉碎机,浙江红景天工贸有限公司;JA5003N型电子天平,上海精密科学仪器有限公司;DZKW-D-1型水浴锅,苏州江东精密仪器有限公司;GZX-9240MBE型电热鼓风干燥箱,上海博讯实业有限公司医疗设备厂;XP07型破壁料理机,佛山市顺德区喜莱家电器有限公司。
1.4 试验方法
1.4.1 金针菇α-半乳糖苷酶粗酶液的制备 将新鲜的金针菇子实体和新鲜的去除基部菌糠的金针菇菌根,清洗后沥干水分。将二者各分成4份,分别进行-20℃冷冻保存、室温(25℃)晾干、高温(60℃)烘干及不做处理。
将新鲜和-20℃冷冻保存处理的分别加入1倍体积的生理盐水,室温晾干和高温烘干处理的分别用高速粉碎机粉碎后,添加10倍体积的生理盐水,4℃抽提过夜,8 500 r/min离心10 min,收集上清液,用截留分子量为3 ku的透析袋将上清液用去离子水充分透析,得到α-半乳糖苷酶粗酶液。
1.4.2 α-半乳糖苷酶酶活力的测定 根据JUDIT等[19]的方法测定α-半乳糖苷酶的活性,并稍加改动:取 20 μL酶液,加入 20 μL的 pNPG(10 mmol/L)底物溶液,40℃反应 10 min,加入 160 μL的Na2CO3(500 mmol/L)溶液来终止反应,在405 nm下测定吸光值。酶活力单位定义:在适宜pH和温度下,每分钟生成1 μmol对硝基酚的酶量为一个酶活力单位。
式中,A表示α-半乳糖苷酶的酶活力(U/mL);Ax表示样品酶液的吸光值;Ao表示对应酶液的空白吸光值;K表示对硝基酚标准曲线的斜率;Co表示对硝基酚标准曲线的截距;Df表示稀释倍数;V表示反应所用酶量(mL);t表示反应时间(min)。
1.4.3 金针菇菌根中α-半乳糖苷酶的最适温度及温度稳定性的测定
1.4.3.1 最适温度的测定 酶活力测定时,改变反应温度,将反应温度分别设为 10、20、30、40、50、60、70、80、90℃,其他条件不变,测定酶活力,将酶活力最高值设为100%,计算各温度下α-半乳糖苷酶的相对活力并对温度作图。
1.4.3.2 温度稳定性的测定 酶活力测定前,将酶液分别在 4、10、20、30、40、50、60、70、80、90 ℃下保温2 h,后测定残余酶活,以未保温(4℃)的酶活力作为100%,计算各温度下的残余酶活。
1.4.4 金针菇豆乳粉制作工艺流程 大豆→筛选→清洗→晾干→磨粉→浸提→过滤→将滤液与金针菇菌根粗酶液按比例混合→加入麦芽糊精、单甘酯进行调配→杀菌→均质→喷雾干燥→得到金针菇豆乳粉。
1.4.5 金针菇豆乳粉操作工艺要点
1.4.5.1 浸提、过滤 将磨好的大豆粉与蒸馏水按1∶4的料液比混合,90℃浸提1 h,用0.1 mm纱布过滤除渣,滤液即为豆乳[20-21]。
1.4.5.2 调配 将金针菇菌根粗酶液与滤液按体积比3∶7混合,40℃下反应3 h,后加入0.010 g/mL单甘酯和0.15 g/mL麦芽糊精进行调配[1]。
1.4.5.3 杀菌 调配好的豆乳于121℃下加热杀菌15 min[22-23]。
1.4.5.4 均质 均质前要将混合液使用0.1 mm纱布进行过滤,去除混合液中的残留,防止均质过程中堵塞仪器,均质压力设为20 MPa。
1.4.5.5 喷雾干燥 将均质后的液体进行喷雾干燥,干燥条件是:进口温度180℃、出口温度60℃、物料流量16 mL/min,由此得到金针菇豆乳粉[24]。
1.4.6 不同大豆与水的料液比下金针菇豆乳粉得率的测定 在基础工艺条件下,设大豆与水的料液比分别为 1∶3、1∶4、1∶5、1∶6、1∶7(g/mL)等 5 个水平的单因素试验,计算其得率,确定大豆与水的最适料液比。
式中,M1表示喷雾干燥所得金针菇豆乳粉的质量(g);M2表示所用原料大豆粉的质量(g)。
1.4.7 还原糖的测定
1.4.7.1 葡萄糖标准曲线绘制 以葡萄糖含量为纵坐标,以不同浓度的葡萄糖在540 nm处所对应的吸光值为横坐标,绘制标准曲线(图1),得到y=25.843x-0.953 2(R2=0.999 8)。
1.4.7.2 还原糖含量的测定方法 依据MILLER[24]的方法进行还原糖含量的测定。样品为加入金针菇菌根粗酶液后的豆乳,取样品溶液1 mL,加入1 mL蒸馏水、1.5 mL水杨酸,对照组用未加入金针菇菌根粗酶液的豆乳代替样品,混合均匀,沸水浴5 min后,立即用冷水冷却到室温,每管各加入21.5 mL蒸馏水,摇匀,在540 nm处测定其吸光值,通过葡萄糖标准曲线得到的公式计算样品中的还原糖含量。
1.4.8 金针菇豆乳粉的感官评定 金针菇豆乳粉以1∶10的比例用开水冲调后,由10人(5男5女)组成的评价小组分别对产品的滋味、色泽、气味和冲调性进行感官评价,满分为100分[24-25]。金针菇豆乳粉的感官评价标准列于表1。

表1 金针菇豆乳粉产品感官评价
1.4.9 单因素试验设计 在基础工艺条件下进行单因素试验,试验设计为:金针菇菌根粗酶液与豆乳体积比分别为 1∶9、2∶8、3∶7、4∶6、5∶5,金针菇菌根粗酶液与豆乳的反应温度分别为20、30、40、50、60℃,金针菇菌根粗酶液与豆乳的反应时间分别为 1、2、3、4、5 h,单甘酯添加量分别为 0.006、0.008、0.010、0.012、0.014 g/mL,麦芽糊精添加量分别为 0.05、0.10、0.15、0.20、0.25 g/mL,喷雾干燥进口温度分别为 160、170、180、190、200 ℃。通过单因素试验筛选出各因素的最佳条件,为响应面试验提供参考依据。
1.4.10 响应面试验设计 在单因素试验结果的基础上,选取金针菇菌根粗酶液与豆乳的体积比(A)、喷雾干燥进口温度(B)、单甘酯添加量(C)以及麦芽糊精添加量(D)4个因素为自变量,以金针菇豆乳粉感官评分为响应值,通过Design-Except 8.0.6软件进行Box-Behnken响应面分析试验。试验因素及水平列于表2。

表2 响应面试验因素及水平
2 结果与分析
2.1 不同处理方式对金针菇子实体和菌根中α-半乳糖苷酶酶活力的影响
分别检测了金针菇子实体和菌根在4种不同处理方式下的α-半乳糖苷酶酶活力。由图2可知,在4种状态下,金针菇子实体和菌根中均含有α-半乳糖苷酶,且金针菇菌根中α-半乳糖苷酶酶活力远高于金针菇子实体中的酶活力。由此可知,金针菇菌根可以作为α-半乳糖苷酶的良好来源。其中,新鲜状态下α-半乳糖苷酶的酶活力最高,室温晾干的次之。此外,实际生产中最常见的干制方式高温烘干会导致酶活力大量损失,金针菇子实体约损失70%,金针菇菌根约损失40%。因此,在后续试验中,均采用常见的室温晾晒后的金针菇菌根作为α-半乳糖苷酶粗酶液的来源。
2.2 金针菇菌根α-半乳糖苷酶的最适温度和温度稳定性分析
从图3可以看出,金针菇菌根的α-半乳糖苷酶在反应温度为50℃时,酶活力最高,设为100%;反应温度为40℃时,残余酶活为60%左右;反应温度达到60℃时,有40%左右的酶活。其余反应温度下,酶活均低于30%;当反应温度为90℃时,基本丧失活性。结果表明,50℃为金针菇菌根的α-半乳糖苷酶最适反应温度。
由图4可知,该酶的热稳定性整体呈现下降趋势。将4℃温育2 h后测得的酶活力设为100%;在10℃温育2 h后,相对酶活在80%附近;20~40℃温育2 h后,相对酶活在70%左右;40℃后酶活力急剧下降,50℃温育2 h后,相对酶活仅有20%左右;当温度达到70℃以上后检测不到活性。温度稳定性结果表明,金针菇菌根的α-半乳糖苷酶的热稳定性在40℃以下温度范围内稳定性良好。
在最适反应温度50℃下,金针菇菌根中的α-半乳糖苷酶的热稳定性较低,残余酶活仅有30%左右;温度为4~40℃时,酶的热稳定性较好且反应温度为40℃时,酶活力较高,因此,后续单因素试验中选择40℃作为反应温度。
2.3 大豆与水的料液比对金针菇豆乳粉得率的影响
在豆乳粉制作过程中,大豆与水的料液比直接影响金针菇豆乳粉的得率。由图5可知,随着大豆与水的料液比不断减小,得率整体呈现下降趋势,在大豆与水的料液比为1∶3时,得率最高。1∶4的豆乳粉得率略小于1∶3的。但由于大豆与水的料液比为1∶3时,物料过于浓稠,后续操作较为困难。因此,确定大豆与水的适宜料液比为1∶4(g/mL)。
2.4 单因素试验结果
2.4.1 金针菇菌根粗酶液与豆乳的体积比对豆乳粉中α-半乳糖苷降解效果和感官评分的影响 将金针菇菌根粗酶液和豆乳分别以体积比1∶9、2∶8、3∶7、4∶6、5∶5 混合,以未加入金针菇菌根粗酶液的豆乳作为空白对照组,在40℃下放置3 h,检测其生成的还原糖含量。
从图6可以看出,当金针菇比例不断增加时,生成的还原糖含量呈现上升趋势,而感官评分呈先增高后降低,在金针菇菌根粗酶液与豆乳体积比为3∶7时,入口无金针菇腥味,金针菇与豆乳体积比刚好合适,感官评分最高。综上所述,确定金针菇菌根粗酶液与豆乳最适体积比为3∶7。
2.4.2 金针菇菌根粗酶液与豆乳的反应时间对豆乳粉中α-半乳糖苷降解效果和感官评分的影响混合金针菇菌根粗酶液和豆乳,以未加入金针菇菌根粗酶液的豆乳作为空白对照组,在40℃分别放置 1、2、3、4、5 h,检测其生成的还原糖含量。由图 7可知,随着金针菇菌根粗酶液与豆乳的反应时间不断增加,还原糖含量一直增大,反应时间为3 h时,还原糖的量达到最大,反应时间为4 h,还原糖的量不再继续增加。而随着反应时间的延长,感官评分虽有所提高,但无明显差异。因此,综合考虑,确定金针菇菌根粗酶液与豆乳的最适反应时间为3 h。
2.4.3 金针菇菌根粗酶液与豆乳的反应温度对豆乳粉中α-半乳糖苷降解效果和感官评分的影响混合金针菇菌根粗酶液和豆乳,以未加入金针菇菌根粗酶液的豆乳作为空白对照组,在20、30、40、50、60℃的反应温度分别放置3 h,检测其生成的还原糖含量。由图8可知,随着金针菇菌根粗酶液与豆乳的反应时间不断增加,还原糖含量一直增大,反应温度为40℃时,还原糖的量达到最大。温度继续提高,还原糖的生成量反而降低,可能是由于长时间高温导致部分α-半乳糖苷酶变性,温度稳定性降低所致。而随着反应时间的延长,感官评分虽有所变化,但无明显差异。因此,综合考虑,确定金针菇菌根粗酶液与豆乳的最适反应温度为40℃。
2.4.4 单甘酯添加量对金针菇豆乳粉感官评分的影响 从图9可以看出,随着单甘酯添加量的不断增大,金针菇豆乳粉的感官评分先增加后趋于稳定。在单甘酯添加量为0.010 g/mL时,感官评分最高。此时豆乳粉干燥效果较好,呈淡黄色,色泽均匀,冲调时易溶解,几乎无团块,且冲调后较稳定,无分层现象。此后随着单甘酯添加量继续增加,感官评分不再增加。综上所述,确定单甘酯最适添加量为0.010 g/mL。
2.4.5 麦芽糊精添加量对金针菇豆乳粉感官评分的影响 由图10可知,当麦芽糊精添加量为0.05~0.20 g/mL时,金针菇豆乳粉的感官评分随着麦芽糊精添加量的增加而增大。在麦芽糊精添加量为0.20 g/mL时,感官评分最高。此时豆乳粉冲调后甜度适中,豆香味明显,无金针菇的苦腥味。当麦芽糊精添加量继续增加,豆香味减弱,且有明显的糊精味。综上所述,确定麦芽糊精最适添加量为0.20g/mL。
2.4.6 喷雾干燥进口温度对金针菇豆乳粉感官评分的影响 由图11可知,随着喷雾干燥进口温度的升高,感官评分先增大后减小。当进口温度为180℃时,感官评分最高。当进口温度较低时,水分蒸发不彻底,颗粒之间出现黏结,冲调性较差,有大量团块。当进口温度过高时,豆乳粉冲调后不易润湿,溶解时间较长。因此,确定最适喷雾干燥进口温度为180℃。
2.5 响应面法试验结果
2.5.1 响应面法试验设计与结果 Box-Behnken响应面的试验方案及结果列于表4。由表4可知,金针菇豆乳粉的最佳生产条件为:金针菇菌根粗酶液与豆乳的体积比为3∶7、喷雾干燥进口温度为180℃、单甘酯添加量为0.010 g/mL、麦芽糊精添加量0.20 g/mL,感官评分为95分。
2.5.2 响应面回归模型的方差分析 利用Design-Expert 8.0.6软件对表4的数据进行回归拟合和方差分析,得到回归方程为:Y=91.00-3.75A-3.50B+1.92C+2.00D+3.00AB+0.75AC+0.50AD+4.25BC +3.25BD -6.25CD -10.29A2-8.42B2- 7.79C2-8.67D2。
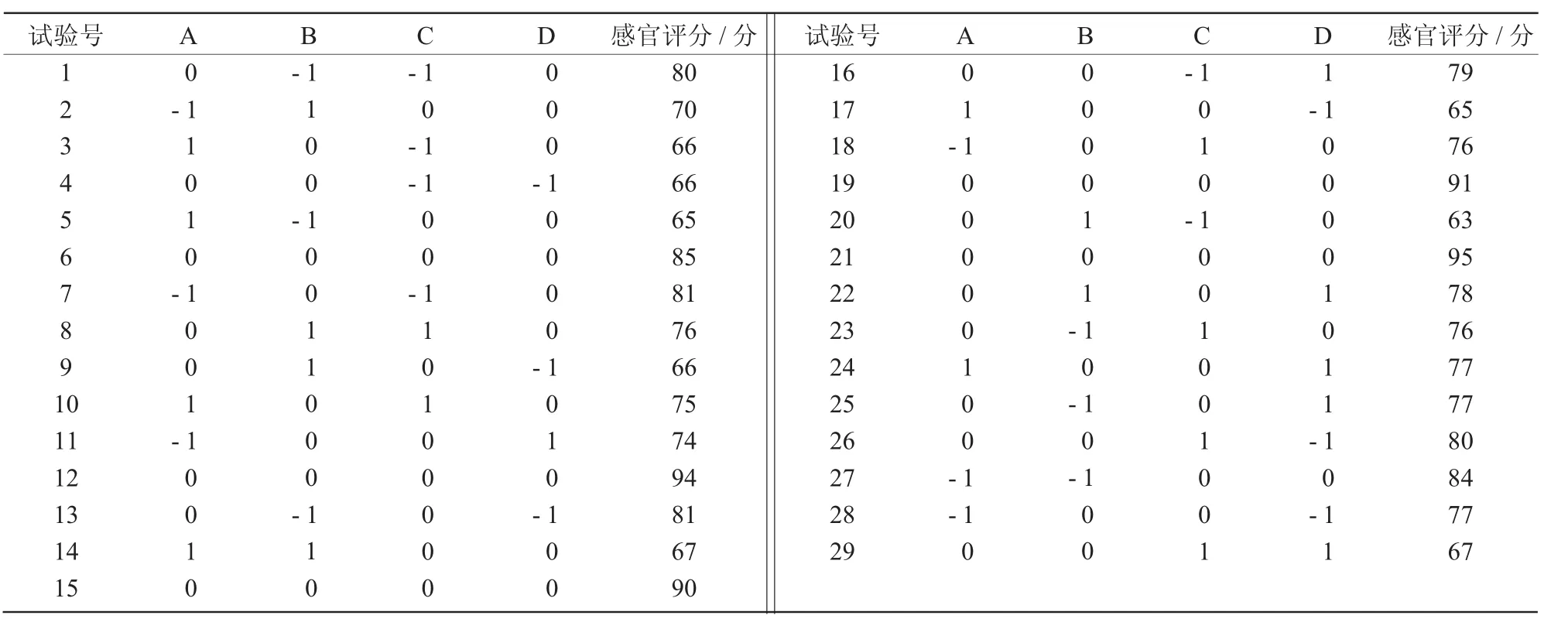
表4 响应面试验设计及结果
从表5可以看出,模型的多元相关性系数R2为0.939 9,说明金针菇豆乳粉的感官评分变化93.99%都是因为自变量。回归模型的P值小于0.000 1,差异高度显著,失拟项值为0.846 3,差异不显著,说明方程与实际情况拟合比较好,试验误差较小,该模型可靠。A、CD、A2、B2、C2、D2项差异高度显著,B项差异极显著,AB、AC、AD、BC、BD项差异显著,由F值可知,4个因素的影响顺序为A>B>D>C。图12为响应面的三维曲面图,反映了响应值与变量之间的相互关系。由图12可知,A、B、C、D这4个因素之间存在交互作用关系,且曲面越陡峭,说明2个因素之间的交互作用越显著。
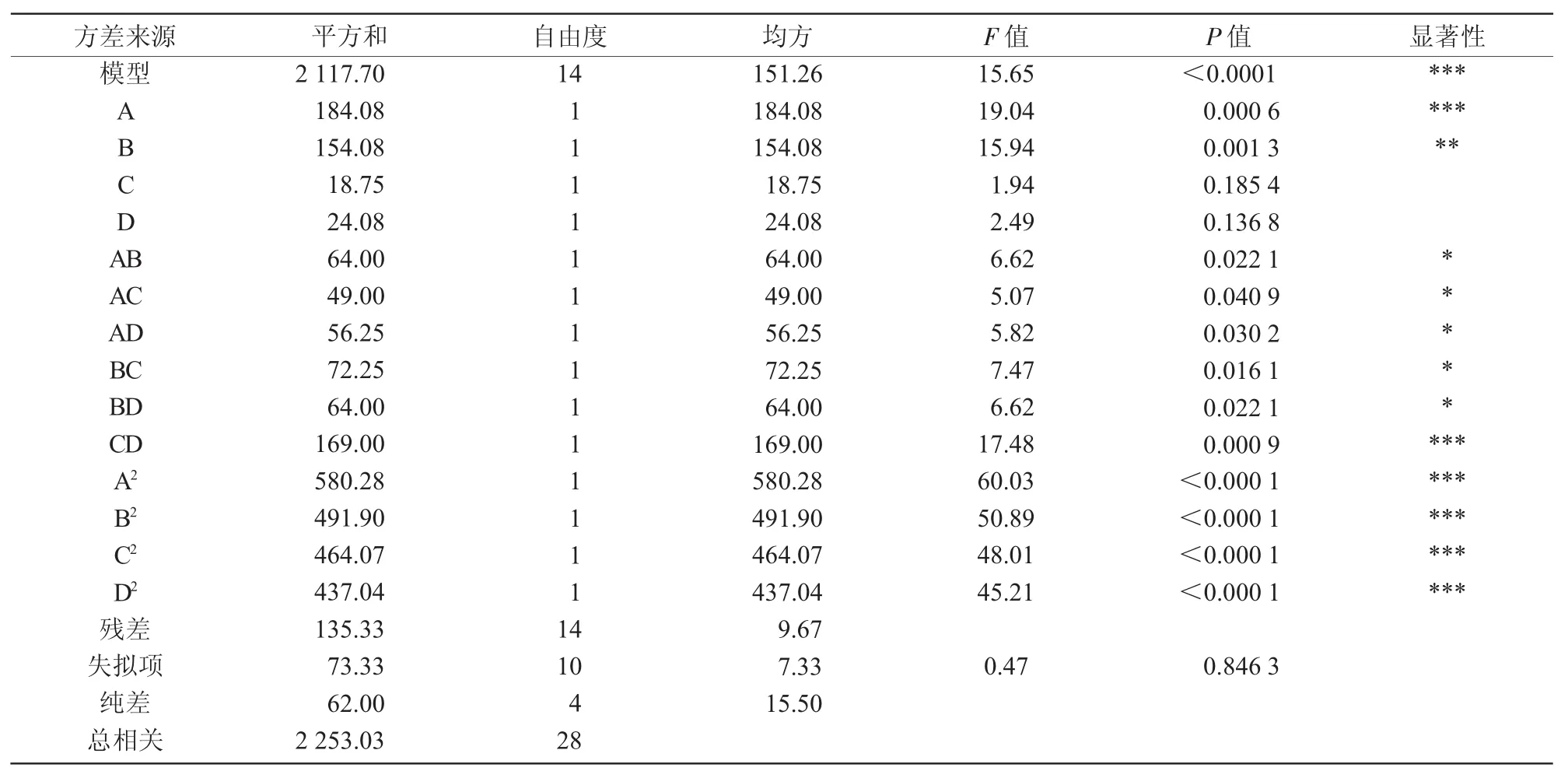
表5 回归方程方差分析
2.6 验证试验结果
响应面试验结果经Design-Expert 8.0.6软件分析优化,得到金针菇豆乳粉的最佳生产工艺为:金针菇菌根粗酶液与豆乳的体积比2.86∶7.14、喷雾干燥进口温度177.1℃、单甘酯添加量0.009 9 g/mL、麦芽糊精添加量0.197 5 g/mL。该条件下金针菇豆乳粉的感官评分预测值为92.020 6分。由于实际操作限制,最佳工艺条件修正为:金针菇菌根粗酶液与豆乳的体积比3∶7、喷雾干燥进口温度177℃、单甘酯添加量0.010 g/mL、麦芽糊精添加量0.20 g/mL。采用上述优化条件做验证试验,重复3次,得到感官评分为92分,相对标准偏差(RSD)为0.010 9,与理论数值非常接近。所以,响应面法分析得到的该 模型可靠,具有实用价值。
3 结论与讨论
本研究以金针菇菌根、大豆为主要原料,通过在豆乳中添加金针菇菌根的α-半乳糖苷酶粗酶液,采用单因素和响应面法,确定了金针菇豆乳粉的最佳生产工艺:大豆与水的料液比为1∶4(g/mL)、金针菇菌根粗酶液与豆乳的体积比为3∶7、金针菇菌根粗酶液与豆乳的反应时间为3 h、金针菇菌根粗酶液与豆乳的反应温度为40℃、单甘酯添加量为0.010 g/mL、麦芽糊精添加量为0.20 g/mL、喷雾干燥进口温度为177℃。研制出一款色泽、气味、口感均良好的金针菇豆乳粉,可为金针菇菌根的利用及精深加工提供一定理论依据。本试验是利用金针菇中α-半乳糖苷酶可以降解寡糖这一原理,将其添加到豆乳中来制作金针菇豆乳粉,但是降解寡糖的种类及作用机制并不清楚,后期可以对其进行探讨及研究。加工过程中喷雾干燥的出口温度、物料流量等并未进行优化试验,因此,后续可以对金针菇豆乳粉的喷雾干燥工艺进行优化试验。
