“新筛”干血斑在耳聋基因检测中的应用
2020-04-21覃诗琪唐美芳
高 鹏, 覃诗琪, 唐美芳
(1.武汉华大医学检验所有限公司技术中心,湖北 武汉 430074;2.中国科学院大学华大教育中心,广东 深圳 518083)
目前,干血斑除被广泛应用于各种新生儿遗传代谢病筛查(“新筛”)检测,在基于飞行质谱或测序平台的人乳头瘤病毒(human papillomavirus,HPV)、耳聋、地中海贫血等基因检测领域也有所应用。我国每年有1‰~3‰的新生儿存在听力损失,而其中约50%因遗传导致[1],新生儿耳聋基因检测对指导和干预迟发性和药物性耳聋具有重要意义[2]。目前,“新筛”在我国东部地区已实现普及,西部地区的普及率也快速提高,部分地区的“新筛”费用已被纳入各类医保体系中[3]。因此,通常需要处理大量需要同时做“新筛”和耳聋基因检测的干血斑样本,因此同一个采血卡样本会被反复打孔取样以完成不同类型的检测,极大地增加了试验人员的工作量,甚至会出现因频繁取样使样本不足而无法完成检测的现象,为疾病筛查带来诸多不便。
“新筛”需要提取血斑中的氨基酸和肉碱等胞外物质,耳聋基因检测需要提取细胞内的核酸,两者的目标检测物及其分布场所互不相同,因此本研究提出按先后顺序依次提取同一个干血斑中胞外和胞内产物,提取产物分别用于“新筛”和耳聋检测。然而,基于串联质谱的“新筛”检测通常先用甲醇提取干血斑中的代谢产物[4],而甲醇可稳固细胞结构[5],使细胞裂解的难度增大,给后续耳聋基因提取带来一定困难。因此,为避免反复取样,本研究在碱水煮沸法提取干血斑DNA的基础上进一步优化提取条件,以期实现用1个血斑先后完成“新筛”和耳聋的产物提取和检测,从而提高筛查中心的检测效率,促进自动化检测平台的搭建。
1 材料和方法
1.1 研究对象
收集2018年9—11月江县人民医院、贞丰县妇幼保健计划生育服务中心和汝州市妇幼保健院用采血卡采集的出生24~72 h内的新生儿足跟血样本28例,其中阳性样本8例,阴性样本20例。主要检测包括耳聋基因GJB2、GJB3、12S rRNA、PDS在内的20个相关基因位点。测试通过华大基因生命伦理评估,并与新生儿家属签订知情同意书。
1.2 方法
1.2.1 验证用现有方法提取“新筛”干血斑DNA的效果 现有提取方法:用打孔钳打取直径为3.20 mm的干血斑,加入100 μL无菌水洗涤血斑后去除上清,加入120 μL pH值为10的碱水,并在100 ℃条件下孵育12 min。实验组用该方法提取“新筛”干血斑中的核酸,对照组为用该方法提取同一样本的新鲜血斑的核酸,每组完成6个重复。用QubitTM dsDNA HS Asaay Kit(美国Invitrogen公司)检测提取的DNA浓度。将提取产物进行多重聚合酶链反应(polymerase chain reaction,PCR)获得1975G>C、1174A>T、1226G>A、2027T>A、235delC、IVS7-2A>G、1494C>T、281C>T、1555A>G、299_300delAT、167delT、2162C>T、176_191del16、1229C>T、538C>T、2168A>G、547G>A、IVS15+5G>A、589G>A靶序列产物,酶解去除体系中多余的脱氧核糖核苷酸,加入单核苷酸多态性(single nucleotide polymorphism,SNP)序列特异延伸引物,在SNP位点上延伸1个与突变位点互补的碱基,将产物进行阳离子交换树脂纯化和飞行质谱检测,质谱仪器为MassARRAY Analyzer 4(美国Agena Bioscience公司),比对2个组核酸提取浓度以及质谱检测情况。
1.2.2 测试碱水pH值和甲醇对“新筛”干血斑DNA提取和检测的影响 将“新筛”干血斑用120 μL pH值分别为9、10、11、12 4个梯度的碱水煮沸12 min,每个梯度重复6次。此外,每个样本补充1组提取前通过水洗去除干血斑上残留的甲醇、氨基酸和肉碱等杂质的对照,用于研究干血斑上残留的杂质对DNA提取以及最终检测结果的影响。检测所有样本的提取浓度和质谱结果。
1.2.3 测试碱水体积对“新筛”干血斑DNA提取和检测的影响 分别用60、70、80、90 μL的上述实验确定的最佳pH值的碱水提取“新筛”干血斑DNA并进行质谱检测,每个体积梯度完成4个平行测试;另用120 μL pH值为10的碱水从新鲜血斑中提取DNA并进行质谱检测,并以此为对照。综合pH值梯度测试情况确定出针对“新筛”干血斑进行DNA提取的优化方案。
1.2.4 验证优化方案对不同阳性、阴性样本的提取和检测情况 选取已知为杂合阳性、纯合阳性、弱阳性、复合阳性、疑似杂合阳性实为阴性、阴性的6种临床检测中出现过的样本,每种类型的样本各选取2例,按优化方案进行DNA提取,对照用120 μL pH值为10的碱水从新鲜血斑中提取DNA,提取产物经多重PCR和质谱检测后,分析不同类型样本DNA的质谱检测结果。
1.3 统计学方法
采用SPSS 19.0软件进行独立样本t检验分析提取浓度差异情况,用Excel 2016软件分析变量之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 用现有方法提取“新筛”干血斑DNA的结果
现有方法“新筛”干血斑和新鲜血斑核酸提取浓度的差异有统计学意义(t=3.262,P=0.022),该方法下的新鲜血斑的各位点全部被正常检出,而6例“新筛”干血斑中有4例存在未被检出的位点。见表1。
2.2 碱水pH值和甲醇等杂质对“新筛”干血斑DNA提取和检测的影响
干血斑中DNA的提取浓度随碱水pH值的增大而增大(r=0.906,P=0.094),表明碱性环境有利于细胞破裂释放核酸(表2)。所有位点与对照的检测结果完全一致,用pH值分别为9、10、11的碱水提取的产物均仅有1个位点(167delT)的信号响应偏弱,而对照有2个位点信号响应偏弱,表明“新筛”干血斑提取的产物检测效果优于新鲜血斑。此外,虽然在不洗的情况下,用pH值为12的碱水提取的DNA浓度比用pH值为11的碱水提取的DNA浓度显著提高(t=4.089,P=0.002),但用pH值为12的碱水提取的产物信号响应弱的基因位点数明显增多(表2、表3)。用pH值为12的碱水提取的产物的各位点信号响应值整体偏低(图1)。因此,用pH值为12的碱水提取的产物检测质量明显下降,而pH值为11的碱水是提取“新筛”干血斑DNA较理想的条件。
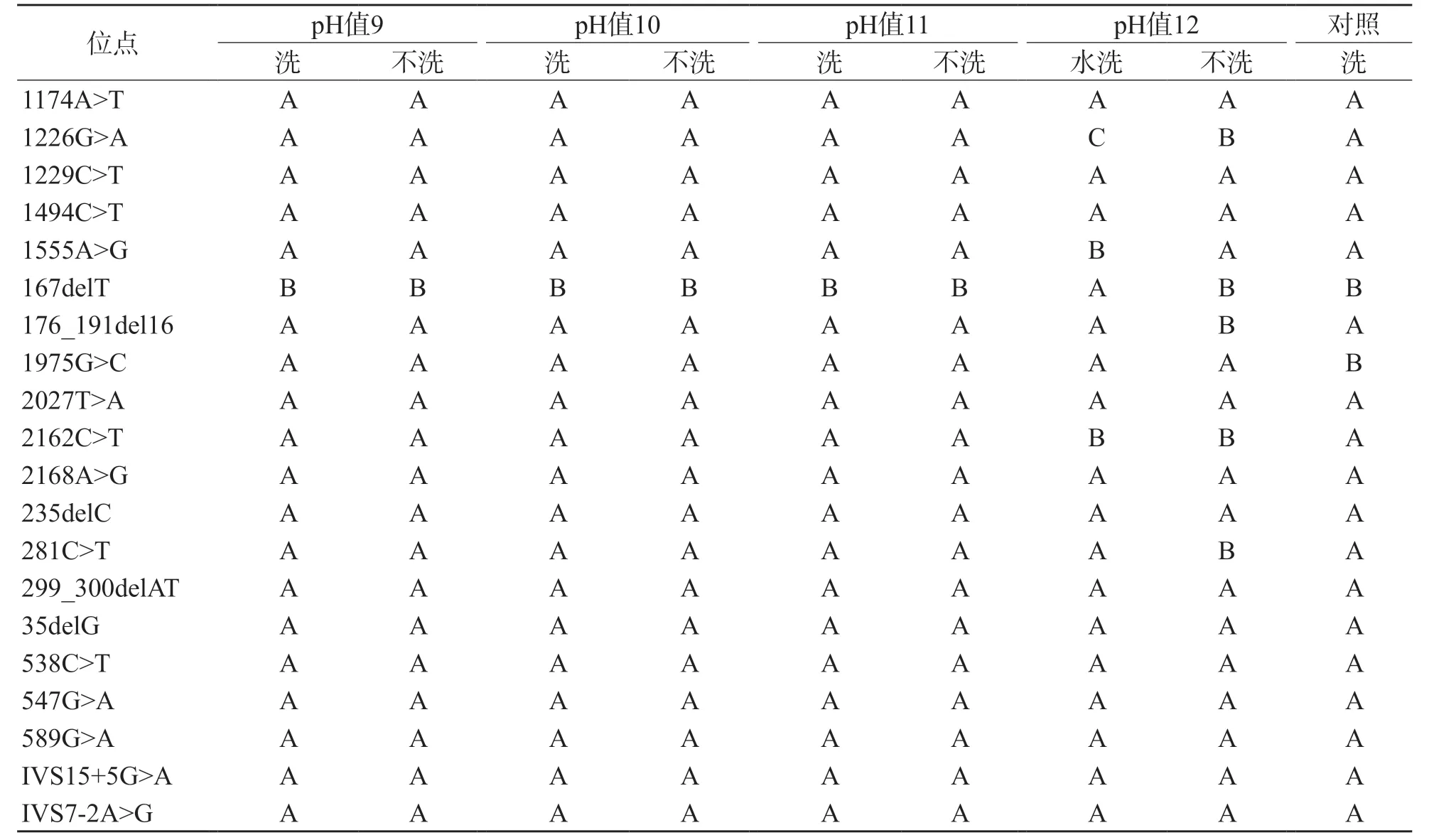
表2 用不同pH值碱水从6个“新筛”干血斑中提取的DNA位点信号强度

表3 不同pH值碱水从6个“新筛”干血斑中提取的DNA浓度
“新筛”检测后的干血斑上有甲醇、氨基酸和肉碱等残留的物质,用pH值为9、10、11的碱水提取DNA前,这些杂质会影响DNA的提取以及酶反应[6]。表3中的提取浓度显示,对“新筛”干血斑水洗除杂的6组样本和不水洗的6组样本的提取浓度之间差异均无统计学意义[pH值9(t=0.350,P=0.733),pH值10(t=0.228,P=0.824),pH值11(t=0.012,P=0.991)]。此外,图1中的质谱峰图显示,对干血斑水洗除杂和不水洗的处理中各位点质谱结果高度一致,表明“新筛”干血斑上的杂质不会显著影响DNA提取和质谱结果。
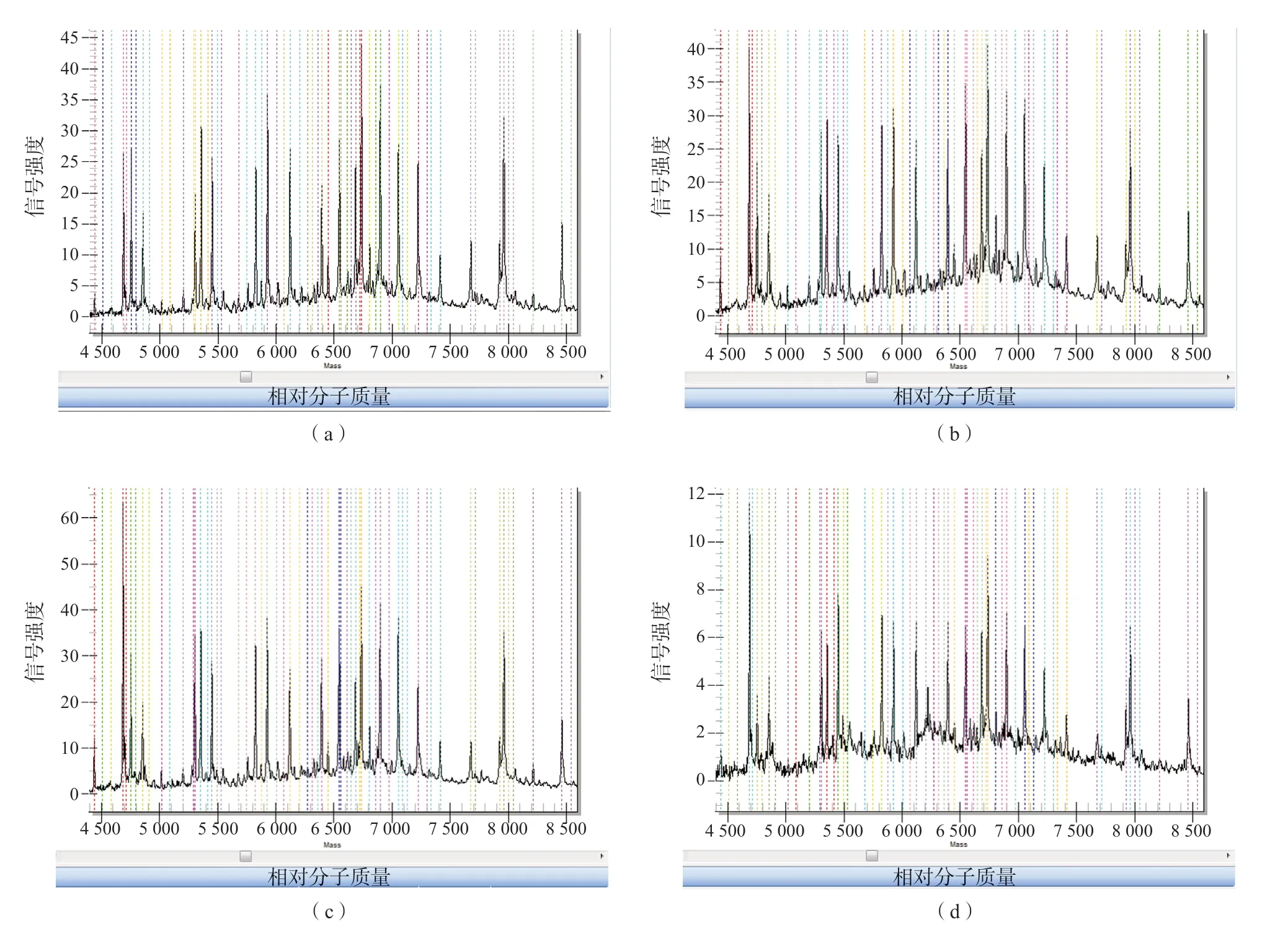
图1 不同pH值的碱水从“新筛”干血斑中提取的产物的各位点质谱信号响应结果
2.3 碱水体积对“新筛”干血斑DNA提取和检测结果的影响
当碱水体积分别为60、70、80、90 μL时,“新筛”干血斑的DNA浓度分别为(0.34±0.08)、(0.30±0.09)、(0.26±0.08)、(0.24±0.05)ng/μL,用不同碱水体积提取的DNA浓度差异有统计学意义(P<0.05)。碱水体积为80 μL时,提取的“新筛”干血斑的DNA浓度与对照[(0.25±0.08)ng/μL]比较,差异无统计学意义(P>0.05)。用60、70、80 μL碱水提取的DNA的各位点质谱结果与对照完全一致。如图2(a)所示,用90 μL碱水从样本1~4中提取的DNA产物的547G>A位点,因信号响应极弱而未被检出;图2(b)显示同一样本的新鲜血斑的547G>A位点虽然被检出,但信号响应同样较弱,表明该样本的547G>A位点本身较难被检出。对含有较难被检出的位点的样本,用体积超过90 μL的碱水从“新筛”干血斑中提取总DNA进行耳聋基因检测时,检测失败的风险增大;图2(c)为其他样本新鲜血斑的547G>A位点峰图,可见信号响应较强,此时引物峰较低,表明引物峰和产物峰的信号响应强度的比值可影响仪器的判读结果。80 μL pH值为11的碱水是提取“新筛”干血斑DNA的较理想的条件。
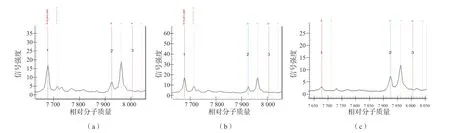
图2 547G>A位点引物峰和产物峰信号强度的关系
2.4 优化方案对不同阳性及阴性样本的提取和检测情况
优化方案下“新筛”干血斑分别为0.26和0.28 ng/μL,两者之间差异无统计学意义(t=0.617,P=0.545)。此外,表4显示,所有类型的样本的质谱结果和对照一致,其中对照中12个新鲜血斑所有位点的总未检出率为1.0%,而“新筛”干血斑为0.5%,表明优化方案从干血斑中提取的产物检测结果优于从对照中提取的产物的检测结果。

表4 优化方案下不同突变类型的2种血斑的质谱检测情况
3 讨论
水洗“新筛”干血斑可去除大部分甲醇、盐离子、氨基酸和肉碱等杂质,有利于后续的提取和扩增反应。本研究结果显示,pH值为9、10、11 时,水洗和不水洗干血斑均不影响DNA提取浓度,而pH值为12时不水洗和水洗处理的DNA提取浓度间差异有统计学意义(t=2.620,P=0.026),导致这种现象的因素有待进一步实验加以探明。此外,用pH值为12的碱水提取时,DNA浓度虽高,但样本的各位点信号响应值均较低,而在扩增时模板的体积占整个体系的20%,模板可能导致扩增体系碱性偏大,进而抑制体系中酶的反应效率[7],最终导致检测结果有偏差。
在扩增反应中,引物二聚体的形成和非特异性扩增是限制PCR敏感性的重要因素[8],引物用量大、片段长等一些特殊因素会使扩增体系出现大量引物二聚体[9],导致目标序列扩增产量降低,目前针对引物二聚体的形成因素已经产生了包括用热启动酶在内的许多尝试[10]。从图2可以看出:547G>A位点信号响应值低时,引物峰高而产物峰低;而该位点响应值高时,对应的产物峰高而引物峰低。质谱峰图信号强度与体系中对应的产物的含量呈正相关,引物峰高表明在扩增过程中产生了大量的引物二聚体。本研究发现,用60、70、80 μL碱水提取DNA时各位点信号响应正常,用90 μL碱水提取DNA时547G>A位点未被检出,而用90 μL碱水提取的DNA浓度也最低。因此,扩增模板量低可能是形成引物二聚体的一个重要因素[11],即模板DNA浓度偏低造成547G>A位点基因与引物分子碰撞结合的概率降低,引物自身结合概率相对增大并形成二聚体,二聚体进一步竞争结合酶、脱氧核糖核苷酸等,最终导致547G>A位点基因扩增产量不足。
随着我国鼓励生育政策的持续推广,以及医保体系的快速覆盖[12],新生儿数量在未来一段时期内会不断增长,而包括“新筛”在内的许多其他筛查项目也会逐步被纳入医保范围,“新筛”也将覆盖更多的地区和人群。然而,基于我国较大的人口基数,各地的筛查中心将迎来庞大的“新筛”样本量,尤其是在人口密集且医疗条件相对滞后的地区,筛查中心将面临高负荷的运营状态。因此,在保证筛查质量的同时,简化流程和引进自动化设备,从而提升筛查效率将成为未来的发展趋势。本研究用同一干血斑先后完成“新筛”和耳聋基因检测,一定程度上缩短了耳聋检测周期,同时减轻了取样环节带来的较大工作负担。此外,在完成耳聋基因检测后,从“新筛”干血斑中提取的DNA仍有大量剩余,在后期仍有用于其他类型基因检测的潜力。
