线粒体解偶联蛋白1基因缺陷小鼠淋巴细胞的频率及活性变化
2020-04-21温建强蔺志杰路国涛龚卫娟
温建强,蔺志杰,张 瑜,路国涛,龚卫娟,
(1.扬州大学医学院 免疫学教研室,江苏 扬州,225001;2.扬州大学附属医院 消化科,江苏 扬州,225001)
解偶联蛋白(UCP)是位于线粒体内膜上一类使基质内质子运输至胞液侧产热,解除二磷酸腺苷(ADP)偶联为三磷酸腺苷(ATP)的家族分子,包括UCP1~5。UCP1主要表达于棕色和米色脂肪,是机体非震颤性产热过程中维持体温的重要分子。生理状态下,UCP1的活性被腺苷类物质(如ADP)抑制,而游离脂肪酸可解除腺苷类分子的抑制而激活UCP1产热[1-2]。UCP1在人群中具有一定的基因多态性,如UCP1-3826A/G多态性与肥胖[3]、2型糖尿病[4]和部分肿瘤(如非小细胞肺癌[5]、乳腺癌[6]和肠癌[7])等具有关联性。鉴于免疫细胞的异常功能变化参与代谢性疾病和肿瘤的发病[8-9],且线粒体能量代谢直接影响淋巴细胞活性[10-11],本研究选取UCP1基因缺陷小鼠,检测生理状态下脾脏及外周血等部位T细胞、B细胞和自然杀伤细胞(NK细胞)频率及相关活化性受体的表达,为进一步评估UCP1基于线粒体代谢调节淋巴细胞的活性提供重要实验依据。
1 材料与方法
1.1 实验材料
UCP1-/-小鼠(UCP-1敲除小鼠,KO)引进自南京模式动物中心,C57BL/6小鼠(野生对照小鼠,WT)来自扬州大学比较医学中心。RPMI-1640培养基购自Invitrogen公司,胎牛血清购自杭州四季青公司。淋巴细胞的检测抗体来自于eBioscience或Biolegend公司:CD3抗体(17A2)、CD4抗体(RM4-5)、CD8抗体(53-6.7)、CD25抗体(3C7)、CD44抗体(BJ18)、CD62L抗体(MEL-14)、NKG2D抗体(A10)、干扰素-γ(IFN-γ)抗体(XMG1.2)、KLRG1抗体(14C2A07)、NK1.1抗体(PK136)、CD19抗体(1D3)、CD5抗体(53-7.3)和CD1d抗体(1B1)。布雷非德菌素A(BFA)购自Biolegend公司(终浓度5 mg/mL);淋巴细胞细胞因子刺激液(佛波酯和离子霉素)500 ×,普通细胞固定剂/破膜液,Foxp3抗体(MF-14)及转录因子固定剂、破膜液购自于eBioscience公司。
1.2 方法
1.2.1 实验小鼠及对照设置:设C57BL/6小鼠为对照组,UCP1-/-小鼠为实验组,周龄为8~20周,雄性,小鼠为同一批次购买,饲养至不同周龄。① CD3+CD4+细胞频率分析,对照组8周(4只)、20周(4只),实验组8周(4只)、20周(4只);② CD3+CD8+细胞频率分析,对照组8周(4只)、20周(4只),实验组8周(4只)、20周(4只);③ NK细胞和NKT细胞频率分析,对照组8~10周(8只)、实验组8~10周(8只);④ B细胞频率分析,对照组8~10周(6只)、实验组8~10周(6只)。
1.2.2 小鼠脾脏、胸腺和骨髓单细胞悬液的分离:为8~20周的UCP1-/-小鼠和对照C57BL/6小鼠,处死小鼠后浸泡于75%酒精,解剖分离小鼠脾脏、胸腺和胫骨骨髓。脾脏和胸腺浸入预冷无菌磷酸盐缓冲液(PBS),去除血渍和外膜,研磨小鼠脾脏或胸腺,在200目无菌滤网中过滤后移入50 mL离心管中,离心收集细胞沉淀用红细胞裂解液处理去除红细胞。胫骨骨髓则直接离心收集细胞沉淀,加入红细胞裂解液裂解红细胞。收集细胞再次离心后用冷PBS悬浮备用。
1.2.3 细胞表面标记的检测:按1.2.2方法制备脾脏单细胞悬液,用细胞计数板计数,按照每个微量离心管(EP管)1×106个细胞分管,加PBS至每管100 μL,按说明书要求剂量加入相应的淋巴细胞表面标记荧光抗体,如FITC-CD3、PE-CD4或PE-CD8等,4 ℃避光孵育30 min。加入800 μL PBS洗涤抗体,4 ℃ 1 500转/min离心10 min,弃上清,用400 μL PBS缓冲液重悬细胞,充分混匀,利用流式细胞仪(FACS Calibur)检测阳性荧光细胞的频率。
1.2.4 CD4+CD25+Foxp3+细胞的检测:收集脾脏单细胞悬液,调整细胞悬液浓度为1×106个/mL,用50 μL PBS重悬细胞,加入CD4和CD25(0.2 mg/mL)抗体,4 ℃避光孵育30 min,洗涤离心弃上清。每管加200 μL转录因子固定液(eBioscience)重悬,4 ℃避光孵育30 min,每管加入1 mL转录因子破膜液洗涤,离心弃上清。加入含Foxp3(0.2 mg/mL)抗体的转录因子破膜液200 μL,4 ℃避光孵30 min,1 mL破膜液再次洗涤,加入300 μL转录因子破膜液重新悬浮细胞,用流式细胞仪检测。
1.2.5 胞内染色法检测IFN-γ分泌:检测前5 h取培养于24孔板中的淋巴细胞,每孔加入淋巴细胞刺激剂(2 μL),1 h后加入BFA(1 μL)。4 h后,收集细胞移入EP管,4 ℃ 1 500 转/min离心5 min,弃上清。1 mL PBS重新洗涤细胞,4 ℃ 1 500转/min离心5 min,弃上清,加入50 μL PBS,以及CD4或 CD8(0.5 mg/mL)抗体,充分混匀,4 ℃避光孵育30 min,PBS洗涤,离心弃上清。每管加200 μL胞内染色固定液(eBioscience)重悬,4 ℃避光孵育30 min,每管加入1 mL普通破膜液洗涤,离心弃上清。加入IFN-γ(0.2 mg/mL)抗体,4 ℃避光孵30 min,1 mL破膜液再次洗涤后,加入300 μL破膜液重悬细胞,用流式细胞仪检测。
1.3 统计学分析
2组之间比较采取团体t检验分析,采用Graphpad 7.0软件进行统计,P<0.05为差异有统计学意义。
2 结 果
2.1 UCP1-/-小鼠CD4+T细胞频率及活性的变化
生理状态下UCP1-/-小鼠和对照C57BL/6小鼠相比,其脾脏和外周血CD3+CD4+细胞的频率无明显变化,且8周龄和20周龄的2组小鼠胸腺CD3+CD4+细胞的频率均无显著差异。脾脏经典调节性T细胞(CD4+CD25+Foxp3+,Treg)、活化型或效应性CD4+T细胞(CD4+NKG2D+、CD4+CD44+、CD4+CD44+CD62L-)的频率无显著差异。利用流式细胞术胞内染色法分析其IFN-γ的产生,发现CD4+IFN-γ+T细胞亦无显著变化。由此提示,UCP1缺陷对小鼠体内CD4+T细胞的分化、频率、活化性受体及IFN-γ的产生无明显影响。见图1。



WT:C57BL/6小鼠;KO:UCP1-/-小鼠;IFN-γ:干扰素-γ。A:WT、KO脾脏CD3+CD4+细胞频率;B:WT、KO外周血CD3+CD4+细胞频率;C1~2:WT、KO胸腺8、20周CD3+CD4+细胞频率;D:WT、KO脾脏Treg细胞频率;E、F、G:WT、KO脾脏活化型或效应性CD4+T细胞频率;H1~2:WT、KO脾脏CD4+IFN-γ+T细胞流式分析图;I:WT、KO脾脏CD4+IFN-γ+细胞频率。
图1 流式细胞术检测小鼠CD4+T细胞的频率及其活性
2.2 UCP1-/-小鼠CD8+T细胞的频率及活性的变化
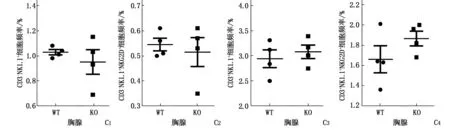
CD3+CD8+细胞频率在野生型和基因缺陷小鼠的脾脏明显下降,而外周血无明显变化;同时,8周龄和20周龄的2组小鼠胸腺CD3+CD8+细胞的频率均无显著差异。进一步分析脾脏内CD8+T细胞活化性受体表达和活性的变化,发现UCP1基因缺陷小鼠脾脏CD8+T表达NKG2D和CD44下降,且效应性CD8+T细胞:CD8+NKG2D+、CD8+CD44+、CD8+CD44+CD62L-、CD8+CD44+KLRG1+、CD8+IFN-γ+的频率显著下降,CD8+IFN-γ+T细胞的频率亦显著降低。由此提示,UCP1缺陷对CD8+T细胞在胸腺内发育无明显影响,却会下调CD8+T细胞活化及产生的能力。见图2。


A:WT、KO脾脏CD3+CD8+细胞频率;B:WT、KO外周血CD3+CD8+细胞频率;C1~2:WT、KO胸腺CD3+CD8+细胞频率;D、E、F、G:WT、KO脾脏活化型或效应性CD8+T细胞频率;H:WT、KO脾脏CD8+IFN-γ+T细胞频率。与KO比较,*P<0.05,**P<0.01。
图2 流式细胞术检测小鼠CD8+T细胞的频率及其活性
2.3 UCP1-/-小鼠NK细胞及NKT细胞频率及其NKG2D表达
对2组小鼠脾脏、外周血和胸腺中CD3-NK1.1+、CD3+NK1.1+、CD3-NK1.1+NKG2D+和CD3-NK1.1+NKG2D+细胞频率进行分析,发现3种组织中上述4种细胞的频率均无显著变化,提示UCP1缺陷对NK细胞或NKT细胞数目及NKG2D表达无影响。见图3。
2.4 UCP1-/-小鼠总B细胞及调节性B细胞频率
检测2组小鼠脾脏、外周血和骨髓内B细胞分布的情况,发现总B细胞(CD19+)的频率无显著差异,且脾脏内调节性B细胞(CD19+CD5+CD1d+,Breg)的频率亦无显著差异(P>0.05),提示UCP1缺陷对小鼠B细胞的发育和分布无明显影响。见图4。
3 讨 论
本研究全面分析了生理状态下UCP1缺陷小鼠T细胞、B细胞和NK细胞在脾脏、外周血、胸腺或骨髓内细胞的分布情况,发现尽管UCP1缺陷小鼠胸腺内CD8+T细胞的发育不受影响,但脾脏内其细胞频率下降,且活化型或记忆型CD8+T细胞的频率下降、IFN-γ的产生被抑制,提示UCP1缺陷后对CD8+T细胞的活化、增殖和效应功能的发挥可能具有重要影响。与CD8+T细胞的变化趋势不同,总CD4+T细胞、调节性CD4+T细胞、NK细胞、NKT细胞和B细胞频率均无明显变化,提示UCP1缺陷对这些淋巴细胞的发育、增殖及功能均无影响。本研究不仅说明UCP1调节的线粒体氧化磷酸化代谢可以影响CD8+T细胞生物学功能,还提示不同淋巴细胞的活性发挥对线粒体代谢的依赖度不完全一致。


A1~4:WT、KO脾脏NK细胞、NKT细胞频率及NKG2D表达;B1~4:WT、KO外周血NK细胞、NKT细胞频率及NKG2D表达;C1~4:WT、KO胸腺NK细胞、NKT细胞频率及NKG2D表达。图3 流式细胞术检测小鼠NK细胞、NKT细胞及其NKG2D的表达

A:WT、KO脾脏总B细胞频率;B:WT、KO外周血总B细胞频率;C:WT、KO骨髓总B细胞频率;D:WT、KO脾脏调节性B细胞频率。
图4 流式细胞术检测小鼠B细胞亚群的频率
UCP1缺陷的棕色脂肪组织内活性氧(ROS)增多,且线粒体内钙离子缓冲能力下降。增多的ROS不仅导致线粒体内电子传递链(ETC)活性下降,还激活棕色脂肪细胞的固有免疫应答(表现为干扰素刺激基因ISG、核酸识别受体如RIG-1、STAT1/2表达上调)[12-13]。UCP1缺陷小鼠CD8+T细胞活性下调是由于该淋巴细胞胞内线粒体代谢异常反应导致(内因),还是由于体内局部微环境其他细胞如棕色脂肪细胞或巨噬细胞活性变化引起的继发效应(外因),仍需要进一步研究。另外,尚不清楚UCP1缺陷后可否诱导该家族其他分子如UCP2~5的代偿性上调表达[14],而导致细胞功能发生变化。
在免疫应答过程中,不同活化状态的淋巴细胞采用不同的代谢方式供能。一般认为,静息状态或记忆性淋巴细胞以高效率的线粒体氧化磷酸化供能,而受抗原刺激后的活化或效应性淋巴细胞以无氧糖酵解供能为主,并同时利用葡萄糖代谢的磷酸戊糖途径产生淋巴细胞增殖分裂DNA合成所需的核糖类物质[10-11]。与效应性CD4+T细胞相比,调节性CD4+T细胞亦以线粒体氧化磷酸化供能为主[15]。免疫细胞活性与其代谢方式互为调节,免疫细胞活性改变后,将通过代谢重编程的形式进一步促进其功能发挥[16]。本研究发现的CD8+T细胞功能变化是否与其代谢方式有关,仍然需要进一步观察。
