自身免疫性肝炎的标准治疗和潜在治疗靶点
2020-04-21王绮夏
王 睿, 王绮夏, 马 雄
上海交通大学医学院附属仁济医院 消化内科, 上海市消化疾病研究所, 上海 200001
自身免疫性肝炎(AIH)是一种肝脏实质性炎症,由针对肝细胞的自身免疫反应所介导,特点为高免疫球蛋白G血症、血清自身抗体阳性、肝组织学上存在中重度界面性肝炎[1]。临床上多表现为慢性、隐匿起病,少数表现为急性发作甚至引发肝衰竭,未经治疗者可进展为肝硬化。基于1960年-1980年的临床研究结果,泼尼松(龙)联合硫唑嘌呤或泼尼松(龙)单药治疗作为AIH的标准治疗方案被提出。该方案能显著改善大多数中重度AIH患者的肝功能、延长生存期,作为AIH治疗的主要方案沿用至今。但至少有10%~15%的患者对标准治疗方案应答不佳[2],另有部分患者不能耐受药物副作用或停药复发。因此,AIH的二线治疗方案开始受到关注。本文针对目前AIH的治疗研究进行综述,并提出AIH的潜在治疗靶点供广大读者参考。
1 目前的治疗方案
AIH的总体治疗目标是获得肝组织学缓解、防止进展为肝衰竭和肝硬化、提高患者的生存期和生存质量。临床上可行的治疗目标是获得生化缓解,即血清转氨酶(ALT/AST)和IgG水平均恢复正常。治疗指征上,所有活动性AIH患者均应接受免疫抑制治疗,并可根据疾病活动度调整治疗方案及药物剂量。
1.1 一线治疗 2015年欧洲肝病学会优先推荐泼尼松(龙)联合硫唑嘌呤作为标准治疗方案,即泼尼松(龙)用于诱导缓解,硫唑嘌呤用于维持缓解。该方案可显著减少泼尼松(龙)剂量及副作用。欧洲肝病学会推荐泼尼松(龙)的初始剂量为0.5~1 mg·kg-1·d-1,治疗2周出现生化缓解后加用硫唑嘌呤,硫唑嘌呤的初始剂量为50 mg/d,可视毒性反应和应答情况渐增至1~2 mg·kg-1·d-1,同时泼尼松(龙)渐减,理想情况下泼尼松(龙)可撤药,仅硫唑嘌呤单药维持[2]。泼尼松(龙)单药治疗时,初始剂量为40~60 mg/d,4周内渐减至15~20 mg/d[3]。免疫抑制治疗应维持3年以上,或获得生化缓解后至少2年以上,方可考虑停药。近年来,英国AIH协作组开展了一项多中心、横断面研究[4],纳入1249例AIH患者(50.8%来自肝移植中心、49.2%来自非移植中心),结果表明真实世界中获得生化缓解的患者占59%。AIH患者停药后易复发,研究[5]表明,停药1、2、3年后复发率分别为59%、73%、81%。因此,大部分患者可能需要接受终生的免疫抑制治疗。既往研究[6]表明,接受泼尼松(龙)治疗的AIH患者,约30%会出现糖皮质激素相关副作用,且泼尼松(龙)剂量增至7.5~10 mg/d时更易出现副作用,因此建议尽量减少泼尼松(龙)剂量。
布地奈德作为第二代糖皮质激素,特点为糖皮质激素相关副作用显著较轻、肝脏首过清除率约90%。目前已开展了10余项关于布地奈德作为AIH一线或二线治疗方案的临床研究。结果表明,布地奈德可作为AIH的一线治疗方案,适用于需长期应用糖皮质激素维持治疗的AIH患者,但不宜用于泼尼松(龙)无应答的患者及肝硬化患者。 2019年美国肝病学会推荐将布地奈德联合硫唑嘌呤或泼尼松(龙)联合硫唑嘌呤作为非肝硬化、非急性重症AIH患者的一线治疗方案[7]。
1.2 二线治疗 对一线治疗应答欠佳或不耐受糖皮质激素副作用的AIH患者,可选择二线治疗方案,药物包括吗替麦考酚酯、他克莫司、环孢素、甲氨蝶呤、6-巯基嘌呤等。AIH接受上述药物治疗后缓解率、不良反应情况各异,近3年的相关临床研究结果详见表1[8-19]。
1.3 手术治疗 AIH患者进展至急性肝衰竭或终末期肝病时,应考虑行肝移植术。20%的AIH患者术后会再次发病[20],建议在抗排异方案的基础上加用泼尼松(龙)或硫唑嘌呤。此外,6%~10%的非AIH患者在肝移植术后出现类似AIH的血清学及组织学表现,成为新发AIH。
2 潜在治疗靶点
近年来研究揭示了免疫系统、肠-肝轴、营养物质等在AIH的发生发展中起作用。上述因素可作为潜在治疗靶点,为AIH的治疗提供新思路,内容参见表2。已开展的临床试验参见表3。
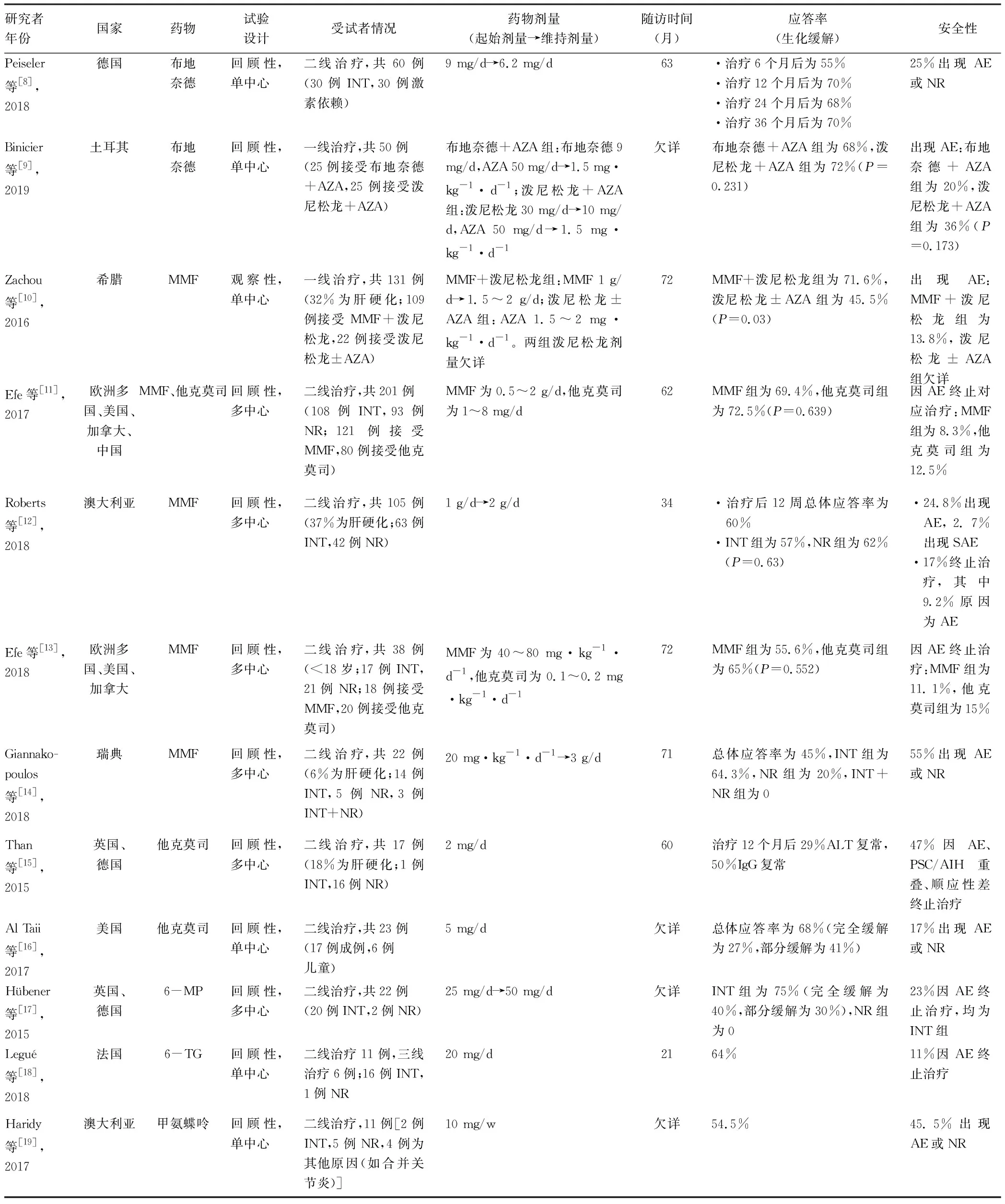
表1 近3年关于AIH治疗方案开展的临床研究
注:AZA,硫唑嘌呤;MMF,吗替麦考酚酯;6-MP,6-巯基嘌呤;6-TG,6-硫代鸟嘌呤;INT,不耐受标准疗法;NR,标准疗法无应答;AE,不良反应;SAE,严重不良反应;PSC,原发性硬化性胆管炎。
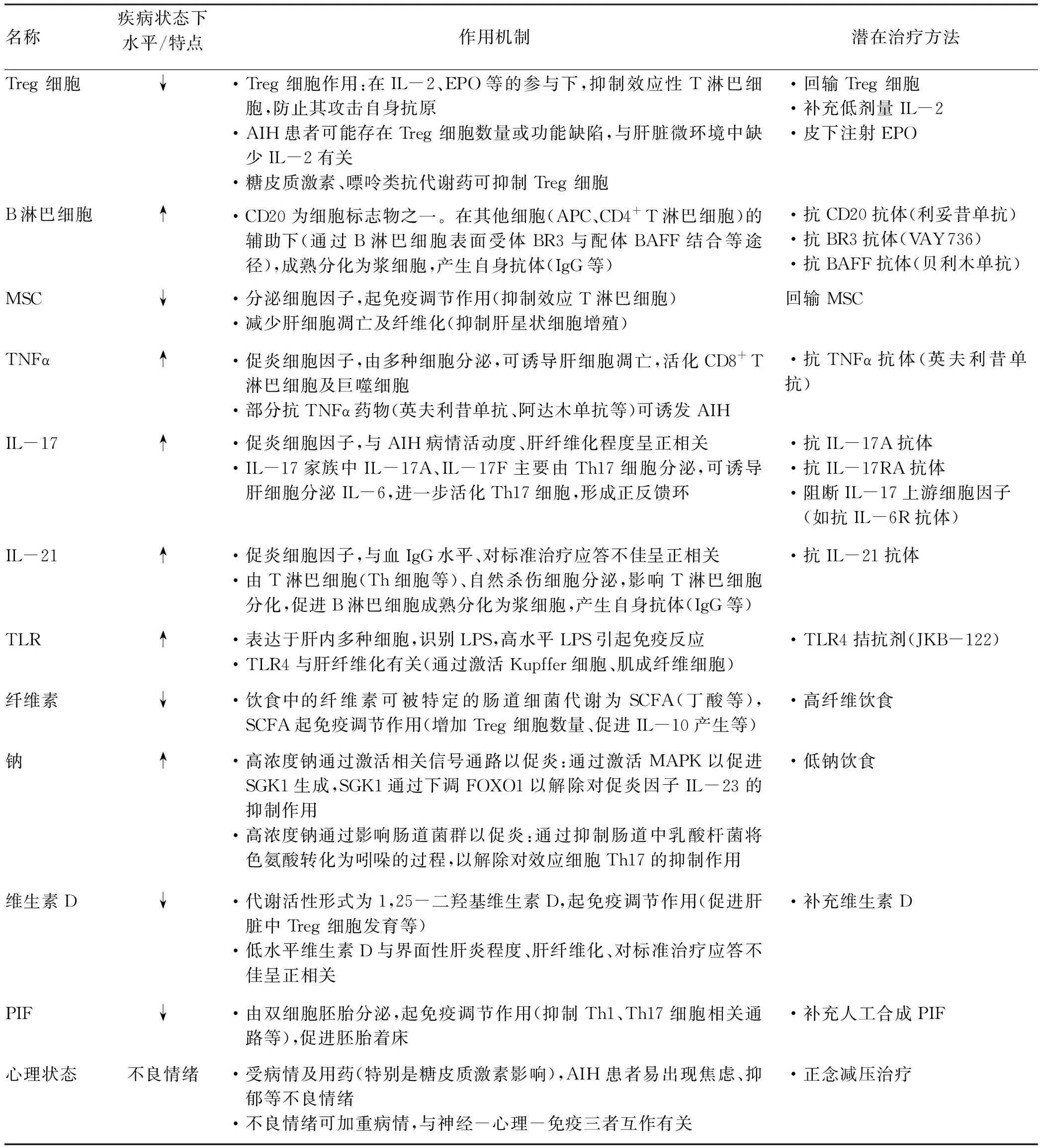
表2 AIH的(部分)发病机制及潜在治疗方法
注:EPO,红细胞生成素。
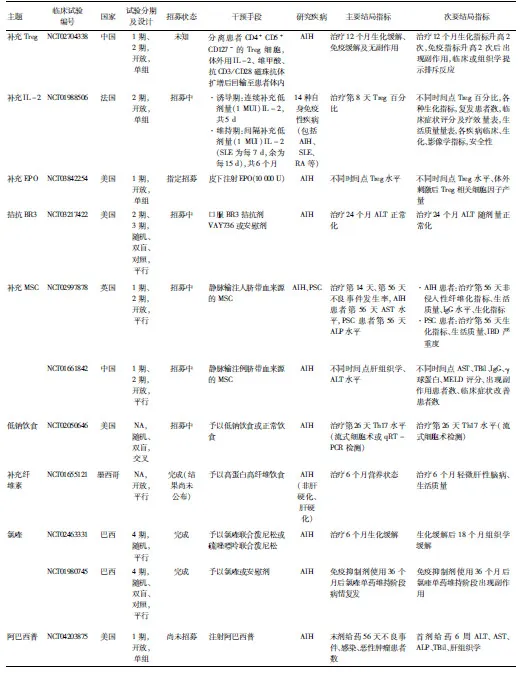
表3 AIH治疗相关的临床试验(截至2019年12月24日)
续表

主题临床试验编号国家试验分期及设计招募状态干预手段研究疾病主要结局指标 次要结局指标 血浆置换NCT02874586中国NA,开放,单组招募中血浆置换联合免疫抑制剂AIH治疗6个月生化缓解不同时间点ALT、AST、球蛋白、IgG、TBil、DBil拮抗TLR4NCT02556372美国2期,开放,单组试验进行中,但目前不招募口服TLR4拮抗剂JKB-122AIH治疗6个月ALT水平/补充PIFNCT02239562美国1期,随机、双盲、对照,平行完成予以人工合成PIF或安慰剂AIH治疗29 d药物安全性及患者耐受度治疗29 d出现抗-PIF抗体及药物相互作用患者数大麻二酚NCT04129489以色列2期,开放,单组招募中予以人工合成大麻二酚AIH治疗12个月生化及组织学缓解、出现副作用患者数、复发患者数/心理干预NCT02950077美国NA,开放,单组试验进行中,但目前不招募正念减压治疗AIH治疗12个月压力知觉量表、生活体验调查、日常烦恼问卷、简明自我控制量表治疗12个月ALT及IgG水平、泼尼松剂量调整、复发患者数、血清MIF及CD74水平
注:MIU,百万国际单位; SLE,系统性红斑狼疮;RA,类风湿性关节炎;NA,不适用;MIF,巨噬细胞移动抑制因子;/,研究未设置次要结局指标。
2.1 免疫系统相关
2.1.1 基于细胞的疗法 调节性T淋巴细胞(Treg)在抑制效应性T淋巴细胞、避免其攻击自身成分方面发挥重要作用,其活化需要IL-2、红细胞生成素等因子的参与。研究[21]表明,与健康人及病毒性肝炎患者相比,AIH患者的Treg细胞在外周血中数量减少、在肝脏中存在功能缺陷。 Chen等[22]研究提示,疾病状态下肝脏微环境中缺少IL-2,与Treg细胞功能缺陷有关。此外,糖皮质激素、嘌呤类抗代谢药(如硫唑嘌呤)也可影响Treg细胞功能[23]。Lim等[24]开展了首项低剂量补充IL-2的人体试验,持续6个月接受低剂量IL-2的2例难治性AIH患者外周血Treg细胞数量增多,其中1例患者获得生化缓解。靶向Treg细胞以治疗AIH的临床试验已陆续开展,包括低剂量补充IL-2(NCT01988506)、回输体外用IL-2等刺激的Treg细胞(NCT02704338)以及皮下注射红细胞生成素(NCT03842254)。
B淋巴细胞也参与AIH的发生发展。在抗原递呈细胞、CD4+T淋巴细胞的参与下,B淋巴细胞活化因子(B cell activation factor, BAFF)与B淋巴细胞表面的受体BR3结合,B淋巴细胞成熟、分化为浆细胞,产生IgG等自身抗体。其中,血BAFF水平与AIH的疾病活动度、糖皮质激素治疗应答不佳呈正相关[25]。利妥昔单抗通过拮抗B淋巴细胞表面的CD20以耗竭B淋巴细胞,作为难治性AIH患者的挽救治疗方案应用于临床。靶向BAFF的贝利木单抗已获得美国食品药品监督管理局(FDA)批准,用于治疗系统性红斑狼疮等自身免疫性疾病,有望应用于AIH。此外,美国开展了应用靶向BR3的单抗(ianalumab/VYA736)治疗AIH的临床试验(NCT03217422)。
间充质干细胞(mesenchymal stem cell, MSC)通过分泌TGFβ、IL-10等因子,发挥免疫调节作用[抑制CD4+T淋巴细胞分化为辅助性T淋巴细胞(Th)1及Th17细胞、抑制CD8+T淋巴细胞增殖等],还可通过抑制肝星状细胞增殖从而缓解肝纤维化。动物实验[26]表明,通过超速离心从MSC中分离得的外泌体,可通过miRNA-233途径来调控炎症小体NLRP3及caspase-1,对肝细胞起保护作用。目前已有2项关于静脉输注人脐带血来源的MSC用于治疗AIH的临床试验(NCT02997878、NCT01661842)。
除经典的免疫细胞外,组织驻留记忆T淋巴细胞[27]、髓系源性抑制细胞[28]等在AIH的发生发展中可能起一定作用,其作用机制被进一步阐明后,可作为治疗靶点。
2.1.2 基于细胞因子的疗法 TNFα属于促炎细胞因子,可活化CD8+T淋巴细胞及巨噬细胞、诱导肝细胞凋亡,与健康人相比,AIH患者的外周血及肝脏TNFα水平较高[29]。靶向TNFα的英夫利昔单抗已获批用于治疗包括类风湿性关节炎、炎症性肠病等多种自身免疫性疾病,也作为挽救手段用于治疗难治性AIH患者,但此疗法并发感染概率较高。另有研究[30]表明,此类生物制剂应用于治疗其他自身免疫性疾病患者时,可导致药物诱导AIH。
IL-17也属于促炎细胞因子。IL-17家族中的IL-17A、IL-17F主要由Th17细胞分泌,可诱导肝细胞分泌IL-6,进一步活化Th17细胞以形成正反馈环,促进其他促炎因子如TNFα的释放。与健康人相比,AIH患者的外周血及肝脏IL-17水平较高,与疾病活动度、肝纤维化呈正相关。靶向IL-17A的单抗(secukinumab、ixekizumab)、靶向IL-17RA的单抗(brodalumab)已用于治疗银屑病等炎症性疾病。靶向IL-17上游及调控Th17细胞相关的细胞因子,如抗IL-23的单抗(ustekinumab)、抗IL-1R单抗(anakinra)、抗IL-6R单抗(tocilizumab)[31]已用于治疗炎症性肠病、类风湿性关节炎等疾病,亦有望应用于AIH。
IL-21由T淋巴细胞、自然杀伤细胞分泌,影响多个T淋巴细胞亚群分化。与健康人及病毒性肝炎患者相比,AIH患者外周血及肝脏IL-21水平较高,与血清IgG水平、糖皮质激素治疗应答不佳有关[32]。动物实验[33]表明,阻断IL-21后,滤泡辅助性T淋巴细胞功能受抑制,PD1-/-小鼠不易发展为AIH。
2.1.3 抗原特异性疗法 2型AIH的特征性抗体之一为抗肝肾微粒体抗体,其靶抗原为细胞色素P4502D6(CYP2D6)。研究[34]表明,2型AIH患者体内存在携带人类白细胞抗原(human leukocyte antigen, HLA)等位基因DRB1*0701的CD4+T淋巴细胞、携带HLA-A*0201的CD8+T淋巴细胞,可识别CYP2D6的特定区域,进而释放促炎因子IFNγ,破坏细胞色素、引起肝损伤。上述过程可被Treg细胞调控。
以自身抗原作为靶点,近年来肽免疫疗法开始尝试用于治疗包括AIH的自身免疫性肝病小鼠模型。研究者[35]将含有自身抗原成分的肽段装载进覆有主要组织相容性复合体Ⅱ类分子的纳米颗粒,将纳米颗粒注入小鼠体内,可观察到效应T淋巴细胞受到抑制,机制可能为自身免疫性CD4+T淋巴细胞分化为1型Treg细胞,分泌IL-10等抑炎因子、促进B淋巴细胞分化为调节性B淋巴细胞。
以自身反应性免疫细胞作为靶点,嵌合抗原受体(chimeric antigen receptor, CAR)T淋巴细胞(CART细胞)已应用于治疗寻常型天疱疮(pemphigus vulgaris, PV)[36]。改造T淋巴细胞,使之表达含有PV自身抗原桥粒芯蛋白3(desmoglein 3, Dsg3)的嵌合自身抗体受体(chimeric autoantibody receptor, CAAR)。体外、体内实验证实,该Dsg3 CAAR T淋巴细胞可特异性杀死靶向Dsg3的自身反应性B淋巴细胞,从而缓解疾病。此外,CAR Treg细胞已被报道用于治疗移植物抗宿主病。因此,CART细胞有望用于治疗AIH。
2.1.4 借鉴其他自身免疫性疾病的疗法 氯喹通过提高溶酶体pH值使得酸性水解酶失活,进而减弱巨噬细胞作为抗原递呈细胞的功能,抑制IL-1等因子分泌及淋巴细胞活化,用于治疗风湿免疫类疾病已逾数10年。关于氯喹作为AIH维持缓解期治疗方案,Mucenic等[37]开展了纳入32例患者的首个探索性研究,提示氯喹的安全性和有效性。此后,巴西圣保罗大学总医院开展了2项四期临床试验。2016年的临床试验(NCT02463331)共纳入57例患者,比较了氯喹联合泼尼松(26例)、硫唑嘌呤联合泼尼松(31例)对于缓解AIH病情的效果,结果显示,两组的生化缓解率分别为53.8%、57.7%,组织学缓解率分别为28.6%、47.6%。2018年的临床试验(NCT0198074)[38]共纳入61例AIH患者[氯喹组(250 mg/d)组为31例、安慰剂组为30例],两组的无复发生存率分别为59.3%、19.9%(P=0.039),复发率分别为0、41.6%,提示氯喹可作为AIH维持缓解期的治疗方案。
阿巴西普是细胞毒性T淋巴细胞抗原4的同源物,通过阻断CD28与共刺激分子CD80/CD86的结合,抑制CD4+T淋巴细胞的活化[39]。已获FDA批准用于治疗类风湿性关节炎、幼年特发性关节炎及银屑病。目前,美国拟开展阿巴西普用于治疗AIH的临床试验(NCT04203875)。
血浆置换用于治疗自身免疫性疾病的机制是清除外周血中的自身抗体,曾应用于1例合并成人Still’s病、糖皮质激素应答不佳的AIH患者[40],但此病例诊断是否为AIH尚存争议[41]。目前,中国亦有研究者开展血浆置换治疗AIH的临床试验(NCT02874586)。
2.2 肠-肝轴相关 “肠-肝轴”即肠道和肝脏通过门静脉、胆道系统及全身血液循环,在解剖和功能上密切联系、相互影响。随着高通量测序技术的发展,慢性肝病状态下菌群特别是肠道菌群的特征得以阐明。肠道菌群失衡参与了AIH的发生发展,机制可能为肠屏障破坏后肠道菌群异位到肝脏,引起肝脏炎症性反应。既往的人体菌群测序结果[42]表明,与健康人相比,AIH患者粪便中双歧杆菌、乳酸杆菌丰度较低,唾液中链球菌丰度较低、韦永氏球菌丰度较高。值得关注的是,本课题组[43]对91例AIH患者、98例健康人进行粪菌测序,结果显示:与健康人相比,AIH患者的菌群多样性较低,4个菌属(韦永氏球菌、链球菌、乳酸杆菌、克雷伯菌)的丰度较高,其中韦永氏球菌的差异最显著(P=8.85×108),与血清AST水平、疾病活动度呈正相关。此外,AIH特异的肠道菌群特征可用于预测疾病状态,即同时应用韦永氏球菌属、乳酸菌属、颤螺旋菌属和梭菌目所属菌属构建模型时的区分效能最佳(AUC=0.78)。
Toll样受体4(TLR4)表达于肝内多种细胞(如巨噬细胞),可识别脂多糖(lipopolysaccharide, LPS)等细菌成分。TLR4与配体结合后,激活促炎因子相关通路,参与AIH的发生。此外,多种慢性肝病中TLR4还可通过激活肌成纤维细胞,促进肝纤维化[44]。美国已开展口服TLR4拮抗剂(JKB-122)治疗AIH的临床试验(NCT02556372)。亦可考虑应用益生菌、抗生素及肠道内递送抑炎细胞因子,以恢复肠稳态、缓解AIH病情[45]。
2.3 营养物质相关 钠在高浓度下有促炎作用。一方面,高浓度钠通过激活丝裂原活化蛋白激酶以促进血清和糖皮质激素调节激酶1(serum/glucocorticoid-regulated kinase 1, SGK1)生成,SGK1通过下调FOXO1以解除对促炎因子IL-23的抑制作用;另一方面,高浓度钠通过抑制肠道中乳酸杆菌将色氨酸转化为吲哚的过程,以解除对效应细胞Th17的抑制作用[46]。美国开展了低钠饮食的临床试验(NCT02050646),以期通过饮食缓解AIH病情。
维生素D的代谢活性形式为1,25-二羟基维生素D,可增加钙质吸收、促进肝脏中Treg细胞发育。研究[48]表明,低水平维生素D与界面性肝炎程度、肝纤维化、对标准治疗应答不佳呈正相关。加之糖皮质激素相关副作用之一为骨质疏松,应重视向AIH患者补充维生素D。
2.4 其他 受疾病及用药(特别是糖皮质激素)的影响,AIH患者生活质量较低,易出现焦虑、抑郁。研究[49]指出,心理-神经-免疫三者存在相互作用,提示减轻心理压力可缓解炎症。目前,美国已开展正念减压以治疗AIH的临床研究(NCT02950077)。
预植入因子(pre-implantation factor, PIF)由双细胞胚胎分泌,具有控制炎症、促进胚胎着床的作用。动物实验[50]表明,PIF可通过抑制Th1/Th17通路,有效缓解青少年糖尿病、自身免疫性脑脊髓膜炎小鼠的病情。美国开展了补充人工合成PIF以治疗AIH的临床试验(NCT02239562),共纳入36例患者,采用单次给药剂量渐升法及多次给药剂量渐升法,给予各组别以不同剂量人工合成PIF(0.1、0.5、1 mg/kg)及安慰剂,观察不良反应出现情况。结果表明,胃肠道不适、一过性皮肤瘙痒、头疼等非特异不良反应仅出现于单次给药剂量渐升法0.1 mg/kg组,其余组皆无不良反应,提示PIF用于治疗AIH具有安全性。
大麻二酚(cannabidiol, CBD)是一类从大麻类植物中提取的纯天然成分,具有抗炎及免疫调节的作用,已获批用于多发性硬化的治疗。研究[51]表明,CBD可通过激活香草酸受体TRPV1活化髓系源性抑制细胞,起免疫调节作用。以色列开展了CBD用于治疗AIH的临床试验(NCT04129489),疗效尚处于试验中。
3 小结与展望
免疫抑制治疗是目前AIH的标准疗法,由于部分患者对标准治疗不耐受或应答不佳,AIH的潜在治疗靶点及相关药物受到关注。基于AIH的发病机制,靶向免疫、肠道菌群等疗法部分已进入临床试验阶段。此外,应重视AIH患者的综合治疗,即实现生化缓解及组织学缓解的同时,应关注其生活质量及心理状态。临床研究方面,可开展多中心合作(欧洲多国已有先例),整合AIH患者的临床资料、进行回顾性研究。基础研究方面,对AIH的病理生理过程的理解和探索,有助于开发新疗法,实现转化医学的目标。
