叶酸受体介导靶向给药系统研究进展
2020-04-20高金龙李宛萍吴肖东高丽颖赵东亚张颖王奎涛段志清
高金龙 李宛萍 吴肖东 高丽颖 赵东亚 张颖 王奎涛 段志清


摘 要:靶向给药系统是诊断和治疗癌症的一种有效方法,因其副作用小、治疗效果好而受到广泛关注。叶酸受体在多数癌细胞表面过度表达,但在正常细胞表面低表达或未表达,与配体叶酸具有高度的亲和力。叶酸连接到药物载体上,可靶向作用于癌细胞。介绍了叶酸与叶酸受体,简述了叶酸受体介导靶向的作用机制,讨论了叶酸连接脂质体、胶束、纳米粒、聚合物载体、液晶叶酸纳米粒、负载药物通过叶酸受体介导诊治癌症的研究进展,分析了各自的优点和不足,提出了叶酸受体介导靶向给药系统的未来研究方向:一是对叶酸受体介导作用机制进行深入研究;二是对药物释放后载体的体内分布、代谢、排泄等过程做进一步探索;三是研究单一、易合成但高效的诊断或治疗剂,减少材料浪费,简化给药方式。
關键词:肿瘤治疗学;叶酸;叶酸受体;靶向;药物载体
中图分类号:TQ31;TB34;R944文献标识码:A
Abstract: Targeted drug delivery system is an effective way to diagnose and treat cancer. Because of its small side effects and good therapeutic effect, it has been widely concerned. Folate receptor is over expressed on the surface of most cancer cells, but it is low or not expressed on the surface of normal cells. Folate has a high affinity with the ligand folate. Connected to the drug carrier, folate can target cancer cells. Folic acid and folic acid receptors were introduced, the mechanism of folate receptor mediated targeting was briefly described. Furthermore, the research progress of diagnosis and treatment of cancer by using folic acid linked liposomes, micelles, nanoparticles, polymer carriers, liquid crystalline folic acid nanoparticles and loaded drugs through folate receptormediated was discussed, and the advantages and disadvantages were analyzed. Finally, the prospect of folic acid receptormediated targeted drug delivery system was presented. The first is to study the mechanism of folic acid receptor mediated action deeply. The second is to further explore the distribution, metabolism, excretion and other processes of carriers after drug release. The third is to study a single, easily synthesized but highly effective diagnostic or therapeutic agent to reduce material waste and simplify administration methods.
Keywords:neoplastic therapy; folic acid; folic acid receptor; target; drug carrier
化疗是临床治疗癌症的重要手段,然而大部分癌细胞毒性药物存在选择性差、毒副作用强、易产生耐药性等缺点。靶向给药系统可将药物安全高效地运输至目标位置,有效解决了这些问题[1]。
由于癌细胞的特异性,靶向配体介导的癌症治疗方法受到广泛关注。靶向配体主要包括蛋白质(如抗体、转铁蛋白)、肽(如环状RGD)、多糖(如透明质酸)和小生物分子(如叶酸)[2]。叶酸廉价易得、无毒、非免疫原性,且与叶酸受体具有高度的亲和力,其连接药物载体,通过主动靶向,使治疗药物高浓度积蓄于癌细胞表面并有效内化[34]。因此,对叶酸受体介导靶向给药系统的研究进展进行了分析。
1 叶酸受体介导药物作用机制
1.1叶酸和叶酸受体
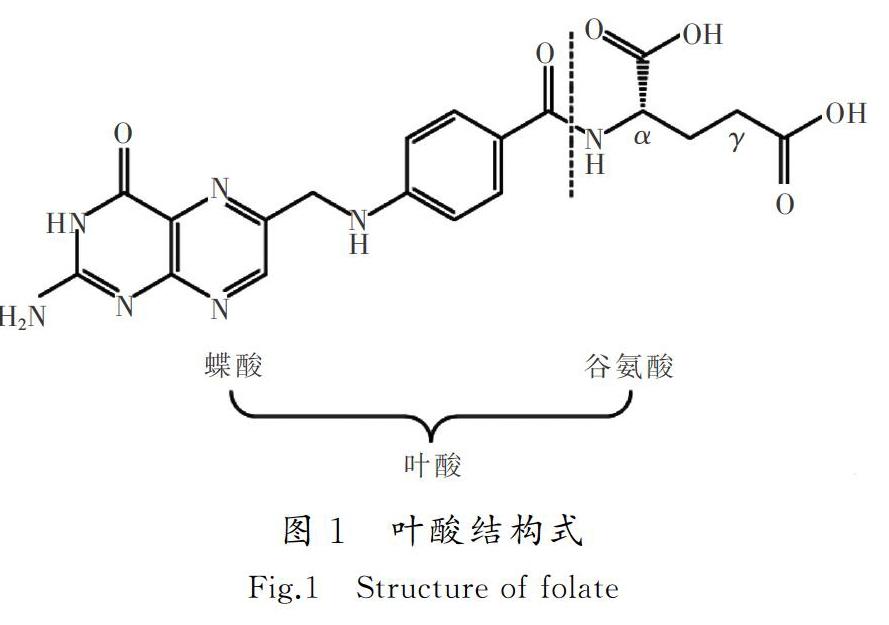
叶酸(folic acid,FA)也称维生素B9,是真核细胞核苷酸合成的必需物质,动物自身不能合成叶酸,只能依赖外源性叶酸的摄取和利用[5]。叶酸分子由蝶酸和谷氨酸2部分组成,结构如图1所示。研究发现,叶酸受体主要识别蝶酸部分,谷氨酸残基对亲和力的影响不大,因此通常将叶酸的谷氨酸部分与载体相连[6]。谷氨酸结构中包含2个羧酸基团:αCOOH和γCOOH,多数药物载体与γCOOH连接,这样便于FA偶联物与叶酸受体的结合[7]。
叶酸受体(folate receptor,FR)是细胞表面的一种糖蛋白,富含半胱氨酸,与FA及叶酸衍生物有较高的亲和力,并介导其发生内吞摄取[8]。FR在乳腺、卵巢、肺、肾、结肠和脑等多种癌细胞表面过度表达,而在正常组织和器官上较少表达或未表达,FR在癌细胞上的表达水平是正常组织的100~300倍[911]。因此,FR在癌症诊断和治疗上已成为广泛研究的新靶点。
1.2 叶酸受体介导的给药系统作用方式及机制
叶酸受体介导的靶向药物给药系统主要有2种作用方式。第1种:需要在癌细胞内释放发挥其细胞毒性或调节功能的药物,如大多数蛋白质毒素、基因治疗药物载体、胶体药物载体等;第2种:不需要在细胞内释放药物,但能在癌细胞表面发挥作用,FR作为癌细胞标记物,使药物高浓度积蓄在细胞表面,如前药激活酶、免疫治疗剂等[12]。如图2所示,叶酸偶联物首先与癌细胞表面FR识别结合,之后通过内吞作用进入细胞,形成核内体,在质子泵的作用下,核内体内的pH值下降,当pH值降为5时,叶酸偶联物与FR发生分离,药物释放发挥作用,FR又重新回到细胞表面,循环转运药物[13]。研究表明,只有10%~25%的FR结合物在细胞内释放,其余的将附着于FR上循环回到细胞表面,叶酸偶联物的内吞数量与癌细胞表面的FR表達数量基本成正比,一个癌细胞的内吞叶酸偶联物的速率为1×105~2×105分子/h[14]。
2 叶酸受体介导的靶向给药系统
叶酸受体介导的靶向给药系统主要有3类。第1类,叶酸直接与药物连接,这类给药系统溶解性差,生物利用度低,这里不做介绍。第2类,叶酸连接载体的靶向给药系统。设计流程如下:叶酸经聚乙二醇(PEG)等物质功能化后,通过化学反应连接到载体上(如脂质体、胶束、纳米粒、聚合物等),随后,PEG改性可以增加药物在体内的溶解度和延长药物的半衰期,载体可装载药物或纳米探针形成给药系统,最终选择合适的给药方式进行机体内实验,判断给药系统的靶向性和抑制癌细胞效果。该系统的合成及应用详见图3[11],这种靶向方式现阶段研究较广。第3类,叶酸自组装为液晶叶酸,以它为载体靶向给药。以下根据载体的不同进行分类综述。
2.1 叶酸脂质体
目前,脂质体制剂已上市应用于临床,如盐酸多柔比星脂质体注射液、注射用紫杉醇脂质体等,然而这些脂质体抗癌药物在治疗时也会使人体产生明显的全身不良反应。靶向脂质体的研究可以减轻这些副作用,同时增强药物抑制癌细胞的作用。CHEN等[15]制备了多种基因药物共同输送的脂质体。该脂质体以FA连接酸敏感膜壳(LFA),以DNA/蛋白质复合物为核心,形成脂质体(p53/CrNC/LFA),基因药物细胞色素c(cytochrome c,CytoC)和p53DNA被依次输送至癌细胞的细胞质和细胞核,联合促进细胞凋亡。MCF7荷瘤小鼠体内实验结果表明,p53/CrNC/LFA减少了药物在肝、脾等网状内皮系统的积蓄,体内主动靶向能力明显。该项研究表明,FA的连接能使载体靶向到达肿瘤位置,载体的巧妙设计使协同作用药物向不同作用部位输送,增强了靶向联合用药的癌细胞抑制作用,这为多药联用化疗的研究提供了方向。OLIVEIRA等[16]将FA添加至负载阿霉素(doxorubicin, DOX)的长循环pH敏感脂质体上(SpHLDOXFA),评估了SpHLDOXFA在4T1乳腺癌模型的体内外抗肿瘤活性。与非FA修饰的放射元素标记脂质体(99mTcSpHL)相比,静脉注射4 h后99mTcSpHLFA有更高的肿瘤吸收效果;此外,SpHLDOXFA在多次静脉给药后显示出比游离DOX更低的心脏毒性。这说明,叶酸脂质体能够降低化疗药物对正常组织的细胞毒性,对肿瘤细胞具有良好的靶向性。这些数据支持SpHLDOXFA进一步作临床前的开发研究,有希望成为治疗乳腺癌的药物给药系统。
2.2 叶酸胶束
两亲性嵌段共聚物在溶液中浓度达到临界胶束浓度及以上时,自组装成胶体大小的聚集体质点微粒为胶束,其粒径小,载药量高,体内循环时间长[17]。ZHANG等[18]开发了用于输送紫杉醇(PTX)的胶束,由FA和α生育酚琥珀酸酯(TOS)分别通过酯键连接到透明质酸(HA)上,合成了两亲性FAHATOS胶束。FA与HA联用增强了主动靶向作用,负载PTX的胶束在体外对人乳腺癌(MCF7)细胞和体内对小鼠肝癌(H22)细胞均具有出色的抑制作用。纪丹阳[19]制备了FA接枝的具有pH值响应性的硬脂酸白芨多糖共聚物(FABSPsSA),以多西他赛(DTX)为模型药物,通过乳化溶剂挥发法制备了载药胶束(DTX/FABSPsSA),胶束对DTX具有缓释、增溶的作用。MTT实验结果表明,胶束DTX/FABSPsSA和 DTX/BSPsSA对肝癌(HepG2)细胞和宫颈癌(Hela)细胞的毒性均高于DTX。此外,DTX/BSPsSA胶束对HepG2和Hela细胞的抑制作用几乎无差别,但DTX/FABSPsSA胶束对Hela细胞的抑制作用强于对HepG2细胞的抑制作用。这说明,DTX/FABSPsSA胶束可以与癌细胞表面FR结合,通过内吞作用,增强DTX对癌细胞的抑制作用。FABSPsSA 有望成为装载难溶药物的纳米载体,获得进一步研究。
2.3 叶酸纳米粒
2.3.1 叶酸载药纳米粒
多形性胶质母细胞瘤(GBM)是一种对成人和儿童致命性的脑内肿瘤,这种肿瘤生长快,不易凋亡,致死率高,尤其是对大脑的血脑屏障阻碍了药物的治疗。KUO等[20]合成了麦胚凝集素(WGA)和FA双靶向修饰的甲氧基聚乙二醇(MPEG)聚己内酯(PCL)纳米粒(WF NPs),WGA和FA分别以人脑微血管内皮细胞表达的N乙酰氨基葡萄糖和恶性U87MG细胞的叶酸受体为靶点,以依托泊苷(ETO)、卡莫司汀(BCNU)和DOX为模型药物。实验证明,载药WF NPs较游离药物能够减轻对人脑微血管内皮细胞(HBMECs细胞)、人脑血管周细胞(HBVPs细胞)、人星形胶质细胞(HAs细胞)的毒性作用。免疫荧光图像和细胞毒性测定表明,WF NPs可以靶向输送不同药物通过血脑屏障,抑制恶性胶质瘤U87MG细胞。因此WF NPs胶质载体有望成为治疗GBM的有效途径。除研究较为广泛的有机纳米粒外,氧化石墨烯(GO)因大比表面积和易于表面改性的特点,被制备成了靶向药物给药系统。FOROUSHANI等[21]制备了载5氟尿嘧啶(5Fu)和造影剂(DTPAMn(Ⅱ))的叶酸石墨烯/锰螯合物纳米粒(RGOPDABSA / FADTPAMn(Ⅱ)/ 5Fu),GO的特点使其可以同时负载大量癌症治疗和诊断药物。多巴胺(DA)在GO表面自组装生成聚多巴胺功能化的GO(RGOPDA),PDA膜可以保护石墨烯载体,同时PDA的表面基团可以被进一步修饰,随后牛血清白蛋白(BSA)和叶酸通过化学反应结合到RGOPDA上,形成结构稳定且具有靶向作用的RGOPDABSA/FA载体。将载药系统静脉注射CT26结肠癌荷瘤小鼠进行体内实验,并对注射小鼠器官进行组织病理学检查和ICPOES分析,结果表明,FA靶向系统较非靶向系统在抑制癌细胞药物输送方面具有更有效的生物分布。体外和体内磁共振成像以及对CT26结肠癌荷瘤小鼠注射治疗等实验数据均表明RGOPDABSA/FADTPAMn(Ⅱ)/5Fu兼具诊断和治疗癌症的能力。
2.3.2 叶酸磁导向纳米粒
磁导向纳米材料,由于其自身的超顺磁性和良好的生物相容性,既可用作药物载体,又是良好的MRI成像造影剂。叶酸的修饰使其增添了主动靶向作用,叶酸磁导向纳米粒被广泛用于肿瘤诊断和治疗研究中。GHOLIBEGLOO等[22]以FA环糊精纳米海绵(FACDNS)包裹Fe3O4纳米粒,制备出装载的姜黄素(CUR)的药物载体和T2加权磁共振成像的双重作用的肿瘤治疗剂(Fe3O4/CDNSFA@CUR NPs),如图4所示,CDNS提供了多孔的三维聚合物结构,使Fe3O4/CDNSFA@CUR NPs可以包封95%的亲脂药物CUR。药物体外释放实验显示,Fe3O4/CDNSFA@CUR NPs在pH值为5.5的环境下较在pH值为7.4时的释放速率快且释放量高(120 h后,pH值为5.5的释放50%,pH值为7.4的释放31%),这说明Fe3O4/CDNSFA@CUR NPs具有pH酸敏感性和缓释药物能力。MTT实验显示,Fe3O4/CDNSFA@CUR NPs同时作用肺癌细胞(M109细胞)和人正常乳腺上皮细胞(MCF 10A细胞),细胞存活率为M109细胞(24 h,37.8%;48 h,29.5%),MCF 10A细胞(24 h,57.2%;48 h,44.8%)。这表明Fe3O4/CDNSFA@CUR NPs可通过肿瘤表面的FR积蓄到癌细胞位置,同时癌细胞周围的酸环境加大了CUR的释放。体外MRI实验发现,Fe3O4/CDNSFA@CUR NPs具有良好的磁性和靶向能力,能够发挥肿瘤诊断和治疗双重效果。
无机金纳米粒子具有良好的化学惰性、表面易修饰性、优异的生物相容性和独特的光学性质,被广泛应用于癌症的光热治疗[23]。有人报道了叶酸载药金纳米粒制剂[2425],通过癌细胞表面的FR,进一步增加叶酸载药金纳米粒在癌细胞部位积蓄,使药物与光热治疗同时进行,增强疗效。叶酸纳米粒可以减轻化疗药物对机体的毒副作用,生物相容性大分子的修饰使载体稳定且提高载药量,癌症的诊断与治疗同样重要,造影剂和化疗药物同时负载到叶酸纳米粒上实现双重目的。
2.4 叶酸聚合物
聚合物药物载体包括天然高分子聚合物(如纤维素、壳聚糖、淀粉等)和人工合成的聚合物(如树枝状大分子、聚乙二醇等),具有良好的生物相容性、可降解、可负载疏水药物等优点,已被应用于药物载体研究。将聚合物连接叶酸,可达到靶向定位给药目的,因此人们研究了叶酸聚合物靶向给药系统。
2.4.1 叶酸有机聚合物
SATTARI等[26]制备了一种叶酸和糖双重靶向的直链淀粉(Am)纳米载体(FAgPAspgAm),FA和Am作为侧链连接到了聚琥珀酰亚胺(PSI)上,详见图5。随后负载模型药物CUR,自组装形成螺旋结构。扫描电镜(SEM)测定载体外貌,结果显示,FAgPAspgAm@CUR为纤维状结构,平均直径≤20 nm,说明载体载药量大且生物相容性良好。这是叶酸和糖靶向协作于给药系统的首次报道,载体的负载提高了CUR的水溶性和稳定性,但作为抗肿瘤制剂还需做进一步的研究。
树枝状大分子作为一种新型聚合物纳米材料,具有粒径较小(1~100 nm)、易于表面修饰和功能化等优点,广泛用于药物、寡核苷酸(siRNAs)、酶和疫苗等多种生物活性物质的递送。NARMANI等[27]研究了FA连接PEG涂层的聚酰胺胺型G4(PAMAM G4)作为5Fu的给药系统(PPFA5Fu),PAMAM类树枝状大分子未经FDA批准,不能单独用作药物载体,而FA和PEG的表面修饰降低了PAMAM G4的细胞毒性,同时提高了载体的稳定性,赋予其靶向作用。选择HT29人结直肠癌细胞株和正常成肌细胞C2C12细胞株进行MTT实验,结果表明,PPFA5Fu对HT29癌细胞有良好的抑制作用,而对正常细胞毒性较低,靶向作用被证实。
ZAMANI等[28]研究了治疗乳腺癌的口服药物制剂,合成了FALPEGPCL(L:赖氨酸,PCL:聚己内酯)聚合物载体,FALPEGPCL装载药物三苯氧胺 (TMX)和槲皮素(QUER)后可在水中自组装为圆形的胶束(FALPEGPCLTMXQUER),TMX和QUER联用,QUER可以保护TMX,减少TMX的首过效应,提高TMX的口服生物利用度。对乳腺癌模型小鼠进行口服给药,通过与游离药物TMXQUER的组合比较可知,FALPEGPCLTMXQUER表现出明顯的抑制癌细胞作用,实验35天后,FALPEGPCLTMXQUER组的肿瘤体积仅为TMXQUER组的12.1%。这说明叶酸受体介导作用,使2种药物被有效递送到肿瘤位置,提高了细胞摄取。因此, FALPEGPCLTMXQUER在靶向口服药物给药方面具有巨大潜力。
2.4.2 叶酸金属有机骨架材料
金属有机骨架材料(MOFs)又称多孔配位聚合物,是一类由金属离子或金属簇与有机配体自组装形成的网状骨架结构材料[29]。MOFs具有有机载体与无机载体结合的特点,如可装载多种类型的药物,载药量高,可生物降解和缓控释放药物等,已成为一种有前景的给药载体。QIN等[30]将光敏剂(Ce6)、掺钆的硅纳米粒子(SiGd NPs)、药物DOX、聚(2(二乙氨基)甲基丙烯酸乙酯)聚合物(HOOCPDMAEMASH)、FAPEG马来酰亚胺(MALPEGFA)整合到一个纳米平台,形成新型多功能MOFs材料(FZIF8/DOXPDFA),FZIF8/DOXPDFA靶向聚合物,将荧光成像与磁共振成像相结合,解决了成像穿透力有限、磁共振成像灵敏度低的问题,提高了成像精确度,负载药物DOX实现了化学、光动力和磁性联合诊治癌症。体外共聚焦显微镜和体内荧光/磁共振成像观察表明,FZIF8/DOXPDFA对MCF7细胞具有靶向作用。
2.5 叶酸其他载体
羟基磷灰石[HAP,Ca10(PO4)6(OH)2]是人和动物骨骼的主要无机成分之一,已被成功地用作骨骼修复和再生材料,同时HAP纳米棒是一种优良的纳米载体[31]。WANG等[32]和LI等[33]均以DOX为模型药物,制备了叶酸HAP纳米棒@DOX,材料具有高载药量和叶酸受体靶向作用。
叶酸还可以连接其他的纳米载体,如纳米胶囊[34]、纳米凝胶[35]、微球[36]、生物大分子[3738]等,在此不一一赘述。
2.6 液晶叶酸
叶酸在一定条件下可以自组装形成有序结构的结晶,称为液晶叶酸,国外有人用液晶叶酸装载药物进行了细胞靶向研究[39]。笔者在实验室合成了液晶叶酸纳米粒,扫描电子显微镜图(SEM)如图6所示,以左旋咪唑(广谱驱虫药,又可用于免疫调节)为模型药物,制备了载药纳米粒,载药量可达87%,同时具有缓释作用。体外MTT实验发现,载药纳米粒较游离药物对MCF7细胞抑制作用更强,这表明液晶叶酸纳米粒具有靶向作用[40]。但在研究过程中发现,液晶叶酸纳米粒不易制备,纳米粒结构不稳定,对体内抑制癌细胞还未进行探索,这阻碍了液晶叶酸纳米粒的临床应用。
3 结论与展望
作用于叶酸受体介导的叶酸纳米载体显示出优异的靶向性,叶酸与叶酸受体具有高度亲和力,叶酸靶向纳米载体,装载药物,通过叶酸受体介导,使药物精准到达癌细胞或经内吞作用进入细胞质发挥作用,提高了药物安全性和生物利用度。
经过不断改进,叶酸靶向纳米载体成为集多种药物协同递送、高载药量、缓控释放、双重靶向、集化学光动力治疗和磁共振成像诊断于一体的叶酸受体介导靶向给药系统,提高了癌症的治疗效果。值得一提的是,有人发现在活化的巨噬细胞上也存在FR[41],这使叶酸受体介导靶向给药系统用于巨噬细胞介导的炎症和自身免疫性疾病(包括风湿性关节炎、狼疮等)的诊断和治疗成为可能[42]。该方法的上述优势优点吸引着科研人员对叶酸受体介导靶向给药系统进行临床试验。
未来研究应着眼以下几方面。一是叶酸靶向纳米载体与叶酸受体结合后释放较慢,药物释放可能达不到治疗剂量,因此对叶酸受体介导作用机制应进行深入研究;二是应对药物释放后载体的体内分布、代谢、排泄等过程做进一步探索;三是叶酸靶向纳米载体的结构越来越复杂,功能多样,将来应深入研究单一、易合成且高效的诊断或治疗剂,减少材料浪费,使给药方式更为简单。希望叶酸受体介导给药系统在不久的将来能够应用于临床靶向治疗,造福人类。
参考文献/References:
[1] DAVIS M E, CHEN Z, SHIN D M. Nanoparticle therapeutics: An emerging treatment modality for cancer[J]. Nature Reviews Drug Discovery, 2008, 7(9):771782.
[2] ZHONG Y, MENG F, DENG C, et al. Liganddirected active tumortargeting polymeric nanoparticles for cancer chemotherapy[J].Biomacromolecules,2014,15(6):19551969.
[3] 刘日钊,谢民强.叶酸修饰的纳米材料在肿瘤靶向治疗中的应用研究进展[J].中国医药生物技术,2015,10(4):297302.
[4] KUMAR P, HUO P, LIU B. Formulation strategies for folatetargeted liposomes and their biomedical applications[J]. Pharmaceutics, 2019, 11(8):381387.
[5] 张文平,陈艳五,张昆,等.叶酸介导靶向给药体系研究进展[J].中华中医药学刊,2017,35(7):18551859.
ZHANG Wenping, CHEN Yanwu, ZHANG Kun, et al. Research on folic mediated targeted drug delivery system[J]. Chinese Archives of Traditional Chinese Medicine, 2017, 35(7):18551859.
[6] 趙杰,曹胜利,郑晓霖,等.叶酸受体介导的抗肿瘤药物研究进展[J].药学学报,2009,44(2):109114.
ZHAO Jie, CAO Shenli, ZHENG Xiaolin, et al. Folate receptormediated antitumor drugs[J]. Acta Pharmaceutica Sinica, 2009,44(2):109114.
[7] 付利强,丁实,杨玉社.叶酸受体介导的小分子抗肿瘤药物研究进展[J].中国药物化学杂志,2013,23(3):226234.
FU Liqiang, DING Shi, YANG Yushe. Progress in folate receptormediated anticancer agent delivery[J]. Chinese Journal of Medicinal Chemistry, 2013, 23(3):226234.
[8] CHEN C, KE J, ZHOU X E, et al. Structural basis for molecular recognition of folic acid by folate receptors[J]. Nature, 2013, 500(7463):486489.
[9] PARKER N, TURK M J, WESTRICK E, et al. Folate receptor expression in carcinomas and normal tissues determined by a quantitative radioligand binding assay[J]. Analytical Biochemistry, 2005, 338(2):284293.
[10]ELNAKAT H, RATNAM M. Distribution, functionality and gene regulation of folate receptor isoforms: implications in targeted therapy[J]. Advanced Drug Delivery Reviews, 2004, 8(56):10671084.
[11]XU L, BAI Q, ZHANG X, et al. Folatemediated chemotherapy and diagnostics: An updated review and outlook[J]. Journal of Controlled Release, 2017, 252:7382.
[12]TYAGI S, RAWAT S, SAXENA S. Folate conjugates: A boon in the anticancer therapeutics[J]. International Journal of Pharmaceutical Sciences and Research, 2016, 7(11): 42784280.
[13]LU Y, LOW P S. Folatemediated delivery of macromolecular anticancer therapeutic agents[J]. Advanced Drug Delivery Reviews, 2002, 54(5):675693.
[14]PAULOS C M, REDDY J A, LEAMON C P, et al. Ligand binding and kinetics of folate receptor recycling in vivo: Impact on receptormediated drug delivery[J]. Molecular Pharmacology, 2004, 66(6): 14061414.
[15]CHEN X, ZHU Q, XU X, et al. Sequentially sitespecific delivery of apoptotic protein and tumorsuppressor gene for combination cancer therapy[J]. Small, 2019,15(40):190298.
[16]de OLIVEIRA S J, FERNANDES R S, ODA C M R, et al. Folatecoated, longcirculating and pHsensitive liposomes enhance doxorubicin antitumor effect in a breast cancer animal model[J]. Biomedicine & Pharmacotherapy, 2019, 118: 109323.
[17]DAND N M, PATEL P B, AYRE A P, et al. Polymeric micelles as a drug carrier for tumor targeting[J]. Chronicles of Young Scientists, 2013, 4(2):94101.
[18]ZHANG X, LIANG N, GONG X, et al. Tumortargeting micelles based on folic acid and αtocopherol succinate conjugated hyaluronic acid for paclitaxel delivery[J]. Colloids and Surfaces B: Biointerfaces, 2019, 177: 1118.
[19]紀丹阳. 叶酸介导靶向肿瘤细胞的白芨多糖聚合物胶束给药系统的研究[D].长春:吉林大学, 2019.
JI Danyang.Study on Copolymer Micellar Delivery System of Bletilla Striata Polysaccharide for Targeting Tumor Cells Mediated by Folic Acid[D].Changchun:Jilin University,2019.
[20]KUO Y C, CHANG Y H, RAJESH R. Targeted delivery of etoposide, carmustine and doxorubicin to human glioblastoma cells using methoxy poly (ethylene glycol)poly (εcaprolactone) nanoparticles conjugated with wheat germ agglutinin and folic acid[J]. Materials Science and Engineering: C, 2019, 96:114128.
[21]FOROUSHANI M S, SHERVEDANI R K, KEFAYAT A, et al. Folategraphene chelate manganese nanoparticles as a theranostic system for colon cancer MR imaging and drug delivery: Invivo examinations[J]. Journal of Drug Delivery Science and Technology, 2019, 54:101223.
[22]GHOLIBEGLOO E, MORTEZAZADEH T, SALEHIAN F, et al. Folic acid decorated magnetic nanosponge: An efficient nanosystem for targeted curcumin delivery and magnetic resonance imaging[J]. Journal of Colloid and Interface Science, 2019, 556:128139.
[23]任樂.基于RGDC肽修饰的金纳米粒子用于光热疗法治疗胰腺癌的研究[D].合肥:安徽医科大学,2018.
REN Le.Photothermal Therapy based on RGDC Peptide Modified Gold Nanoparticles for Pancreatic Cancer[D].Hefei: Anhui Medical University,2018.
[24]MBATHA L S, MAIYO F C, SINGH M. Dendrimer functionalized folatetargeted gold nanoparticles for luciferase gene silencing in vitro: A proof of principle study[J]. Acta Pharmaceutica, 2019, 69(1):4961.
[25]MATHEW M S, VINOD K, JAYARAM P S, et al. Improved bioavailability of curcumin in GliadinProtected gold quantum cluster for targeted delivery[J]. ACS Omega, 2019, 4(10):1416914178.
[26]SATTARI S, TEHRANI A D, ADELI M, et al. Development of new nanostructure based on poly (aspartic acid)gamylose for targeted curcumin delivery using helical inclusion complex[J]. Journal of Molecular Liquids, 2018, 258:1826.
[27]NARMANI A, MOHAMMADNEJAD J, YAVARI K. Synthesis and evaluation of polyethylene glycoland folic acidconjugated polyamidoamine G4 dendrimer as nanocarrier[J]. Journal of Drug Delivery Science and Technology, 2019, 50:278286.
[28]ZAMANI M, AGHAJANZADEH M, ROSTAMIZADEH K, et al. In vivo study of poly (ethylene glycol)poly (caprolactone)modified folic acid nanocarriers as a pH responsive system for tumortargeted codelivery of tamoxifen and quercetin[J]. Journal of Drug Delivery Science and Technology, 2019, 54:101283.
[29]HUXFORD R C, DELLA R J, LIN W. Metalorganic frameworks as potential drug carriers[J]. Current Opinion in Chemical Biology, 2010, 14(2):262268.
[30]QIN Y, PENG H, HE X, et al. pHresponsive polymerstabilized ZIF8 nanocomposites for fluorescence and magnetic resonance dualmodal imagingguided chemo/photodynamic combinational cancer therapy[J]. ACS Applied Materials & Interfaces, 2019, 11(37):3426834281.
[31]THORWARTH M, SCHULTZEMOSGAU S, KESSLER P, et al. Bone regeneration in osseous defects using a resorbable nanoparticular hydroxyapatite[J]. Journal of Oral and Maxillofacial Surgery, 2005, 63(11):16261633.
[32]WANG H, HE L, ZHANG P, et al. Folatemodified hydroxyapatite nanorods induce apoptosis in MCF7 cells through a mitochondrialdependent pathway[J]. New Journal of Chemistry, 2019, 43(37):1472814738.
[33]LI H, SUN X, LI Y, et al. Preparation and properties of carbon nanotube (Fe)/hydroxyapatite composite as magnetic targeted drug delivery carrier[J]. Materials Science and Engineering: C, 2019, 97:222229.
[34]LI X, ZHAO X, PARDHI D, et al. Folic acid modified cell membrane capsules encapsulating doxorubicin and indocyanine green for highly effective combinational therapy in vivo[J]. Acta Biomaterialia, 2018, 74:374384.
[35]YIN M, SU Z, CUI B, et al. A new type of nanogel carrier based on mixed pluronic loaded with lowdose antitumor drugs[J]. Journal of Wuhan University of Technology:Mater Sci Ed, 2019, 34(4):960967.
[36]CHEN J, CHEN X, YANG Z, et al. Preparation and characterization of folic acid functionalized bioactive glass for targeted delivery and sustained release of methotrexate[J]. Journal of Biomedical Materials Research Part A, 2019, 107(2):319329.
[37]DAI Y, CAI X, BI X, et al. Synthesis and anticancer evaluation of folic acidpeptidepaclitaxel conjugates for addressing drug resistance[J]. European Journal of Medicinal Chemistry, 2019, 171:104115.
[38]SUN Y, ZHAO Y, TENG S, et al. Folic acid receptortargeted human serum albumin nanoparticle formulation of cabazitaxel for tumor therapy[J]. International Journal of Nanomedicine, 2019, 14:135148.
[39]MISRA R, MOHANTY S. Selfassembled liquidcrystalline folate nanoparticles for in vitro controlled release of doxorubicin[J]. Biomedicine & Pharmacotherapy, 2015, 69: 326336.
[40]付英超. 自組装液晶叶酸载药纳米粒子的制备及性能研究[D].石家庄:河北科技大学, 2018.
FU Yingchao. Preparation and Properties of Selfassembled Liquid Crystal Folic Acid Nanoparticles[D]. Shijiazhuang:Hebei University of Science and Technology,2018.
[41]SEGA E I, LOW P S. Tumor detection using folate receptortargeted imaging agents[J]. Cancer and Metastasis Reviews, 2008, 27(4): 655664.
[42]孙祥石. 叶酸靶向酸敏感siRNA纳米粒在类风湿性关节炎治疗中的研究[D].长春:吉林大学,2019.
SUN Xiangshi.Delivery of siRNA using Folate ReceptorTargeted pHSensitive Polymeric Nanoparticles for Rheumatoid Arthritis Therapy[D].Changchun:Jilin University,2019.
