单核细胞/高密度脂蛋白、单核细胞/淋巴细胞与急性 ST段抬高型心肌梗死直接PCI术后的影响
2020-04-20高贝贝王龙林晓晓
高贝贝 王龙 林晓晓

【摘要】 目的 探讨单核细胞/高密度脂蛋白比值(MHR)、单核细胞/淋巴细胞比值(MLR)与ST段抬高型心肌梗死(STEMI)及近期心血管事件的关系。 方法 纳入2010年1月至2012年12月杭州市第一人民医院心内科经急诊冠状动脉造影确诊为STEMI的患者作为STEMI组,另选取我院冠状动脉造影检查诊断非冠心病的患者作为对照组。比较两组的一般资料、实验室检验指标。通过多因素Logistic回归分析、ROC曲线评价 MHR、MLR对STEMI 的诊断价值。 结果 本研究共收集STEMI患者191例,非冠心病患者211例。STEMI组中高血压病史、糖尿病病史、吸烟史所占比及血清肌酐、超敏CRP、血红蛋白、血小板计数、单核细胞计数、MHR、MLR高于对照组,差异有统计学意义(P < 0.05)。通过多因素回归分析示,MHR、MLR是STEMI的独立影响因素(MHR:OR=29.20,P < 0.05;MLR:OR=0.08,P < 0.05)。通过ROC曲线分析,MHR、MLR及MHR联合MLR对STEMI有一定的诊断价值(MHR:敏感度59.70%,特异度63.00%,AUC=0.64,P < 0.05;MLR:敏感度70.70%,特異度56.90%,AUC=0.67,P < 0.05)。MHR < 0.45和MHR≥0.45两组、MLR < 0.35和MLR≥0.35两组患者组间1月内的生存曲线比较差异均有统计学意义(P < 0.05),且高MHR组、高MLR组患者的生存率较低。 结论 MHR、MLR是STEMI的独立影响因素,可作为辅助诊断STEMI的指标,高MHR及高MLR提示预后不良。
【关键词】 单核细胞/高密度脂蛋白比值;单核细胞/淋巴细胞比值;急性ST段抬高型心肌梗死
冠状动脉粥样硬化性心脏病(CAD)是一种侵犯大动脉血管壁的慢性炎症性疾病。ST段抬高型心肌梗死(STEMI)是常见的冠心病类型之一,其发病急,并发症多,死亡率高的特点,目前中国急性心肌梗死的发病率、死亡率持续保持上升趋势[1]。炎症因子,例如C反应蛋白,中性粒细胞比淋巴细胞比值(NLR)已经被认为在稳定型心绞痛、急性冠状动脉综合征等疾病中作为新型炎性标记物[2-3]。单核细胞/淋巴细胞比值(MLR)是另外一种炎症标记物[4],研究发现,行急诊经皮冠状动脉介入(PCI)的STEMI患者的MLR是与不良心血管事件(MACEs)发生密切相关的独立危险因素,且与无复流密切相关[5]。高密度脂蛋白(HDL-c)可通过逆向转运胆固醇、抗炎及抗氧化等机制发挥抗动脉粥样硬化等作用。单核细胞/HDL-c(MHR)预测冠状动脉狭窄严重程度、冠状动脉支架内再狭窄及冠状动脉支架植入术后心源性死亡等[6]。本研究旨在探讨MHR、MLR与 STEMI 及其预后的关系。
1 资料与方法
1.1 一般资料 本研究连续性回顾了2010年1月至2012年12月之间在杭州市第一人民医院心血管内科行急诊PCI的STEMI患者作为STEMI组,入组191例,符合《2017 ESC ST段抬高患者急性心肌梗死治疗指南》,其中男133例,女58例,平均(64.85±12.04)岁。同时选取同期经冠状动脉造影检查为非冠心病患者211例作为对照组,其中男105例,女106例,平均(63.23±9.27)岁。收集患者一般资料,包括年龄、性别、体质量指数(BMI)、高血压病史、糖尿病病史、吸烟史等。患者出院1个月后电话随访出院后的基本情况,并做记录,无失访患者。排除标准:(1)近期合并脑、肺、肝、肾、脾或四肢等动脉栓塞、弥散性血管内凝血等疾病;(2)患者合并慢性肝病、恶性肿瘤;(3)患有血液系统疾病、免疫系统疾病、结缔组织疾病和(或)正在服用激素;(4)合并病毒性心肌炎、心包炎、心肌病、感染性心内膜炎、严重瓣膜疾病等其他器质性心脏病;(5)合并严重感染性疾病。
1.2 方法 所有STEMI组患者急诊首次抽取上肢静脉血3 mL,对照组在入院首次抽取静脉血3 mL,均采用全自动五分类血细胞分析仪检测血红蛋白计数、血小板计数、单核细胞计数、淋巴细胞计数;采用全自动生化分析仪检测总胆固醇(TC)、低密度脂蛋白(LDL-c)、HDL-c及甘油三酯(TG)。
观察终点 观察入组STEMI患者急诊PCI术后1个月内的MACEs(包括全因死亡、再发心肌梗死、急性心力衰竭、恶性心律失常)的发生率。全因死亡定义为任何原因引起的死亡。再发心肌梗死定义连续两个导联出现新的病理性Q波或肌钙蛋白升高大于正常值上限3倍或者新发左束支传导阻滞或冠状动脉造影提示血栓病变。急性心力衰竭定义为突发胸闷气促症状及BNP较前升高倍数3倍以上。恶性心律失常定义为出现室性心动过速、心室颤动及高度房室传导阻滞。随访方式包括电话随访、门诊随访等。
1.3 统计学处理 应用SPSS19.0版统计软件进行数据分析。计量数据以(x±s)表示。符合正态分布的数据采用t检验;计数资料分析采用χ2检验。STEMI的影响因素采用单因素和多因素Logistic回归分析。此外,采用ROC曲线分析MHR、MLR对STEMI患者特异度、敏感度诊断价值。通过Kaplan-Meier法估计1个月内的全因死亡率。P < 0.05为差异有统计学意义。
2 结果
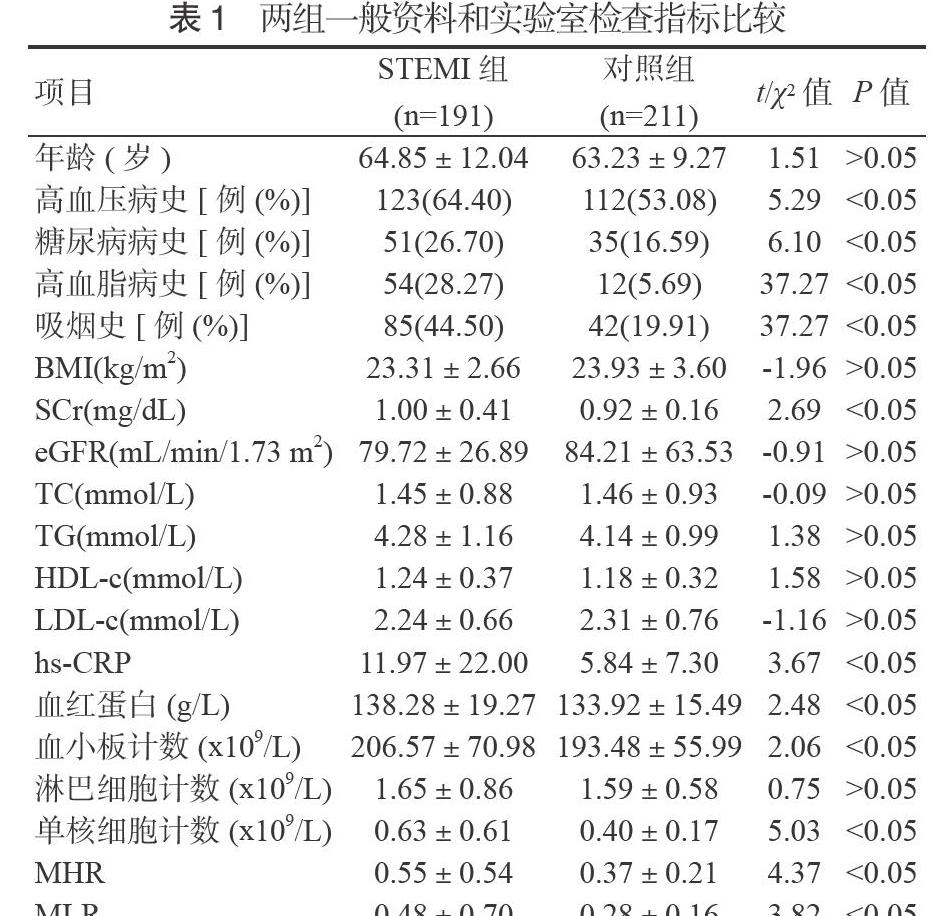
2.1 STEMI组与对照组的一般资料和实验室检查指标比较 两组患者年龄、BMI、肌酐清除率(eGFR)、TC、TG、HDL-c、LDL-c比较,差异无统计学意义(P > 0.05);STEMI组中高血压病史、糖尿病病史、高血脂病史、吸烟史所占比及血清SCr、hs-CRP、血红蛋白、血小板计数、单核细胞计数、MHR、MLR高于对照组,差异有统计学意义(P < 0.05),见表1。
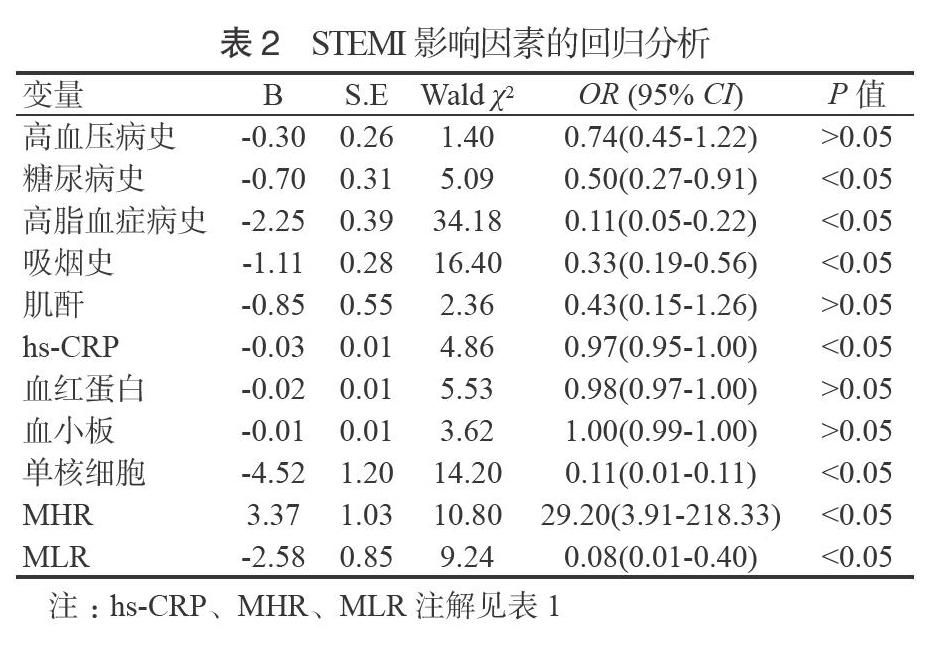
2.2 STEMI的多因素Logistic回归分析 将表1中有统计学差异的指标作为自变量,STEMI作为因变量进行多因素Logistic回归分析,结果显示,糖尿病史、高脂血症病史、吸烟史、hs-CRP、血红蛋白、单核细胞、MHR、MLR是STEMI的独立影响因素(P < 0.05),见表2。
2.3 MHR、MLR、MHR联合MLR对STEMI的诊断价值分析 通过ROC曲线分析MHR、MLR及MHR联合MLR对急性心肌梗死的诊断价值分析,利用Youdens指数(Youdens指数=灵敏度+特异度-1)选择最优的截断值。结果表明:MHR诊断STEMI的ROC曲线下面积(Area under curve,AUC)为0.64,当MHR比值为0.39,敏感度59.70%,特异度63.00%,此时敏感度和特异度均最大,初步推断MHR比值为0.39是诊断STEMI的较优截断值。MLR诊断STEMI的ROC的AUC为0.67;当MLR比值为0.26,敏感度70.70%,特异度56.90%,此时敏感度和特异度均最大,初步推断MLR比值为0.26是诊断STEMI的较优截断值。此外,MHR联合MLR诊断STEMI的AUC为0.68;差异有统计学意义(P < 0.05),见图1。
2.4 STEMI患者行急诊PCI术后近期的心血管事件分析 根据MHR比值的中位数及患者病例数,确定0.45为截点。将STEMI患者分成两组,分为MHR < 0.45和MHR≥0.45两组,其中恶性心律失常、1個月内全因死亡上两组比较差异有统计学意义,且高MHR组较低MHR组发生率高(P < 0.05)。根据MLR比值的中位数及患者病例数,确定0.35为截点。将STEMI患者分成两组,分为MLR < 0.35和MLR≥0.35两组,1个月内全因死亡率上两组比较差异有统计学意义,且高MLR组较低MLR组发生率高(P < 0.05)见表3。MHR < 0.45和MHR≥0.45两组、MLR < 0.35和MHR≥0.35两组患者组间1个月内的生存曲线比较差异均有统计学意义(P < 0.05),且高MHR组、高MLR组患者的生存率较低,见图2。
3 讨论
冠心病尤其是急性心肌梗死已经成为严重危害人民健康的主要疾病之一,已知危险因素包括高血压、糖尿病、血脂异常、年龄、性别、吸烟史等,而大多数STEMI人群存在一个或者多个危险因素。本研究中STEMI患者的高血压病史、糖尿病病史、高血脂病史、吸烟史所占比及血清SCr、hs-CRP、血红蛋白高于健康人群,这与传统的研究结果相符[7]。
目前研究认为,动脉粥样硬化最大的风险因素是代谢紊乱和炎症反应[8]。当胆固醇-载脂蛋白与动脉血管内皮细胞外基质结合,引发白细胞和血小板等粘附并实现跨内皮迁移,与过度增殖的血管平滑肌聚合形成斑块,逐渐氧化变质,当斑块脱落后,会在血管中形成血栓,从而引发急性心肌梗死、脑梗塞等疾病,最终危及生命[9]。因此,我们需要找到一个新的诊断指标及预后指标,帮助我们更好的诊断心肌梗死及预测其MACEs。
既往研究表明,淋巴细胞、单核细胞是机体重要的免疫细胞,并参与一系列炎症反应,而HDL是机体重要的抗炎物质,三者在动脉粥样斑块发生、发展及血栓事件中起到重要的作用[10-11]。研究发现,低表达的淋巴细胞计数与高表达的单核细胞计数与急性心肌梗死后出现左心室功能不全和心室室壁瘤相关,淋巴细胞减少可以加重斑块负荷,促进斑块脂质坏死,导致急性斑块破裂,引起急性心血管事件[12]。HDL-c有许多特性,它抑制动脉粥样斑块形成:促进胆固醇(TC)从细胞逆转运、抑制单核细胞激活及迁移、抑制炎症反应、抑制血栓活性以及抗氧化作用[13-14]。
MHR、MLR是冠心病的独立影响因素,可作为诊断多种心血管病、肿瘤等疾病的辅助诊断指标[4]。本研究结果发现,STMEI患者MHR、MLR高于对照组;通过单因素及多因素回归分析,高血压病史、糖尿病史、吸烟史、hs-CRP、血红蛋白、单核细胞、MHR、MLR是STEMI的独立影响因素。可能为诊断STEMI提供一个有意义的指标,这与既往研究一致[15]。需要指出,MHR、MLR及MHR联合MLR的诊断价值偏低,可能与本文随访时间片短,样本量偏少有一定的关系。本研究随访行急诊PCI的STEMI患者1个月内的心血管事件,我们发现,高MHR组较低MHR组恶性心律失常、1个月内全因死亡上有统计学差异;比较组间1个月内的生存曲线,高MHR组、高MLR组患者的生存率较低。
综上所述,MHR、MLR 是 STEMI 的独立影响因素,可作为辅助诊断 STEMI 的指标;高MHR组、高MLR组患者的生存率较低。但本研究注意到STEMI患者1个月内全因死亡率偏高,主要原因入组STEMI样本中剔除一部分符合排除标准的STEMI患者,也由于入选心肌梗死患者的缺血时间长,导致死亡率偏高;同时为单中心研究且样本量较小,代表性有限,结论仍有待联合多中心、大样本量进一步证实,后续需要进一步长程随访跟踪急性心肌梗死心血管事件。
参考文献
[1] 胡盛寿,高润霖,刘力生,等. 中国心血管病报告2018概要[J]. 中国循环杂志,2019,(34)3:209-220.
[2] ?a?da? M, Rencüzo?ullari I, Karakoyun S, et al. Assessment of relationship between c-reactive protein to albumin ratio and coronary artery disease severity in patients with acute coronary syndrome[J]. Angiology, 2019, 70(4):361-368.
[3] Xu N, Tang XF, Yao Y, et al. Predictive value of neutrophil to lymphocyte ratio in long-term outcomes of left main and/or three-vessel disease in patients with acute myocardial infarction[J]. Catheter Cardiovasc Interv, 2018, 91(1):551-557.
[4] Hu P, Shen H, Wang G, et al. Prognostic significance of systemic inflammation-based lymphocyte-monocyte ratio in patients with lung cancer: based on a large cohort study[J]. PLoS One, 2014, 9(9):1-6.
[5] Alparslan Kurtul, Mikail Yarlioglues, Ibrahim Etem Celik, et al. Association of lymphocyte-to-monocyte ratio with the no-reflow phenomenon in patients who underwent a primary percutaneous coronary intervention for ST-elevation myocardial infarction[J]. Coron Artery Dis, 2015, 26(8):706-712.
[6] ?i?ek G, Kundi H, Bozbay M, et al. The relationship between admission monocyte HDL-C ratio with short-term and long-term mortality among STEMI patients treated with successful primary PCI[J]. Coron Artery Dis, 2016, 27(3):176-184.
[7] Go AS, Dariush M, Roger VL, et al. Executive summary: heart disease and stroke statistics—2014 update: a report from the American Heart Association[J]. Circulation, 2014, 129(3):399-410.
[8] Libby P, Ridker PM, Hansson GK. Progress and challenges in translating the biology of atherosclerosis[J]. Nature, 2011, 473(7347):317-325.
[9] Williams JW, Huang LH, Randolph GJ. Cytokine circuits in cardiovascular disease[J]. Immunity, 2019, 50(4):941-954.
[10] Hofmann U, Frantz S. Role of lymphocytes in myocardial injury, healing, and remodeling after myocardial infarction[J]. Circ Res, 2015, 116(2):354-367.
[11] Woollard KJ, Geissmann F. Monocytes in atherosclerosis: subsets and functions[J]. Nat Rev Cardiol, 2010, 7(2):77-86.
[12] Campbell KA, Lipinski MJ, Doran AC, et al. Lymphocytes and the adventitial immune response in atherosclerosis[J]. Circ Res, 2012, 110(6):889-900.
[13] Barylski M, Toth PP, Nikolic D, et al. Emerging therapies for raising high density lipoprotein cholesterol (HDL-C) and augmenting HDL particle functionality[J]. Best Pract Res Clin Endocrinol Metab, 2014, 28(3):453-461.
[14] Kingwell BA, Chapman MJ, Kontush A, et al. HDL-targeted therapies: progress, failures and future[J]. Nat Rev Drug Discov, 2014, 13(6):445-464.
[15] Ar?soy A, Altunka? F,Karaman K, et al. Association of the monocyte to hDL cholesterol ratio with thrombus burden in patients with ST-segment elevation myocardial infarction[J]. Clin Appl Thromb Hemost, 2017, 23(8):992-997.
(收稿日期:2019-07-25)
(本文編辑:蒋爱敏)
