胸腺原发性黏液腺癌1例并文献复习
2020-04-20徐艳华周秋媛王红莉
徐艳华,周秋媛,王红莉
胸腺癌发病率低,仅占胸腺上皮性肿瘤的18%,常见类型为鳞状细胞癌,胸腺原发性黏液腺癌非常罕见。本文现报道1例胸腺原发性黏液腺癌,并复习相关文献,旨在提高对该肿瘤的认识水平。
1 材料与方法
1.1 临床资料患者女性,48岁,因体检发现纵隔肿物5天入院,无明显不适症状。CT示前纵隔胸腺区可见团块状混杂密度影,边界尚清,形态不规则,呈分叶状改变,肿块大小8 cm×4.9 cm,密度不均,可见结片状低密度影及高密度钙化影,增强扫描可见不均匀强化,其余双肺纹理清楚,肺实质内未见明显异常密度影及异常强化影。两肺门影不大,结构清晰,余未见异常,纵隔内未见明显肿大淋巴结影。无胸腔积液及胸膜增厚。其余影像学检查示肺部、乳腺、女性生殖系统等均未见明显异常,消化内镜检查示胃肠道未见肿块。遂行纵隔肿瘤切除+胸腺扩大切除术,术中见左前上纵隔有一大小8 cm×5 cm的肿块,压迫左肺动脉主干,界限欠清,局灶侵犯左侧无名静脉、心包、左侧纵隔胸膜。
1.2 方法送检手术标本经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,HE染色,免疫组化染色采用SP法,DAB显色。抗体CK、CD5、CK7、CK20、Villin、CDX-2、MUC-2、TTF-1、Napsin A、CD56、Syn、CgA、MC、Calretinin,均购自北京中杉金桥公司,具体操作步骤严格按试剂盒说明书进行。
2 结果
2.1 眼观灰红色肿块1个,大小9.5 cm×9 cm×4.5 cm,包膜完整,切开呈多结节状,切面灰白色,实性,质中,伴钙化及坏死,局部见囊腔,内含灰褐色液体,外附少量脂肪组织。另送胸腺上背脂肪组织,内扪及淋巴结数枚,直径0.3~1.2 cm,双侧心隔角脂肪组织内未扪及明显结节。
2.2 镜检多量黏液背景下可见肿瘤性上皮细胞巢,细胞为立方状、柱状,呈腺泡状、乳头状及筛状结构排列(图1),局部可见囊腔,并见良性上皮逐渐移行为异型上皮,形成复层、腺管样结构(图2),肿瘤周边可见残留的胸腺组织(图3)。送检胸腺上背淋巴结查见癌转移(2/19)。
2.3 免疫表型肿瘤细胞CK、CK7(图4)、CK20(图5)、Villin、CDX-2(图6)、MUC-2均阳性,CD5、TTF-1、Napsin A、CD56、Syn、CgA、MC、Calretinin均阴性,Ki-67增殖指数约60%。
2.4 病理诊断胸腺:黏液腺癌,肿块大小9.5 cm×9 cm×4.5 cm,胸腺上背淋巴结(2/19)见癌转移,“双侧心隔角脂肪”未见癌浸润。
3 讨论
原发性胸腺癌最常见类型为鳞状细胞癌,还有一些少见亚型,包括基底细胞样癌、黏液表皮样癌、淋巴上皮瘤样癌、透明细胞癌、肉瘤样癌和神经内分泌肿瘤[1]等。胸腺原发性黏液腺癌非常罕见,2003年Choi等[2]首次报道胸腺黏液腺癌,目前国外仅报道10余例[2-14]。WHO(2015)胸腺肿瘤新分类中将胸腺癌分为4个亚型:乳头状腺癌、伴有腺样囊性癌样特征的胸腺癌、黏液腺癌及腺癌,非特殊类型,其中非特类型腺癌包括乳头状结构的高级别腺癌、管状腺癌和乳头状管状腺癌。与旧版相比,WHO(2015)胸腺肿瘤新分类将黏液腺癌作为一个新的独立肿瘤。
本文总结文献报道的14例胸腺黏液腺癌[2-12],患者发病年龄15~82岁,男女比为1 ∶1.3,女性患者略多,肿块直径5.2~14.5 cm,部分患者有胸闷、胸痛、气短、呼吸困难等症状,部分患者无明显症状,体检时发现纵隔占位。本例为女性,48岁,肿块直径9.5 cm,体检发现纵隔肿物,与文献报道一致(表1)。
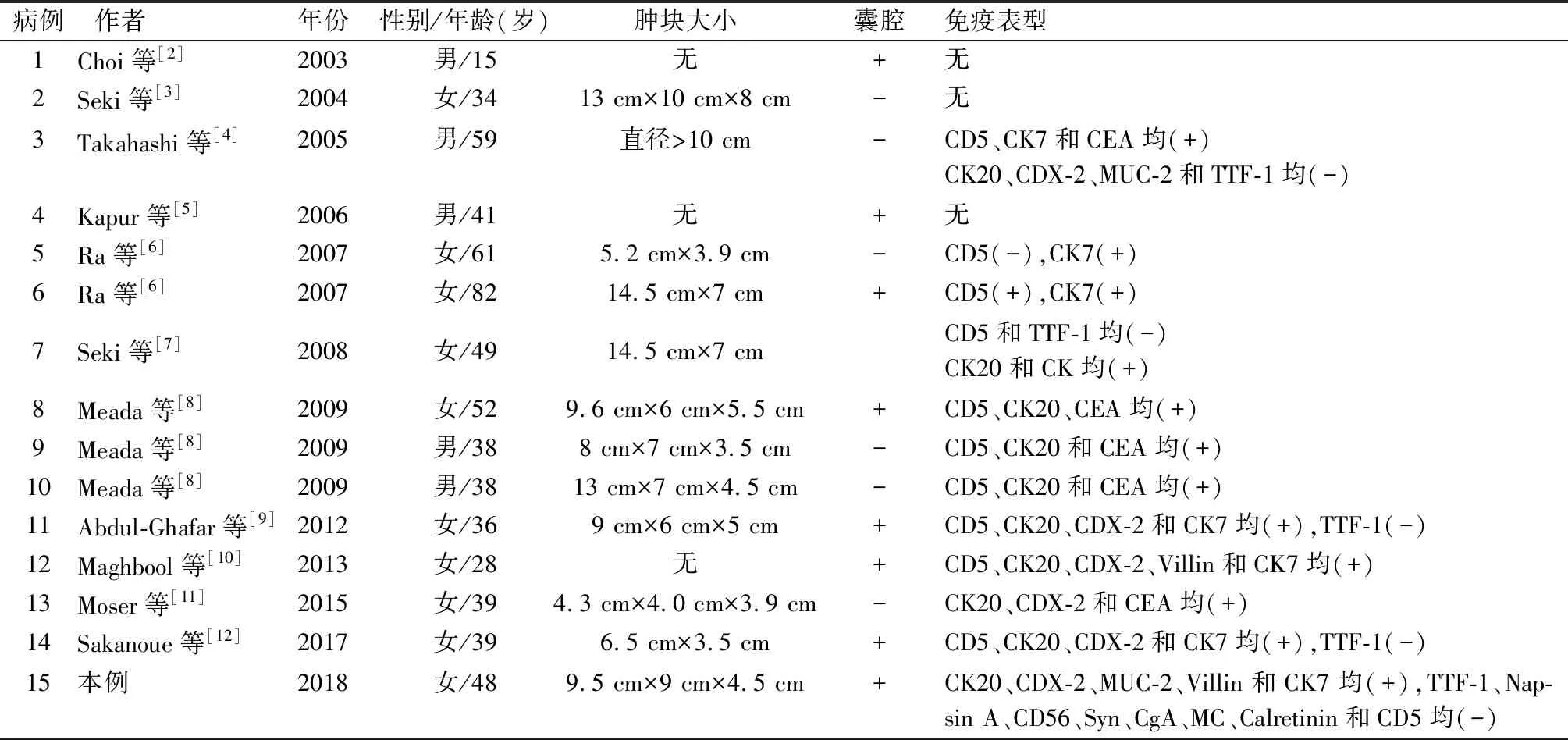
表1 15例胸腺黏液腺癌的临床病理学特征

图1 镜下见多量黏液背景,细胞为立方状、柱状,呈腺泡状、乳头状及筛状结构排列 图2 良性上皮逐渐移行为异型上皮,形成复层、腺管样结构 图3 肿瘤周边残留胸腺组织 图4 肿瘤细胞CK7呈阳性,SP法 图5 肿瘤细胞CK20呈阳性,SP法 图6 肿瘤细胞CDX-2呈阳性,SP法
组织学特点类似于其他部位的黏液癌,多量黏液背景下可见肿瘤性上皮细胞巢,细胞呈立方状、柱状,呈腺泡状、乳头状及筛状结构排列,周边可见残留的胸腺组织。文献报道约1/3的胸腺癌起源于胸腺囊肿尤其是多房性胸腺囊肿[2,15],本文总结15例胸腺黏液腺癌中有8例明确提示有囊腔(包括本例),并见囊腔良性上皮与腺癌直接移行,与文献报道一致,这也是胸腺原发性黏液腺癌最直接的依据。
CD5一直被认为是支持胸腺起源的有力证据,在鳞状细胞癌中敏感性高,可达90%。Maghbool等[10]报道CD5在胸腺癌中的阳性率为67%,本组总结11例胸腺黏液腺癌有8例表达CD5(72%),3例不表达(包括本例)。本例也不表达TTF-1和Napsin A,这两个抗体是公认的肺源性肿瘤的标志物,之前报道的胸腺黏液腺癌也不表达TTF-1。CK20和CDX-2为肠分化标志物,本文总结15例胸腺黏液腺癌中(包括本例)有10例行CK20检测,其中有9例阳性(90%);6例检测CDX-2有5例阳性(83%),本例CK20、CDX-2均阳性。Moser等[11]报道1例胸腺黏液腺癌同时表达CK20、CDX-2,并总结43例胸腺癌报道,其中有11例具有肠型分化特点,从而认为肠型分化腺癌可作为胸腺癌新的亚型。Kwon等[16]总结25例胸腺黏液腺癌及腺癌,非特殊类型,发现具有肠型分化者预后更差。
目前胸腺黏液腺癌尚无特异性指标可显示其胸腺源性,胸腺原发性黏液腺癌是一种排除性诊断,需符合以下3个标准才能诊断胸腺原发癌。(1)肿块大部分位于胸腺区(前纵隔);(2)肿块周围有残余胸腺组织;(3)身体其它部位无原发肿块。本例肿块位于前纵隔,肿块周围可见残余的胸腺组织,且影像学提示肺部、乳腺、女性生殖系统等均未见明显异常,消化内镜检查示胃肠道未见肿块,故排除其他部位黏液腺癌转移。同时,还需与一些纵隔原发肿瘤鉴别。(1)黏液表皮样癌:黏液性肿瘤细胞为多角形、柱状或杯状,呈实性团块或内衬囊肿,除黏液性细胞外还可见实性分布的鳞状上皮细胞和弥散分布的中间型细胞,利用组织学特点即可排除该病。(2)黏液性类癌:属于Alcian蓝阳性染色黏液样基质的罕见类癌亚型,肿瘤直径常较大(>8 cm),可有局灶性的典型类癌成分,如细胞呈带状(小梁状)、实性巢状、菊形团、腺体样结构。本例结构有部分相似之处,但CD56、Syn、CgA均阴性,排除该病。(3)上皮型间皮瘤(管状乳头状变型):最常见的上皮性间皮瘤变型,瘤细胞呈管状和乳头状排列,部分病例还可见梁状排列和类似腺癌的腺腔结构,肿瘤的间质呈黏液样、纤维黏液样或致密纤维化,组织学结构与黏液腺癌有较多类似,本例MC、Calretinin均阴性,故排除该病。
目前胸腺黏液腺癌尚无最佳治疗方案,治疗仍以手术根治性切除为主,术后辅以放、化疗。胸腺原发腺癌生存期4个月~10年不等,中位生存期24.9个月,5年生存率42.3%[17]。肿瘤的组织学分级、临床分期和肿瘤是否完整切除是影响患者预后的重要因素。本文总结胸腺黏液腺癌的生存期为11~34个月,本例随访16个月,暂未发现复发及其它转移性病灶。
本例结合发生部位、大体形态、组织学特征、免疫表型,并排除其他部位黏液腺癌转移,诊断为胸腺原发性黏液腺癌。该病临床罕见,应结合临床资料、影像学检查和病理学检查,以作出正确诊断,并及时处理。已有研究者检测胸腺黏液腺癌有KRAS基因突变,但未检测到EGFR基因突变及EML4-ALK融合基因,提示胸腺黏液腺癌存在与肺腺癌类似的基因突变[12]。随着医学的不断进步,对该肿瘤将有更深入的认识。
