三阴型乳腺癌分子分型的新进展
2020-04-20李雅全慕逢春王路晶张燕妮于炳洋平轶芳
刘 雪,李雅全,慕逢春,王路晶,张燕妮,于炳洋,平轶芳
乳腺癌是女性最为常见的恶性肿瘤,其病死率位居女性恶性肿瘤病死率的第二位,严重威胁女性健康[1]。三阴型乳腺癌(triple negative breast cancer, TNBC)是乳腺癌的重要临床亚型之一,占乳腺癌的15%~20%。与其他激素受体阳性或HER-2阳性乳腺癌相比,TNBC具有生长速度快,易侵袭、转移、治疗效果差、无瘤生存率和总生存率较低等特点。目前,靶向治疗在TNBC中的治疗效果并不乐观,化疗仍然是临床治疗TNBC标准方案。尽管许多早期TNBC患者可用化疗治愈,但对于肿瘤具有侵袭性的患者,使用现有治疗方案的中位总生存期(overall survival, OS)为13~18个月[2]。因此,深入剖析TNBC异质性及将TNBC再度细分为不同亚型,探讨精准治疗新方案十分重要。
1 乳腺癌分子分型
2000年,美国斯坦福大学的Perou等[3]对8 102个基因表达谱差异提出乳腺癌分子分型的概念,首次将乳腺癌分为Luminal-like型、HER-2阳性型、Basal-like型及正常乳腺样型。2001年Sorlie等[4]根据85种基因表达差异将Luminal-like型乳腺癌进一步分为Luminal A 型和Luminal B型,并指出不同亚型的乳腺癌与预后显著相关:Luminal A型预后最好,Luminal B型预后次之,HER-2阳性型和Basal-like型预后最差。此后,PAM50[5]、21-基因复发分数[6]及70-基因预后分型[7]等关于乳腺癌分子分型相关分析层出不穷,均为乳腺肿瘤异质性及患者精准治疗提供重要依据。为进一步规范乳腺癌分子分型标准,2011年St. Gallen国际乳腺癌研讨会上专家达成共识,将乳腺癌分为Luminal A型、Luminal B型、HER-2阳性型、 TNBC型等临床亚型。Ki-67增殖指数(Cutoff值=14%)用于区分Luminal A型(<14%)和Luminal B型(≥14%)。2013年St. Gallen国际乳腺癌会议上,专家组根据患者实际临床治疗获益情况重新定义Ki-67的Cutoff值,将Luminal A型和Luminal B型区分值由14%增至20%。除Ki-67外,还有部分专家提出将PR≥20%作为Luminal A和Luminal B型乳腺癌的区分值(图1)。该阈值的设定,直接影响Luminal A和Luminal B型乳腺癌的比例,引起治疗策略的进一步调整。目前,该标准沿用至今。

图1 乳腺癌分子亚型与治疗方案
乳腺癌的分子亚型对患者个体化治疗具有重要意义[8]。Luminal A型乳腺癌因为激素受体呈阳性,所以治疗方案首选内分泌治疗。可根据测序结果适时选择是否化疗。Luminal B型乳腺癌治疗方案根据4种标志物的表达常选用内分泌治疗联合化疗或抗HER-2治疗。最新研究发现[9],Luminal A型乳腺癌经他莫昔芬治疗可以有效降低肿瘤长期转移风险,患者可从他莫昔芬治疗中获益15年(HR=0.57,95%CI=0.35~0.94);而Luminal B型乳腺癌具有早期远处转移风险,他莫昔芬治疗随着时间延长抑制转移的能力逐渐变弱,患者可从他莫昔芬治疗中获益5年(HR=0.38,95%CI=0.24~0.59)。Luminal B型患者与Luminal A型相比,具有较差的预后及更高的转移复发风险。HER-2阳性乳腺癌预后较差且易转移,而靶向药物曲妥珠单抗(Herceptin)和拉帕替尼(Lapatinib)为患者的治疗带来新的转机。TNBC同样是预后较差的乳腺癌亚型,因其缺乏有效治疗靶点(激素受体和HER-2均阴性),临床治疗仍以化疗为主。Basal-like型与TNBC在组织形态、免疫表型及临床表现等虽大致相似,但两者并非完全重叠,50%~70%的TNBC具有Basal-like表型,约20%的Basal-like型乳腺癌无TNBC的特征。此外,Basal-like型是通过基因表达进行的分类,而TNBC则通常根据免疫表型进行的分类。因临床通常应用免疫组化法进行乳腺癌亚型分类,故使用TNBC代表这一特殊亚型。
2 TNBC概况
TNBC是指ER、PR、HER-2均阴性的乳腺癌亚型,具有恶性程度高、预后差,易在疾病早期复发转移等特点。因缺乏特定的靶点,目前尚无特效治疗方案,故临床称之为“难治性乳腺癌”。Perou等[3]通过基因表达谱分析发现与TNBC特征相似的Basal-like亚群。Karaayvaz等[10]对6例乳腺癌患者1 500多个细胞进行单细胞RNA测序(scRNA-seq),结果发现每例肿瘤的基因表达谱间均存在显著异质性,推测与肿瘤不同亚克隆基因组拷贝数的改变相关。结果表明:TNBC是一类具有高度异质性的乳腺癌亚型。TNBC的标准治疗以化疗为主,靶向治疗及免疫治疗正在不断探索中。目前,对TNBC的靶向治疗研究主要为DNA修复的靶向治疗[11]、酪氨酸激酶抑制的靶向治疗[12]、PI3K/AKT/mTOR通路抑制剂的靶向治疗[13]以及丝-苏氨酸蛋白激酶相关靶向药物[14]。关于免疫治疗研究最多为PD1拮抗剂(Pembrolizumab)[15]及PD-L1单克隆抗体(Atezolizumab)[16]等免疫检查点抑制剂(ICPI),在TNBC治疗中的应用及探索。
3 TNBC分子分型发展史
2011年Lehmann等[17]对来自21个公共数据库中587例TNBC患者基因表达(GE)谱进行聚类分析,发现TNBC在基因表达层面上是一组混合型乳腺癌,可以细分为6个分子亚型:基底样-1型(basal-like-1, BL-1)、基底样-2型(basal-like-2, BL-2)、免疫调节型(immunomodulatory, IM)、间质型(mesenchymal, M)、间质干细胞型(mesenchymal stem-like, MSL)及雄激素受体型(luminal androgen receptor, LAR)。同时,Lehmann等根据TNBC患者肿瘤的GE分析还发现TNBC各亚型所对应的乳腺癌细胞系(图2):BL-1型常见的细胞系有HCC38、HCC1143、HCC1599、HCC1937、HCC2157和HCC3153;BL-2型所对应的细胞系有SUM149PT、CAL-851、HCC70、HDQ-P1和HCC1806;HCC1187和DU4475两种细胞系属于IM型;BT-549、CAL-51及CAL-120被鉴定为M型;我们最为熟知的MDA-MB-231和MDA-MB-436细胞系及MDA-MB-157、HS578T、SUM159PT细胞系归属于MSL型;MDA-MB-453、CAL-148及SUM185PE细胞系则属于LAR型。TNBC各型细胞系的分类汇总为精准探索TNBC基本特征、机制靶点及治疗策略等提供重要依据。在各亚型中,BL-1型和BL-2型的TNBC高表达细胞周期和DNA损伤相关基因,该型代表性细胞系对顺铂类化疗药物敏感。M型和MSL型的TNBC与EMT及生长因子信号通路调控密切相关,细胞模型对PI3K/mTOR抑制剂(NVP-BEZ235)及abl/src抑制剂(Dasatinib)高度敏感。LAR型患者预后差,与雄激素受体信号通路关系密切,此型细胞系对比卡鲁胺(AR抑制剂)特异性敏感。IM型:主要涉及免疫过程多个方面,包括免疫细胞信号转导、细胞因子信号调控及核心免疫信号转导等途径,该型患者或将从免疫治疗中获益。2016年,Lehmann等[18]通过组织病理学定量技术和激光显微切割技术分析发现,先前定义的IM和MSL两种TNBC亚型中的转录物分别来自浸润淋巴细胞和肿瘤相关基质细胞,因此将TNBC分子亚型由之前定义的6种更改为4种:即BL-1型、BL-2型、M型和LAR型。同时,发现各种亚型在发病年龄、组织分级、局部和远处疾病进展等多方面均存在显著异质性。
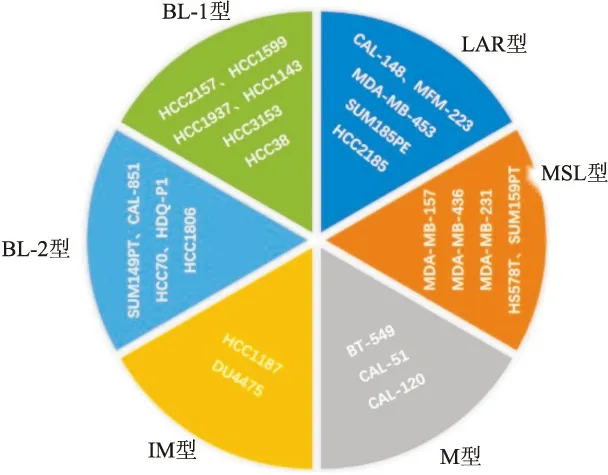
图2 Lehmann六亚型对应细胞系
2015年Burstein等[19]通过对198例TNBC肿瘤组织进行全基因组分析确定4种TNBC亚型:即LAR型、间质型(mesenchymal, MES)、基底样免疫抑制型(basal-like immune-suppressed, BLIS)、基底样免疫激活型(basal-like immune-activated, BLIA);并指出BLIS型TNBC的预后差,而BLIA型TNBC预后好(P<0.05)。同年,另有TNBC三分型的研究[20],将TNBC分为腔内雄激素受体型(C1型,22%)、低免疫应答和高M2样巨噬细胞基底样型(C2型,45%)以及高免疫反应和低M2样巨噬细胞基底富含型(C3型,33%)。
2016年Liu等[21]收集复旦大学上海肿瘤医院165例TNBC进行全转录组学分析,提出四分型的观点,简称“复旦分型”包括:IM、MES、LAR以及BLIS型。在“复旦分型”中,IM型和MES型预后较好。LAR型患者预后比IM、MES型预后略差。BLIS是预后较差的亚型。各亚型特点如下:(1)IM型主要激活的通路为免疫调节通路,包括细胞因子受体相互作用信号通路、TCR/BCR信号通路及NF-κB信号通路等。CXCL10/CXCL11/CXCL13/CCR2等是该型重要的分子标志物,该型功能角色与免疫密切相关。(2)MES型主要介导细胞外基质(extracellular matrix, ECM)-受体信号、局部黏附及转化生长因子-β(transforming growth factor-β, TGF-β)等信号通路调控,MES型与增殖相关基因表达呈负相关,可能是该型预后较好的主要原因。(3)LAR型:主要激活AR、ER及ERBB4等激素相关的信号通路,结果提示患者将对抗-AR及传统的抗-ER治疗敏感。(4)BLIS型主要参与细胞分裂及细胞周期通路的激活,增殖相关的基因(如CENPF、BUB1、PRC1)在此型中富集表达。参与免疫调节的基因存在广泛下调(如参与免疫反应和先天免疫反应及免疫细胞信号通路的基因等)。高增殖性及免疫抑制是该型的重要特点,是导致患者预后较差的重要原因。“复旦分型”让我们重新认识中国TNBC的分子特征,极大程度促进中国TNBC精准治疗及靶向治疗发展,对于预后差的亚型患者或将从更强的化疗方案中获益。此外,该团队针对全球最大的单中心465例中国TNBC多组学队列进行基因组和转录组学数据分析,2019年Jiang等[22]再度证实“复旦四分型”的准确性,揭示TNBC不同分型中的特异性分子靶标,并提供分子分型的精准治疗依据:(1)在IM亚型中,具有较高的免疫原性,肿瘤浸润淋巴细胞增多,免疫检查点分子高表达,故免疫检查点抑制剂为其有效治疗方案。(2)在MES亚型中,常伴随乳腺癌干细胞相关通路(如STAT3通路)显著激活,抗肿瘤干细胞治疗可以使该型患者受益。(3)在LAR亚型中,HER-2突变率明显高于其它各亚型,且处于激活状态,提示抗HER-2治疗潜在敏感性。同时,因LAR亚型中细胞周期激活模式与其它亚型不同,提示细胞周期相关的靶向治疗潜在的优势,其代表性药物为CDK4/6抑制剂。因此,针对LAR亚型患者,抗HER-2治疗和CDK4/6抑制剂治疗将成为其有效治疗方案。(4)BLIS型预后差,同时发现BRCA1/2突变率极高,因此治疗主要为铂类及PARP抑制剂治疗。
此外,2018年He等[23]根据4个公开的TNBC基因组数据集将TNBC按免疫表达谱分为3个亚型,即免疫高表达型(immunity high, IH)、免疫中表达型(immunity medium, IM)和免疫低表达型(immunity low, IL)。IH具有更多的免疫细胞浸润和更强的抗肿瘤免疫活性,与其它亚型相比预后较好。该型TNBC与多种肿瘤相关信号通路相关,可以激活凋亡、MAPK、PI3K/Akt及RAS等信号通路。IL免疫信号较弱,主要参与细胞周期、DNA复制、细胞黏附等多肿瘤发展过程。
2019年,Andrade等[24]对185例TNBC患者miRNA表达谱进行分析,根据4种预后相关miRNA表达(miR-221、miR-1305、miR-4708及RMDN2)将TNBC分为高风险组和低风险组。该分型为评估TNBC预后提供有效依据。
4 讨论
TNBC是一种极具异质性的乳腺癌分子亚型,大量研究发现TNBC不仅仅是单一的乳腺癌类型,其亦可再被细分为多种亚型。通过分析TNBC亚型的研究进展,不难发现各种分型之间有相似性,即不同程度的围绕“免疫”、“间质”、“基底”及“雄激素受体”等关键方面展开分型。例如无论是Lehmann六分型或四分型、还是Burstein四分型及“复旦分型”,均存在LAR相关亚型,2015年TNBC三分型中C1亚型也同属于腔内雄激素受体型。对于这类亚型的患者,均建议行AR拮抗剂的治疗方案。同时研究发现,对于“免疫”相关的各种亚型患者,免疫高表达或激活型均具有较好的预后,这可能是由于该型患者激活相关的免疫调节分子和相关信号通路而引起的抑制肿瘤发生、发展的作用。相反,在Burstein和“复旦分型”两种分型中,无论研究对象是欧美还是亚洲人群,免疫抑制型BLIS亚型的预后均显著低于其它各型。因此,在临床上区分TNBC免疫表达特点对于患者预后评估尤为重要。治疗上,免疫高表达患者可能从免疫检查点抑制剂的使用中获益。虽然有些亚型分类名称并未展示以上全部分类特征,但本质上还有一定的交叉共性,如2018年三分类(IH、IM、IL)是根据“免疫”特征进行分类;2016两分类(高风险组和低风险组)是根据预后进行分类;2015三分类(C1、C2、C3型)中,不同程度的展示 “免疫”、“雄激素受体”等特征。由此TNBC不同亚型的不分地域、不分种族的普遍存在,这也是解释TNBC异质性的强有力证据。
TNBC不同亚型间存在一定的预后差异性、调控机制多样性、治疗靶点不同性等特点。这可能是TNBC治疗效果较差的主要原因。Lehmann 六分型是最早被提出的TNBC分型标准,一直以来受广大学者的肯定和借鉴。Lehmann团队也一直致力于不断优化精准TNBC分型标准。2016年Lehmann团队将先前Lehmann六分型重新定义为Lehmann四分型,揭示IM型和MSL型具有类似的细胞特征,将两者并入M型。同时补充4种亚型的不同临床特征:LAR型肿瘤具有更强的局部扩散和骨转移的特点,M型肿瘤则更倾向于发生肺转移。此外,TNBC的亚型与肿瘤组织学类型显著相关,乳腺小叶癌主要见于LAR亚型,而乳腺化生性癌既可以是M型亦可为BL-2型。Lehmann新分型补充不同亚型与肿瘤生物学行为及组织类型的关系,极大程度的帮助临床医师预测不同类型乳腺癌患者预后及组织特征。Burstein分型中BLIS亚型可独立表达多种SOX家族转录因子,提示针对肿瘤干性进行治疗或许是行之有效的治疗方案。邵志敏团队研究发现,BLIS亚型中BRCA1/2突变率极高,故该型推荐铂类及PARP抑制剂治疗。同时邵志敏团队发现另一重要现象:在中国TNBC人群中,第22号染色体q11位置的PIK3CA基因突变率和拷贝数均高于欧美国家,提示亚洲地区TNBC的某些特征将独立于欧美国家,有望成为中国TNBC患者特有的治疗靶点。
国内外学者基于不同的检测手段及目的将TNBC细分为多种分子亚型,不同亚型具有不同的生物学特性及信号调控通路,为TNBC高度异质性提供有力的证据,为TNBC的精准治疗提供坚实的基础。然而,目前TNBC分子分型尚无统一标准。在诸多三阴型乳腺癌分子亚型中,应关注每种亚型对应的临床意义及治疗策略。在实际工作中,由于基因检测、表达谱分析等均十分昂贵,目前在临床工作中较难开展。因此探索与表达谱分型高度吻合的免疫组化指标成为下一步的工作重点。在今后不断进展的三阴型乳腺癌分子分型的研究中,重视不同亚型的调控机制及靶向治疗将成为TNBC分子分型具有重要意义。
5 展望
精准治疗是TNBC未来临床治疗的重要发展方向,虽已有重要进展,但仍存在较多困难。例如其具有受益人群小、总体有效率低、缺乏有效的生物学标志物及治疗成本高等特点。因此发展以分子分型为基础的TNBC精准治疗,才能更好的开发新型有效的靶向药物,才能为TNBC的个体化治疗带来新的希望。
