子宫内膜癌TCGA分子检测分型的进展
2020-04-20段亚伟张丽华
段亚伟,张丽华
根据世界卫生组织/国际癌症中心的统计显示:2018年美国子宫癌的发病率为8.4人/10万;根据美国癌症学会预计,2019年美国子宫癌新发患者约61 880例,死亡患者12 160例[1]。近年研究表明,随着人们寿命的延长、性激素药物的使用以及肥胖等高风险因素的增加,子宫内膜癌的发病率呈上升趋势,但是子宫内膜癌的治疗并未取得新的进展。
目前随着对子宫内膜癌分子遗传学认识的不断深入,发现子宫内膜癌是生物学、临床特征、组织学特征和遗传学特征均存在显著异质性的一组肿瘤;而传统的子宫内膜癌分类不能完全体现肿瘤异质性。因此,对于患者的预后、治疗反应的效果预测等有一定的局限性。近年有关子宫内膜癌的分类提出一些新问题,促使子宫内膜癌的分型和治疗及预后的关系成为当前研究的热点,本文现对子宫内膜癌不同分型系统和进展进行综述。
1 组织学分型与传统分型
WHO(2014)女性生殖器官肿瘤组织学分类将子宫内膜癌按照形态学特征分为子宫内膜样癌、黏液性癌、子宫内膜浆液性上皮内癌、浆液性癌、透明细胞癌、神经内分泌肿瘤、混合细胞癌、去分化癌和未分化癌。最常见类型为子宫内膜样癌、浆液性癌和透明细胞癌。Bokhman Ⅰ型子宫内膜癌主要对应子宫内膜样癌,通常表现为惰性的临床行为,预后较好;Bokhman Ⅱ型子宫内膜癌主要为浆液性癌和透明细胞癌,通常表现为侵袭性的临床行为,预后较差[2]。WHO(2014)女性生殖器官肿瘤组织学分类提示组织学类型和患者预后相关性良好,但是对子宫内膜癌进行分类时,观察者间仍存在较大差异,特别是在高级别癌形态学模糊时,组织学诊断一致性仅有中等水平。尽管形态学分类存在主观性,但仍然是子宫内膜癌的主流分类方法。
2 免疫组化标志物在子宫内膜癌分型中的应用
免疫组化标志物的应用对于辅助组织学分类具有重要的价值。应用p53和PTEN等免疫组化标记可以鉴别子宫内膜样癌和浆液性癌,通常子宫内膜样癌激素受体(ER、PR)阳性,PTEN表达丢失;浆液性癌呈p53突变型,p16呈弥漫强阳性;透明细胞癌较为特异的标志物为Napsin A和HNF-1β,且两种标志物呈中度至强阳性。去分化及未分化癌中PAX8、ER、INI1和BRG1常呈阴性,p53呈野生型(斑驳阳性)。
新近研究发现L1CAM高表达提示其与晚期、高级别子宫内膜样癌及淋巴结转移相关,与HER-2的表达互斥[3],L1CAM高表达与TP53突变存在较强的相关性,是预后较差的独立预测因素[4]。对于子宫透明细胞癌,L1CAM的高表达提示其可能是透明细胞癌的发生机制之一,并且与预后相关,但仍需大量实验进一步验证[5]。此外,HIF-1α、PHD2的表达与子宫内膜腺癌的发生、发展密切相关[6]。
然而,没有单一标记是完全敏感或特异的。2017年国外研究小组提出 “antibody panel”,但其最终组成及染色模式解读未达成一致意见[7]。
3 基因突变在子宫内膜癌分型中的应用
子宫内膜癌中单基因突变的研究可能有助于形态学的分类。CTNNB1基因突变常发生于66%的低级别肿瘤。ARID1A基因突变发生于40%~46.7%的低级别肿瘤和60%的高级别肿瘤,发生于1/4以上的透明细胞癌,罕见于浆液性癌,是子宫内膜癌的早期事件[8]。PTEN基因突变常见于子宫内膜样癌及透明细胞癌,但很少见于浆液性癌。PPP2R1A错义突变发生于41%以上的浆液性癌中,而在子宫内膜样癌突变率不足5%[9]。虽然这些单基因突变在子宫内膜样癌和浆液性癌的蛋白表达和突变谱上差异有显著性,但也有较大的重叠,例如PIK3CA突变存在于52%的子宫内膜样癌和42%的浆液性癌中。TP53突变约占浆液性癌的75%,而在多达12%的子宫内膜样肿瘤中也有此突变,因此依靠单基因突变辅助子宫内膜癌分类仍然存在挑战。
4 子宫内膜癌分子分型进展
4.1 TCGA分子分型2013年子宫内膜癌美国癌症基因组图研究中心对子宫内膜癌的分类提供革命性的见解,根据整合基因组特点,TCGA将子宫内膜癌重新分为4种不同的类型[10-11],其分别具有不同的预后,该分类为临床治疗和预后判断提供更准确的信息,子宫内膜癌的分子分型拉开序幕。
TCGA对373例子宫内膜癌患者(其中包括307例子宫内膜样癌、66例浆液性癌和混合性癌)进行整合基因组、转录组学和蛋白质组学表征的研究,基于突变谱、拷贝数改变、微卫星不稳定性综合数据将子宫内膜癌分为4类。(1)POLE基因突变型:具有很高突变率的“超突变”肿瘤,均含有聚合酶epsilon(POLE)基因核酸外切酶域突变,C→A碱基转换频率增加,具有PTEN、PIK3R1、PIK3CA、FBXW7和KRAS等突变,预后较好;(2)微卫星不稳定超突变型(microsatellite instability-hyper mutated, MSI-H):“超突变型(hyper mutated)”肿瘤具有突变率高、拷贝数低的特点;常具有KRAS和PTEN突变;(3)低拷贝数型(copy number abnormalities low, CN-L):大部分是微卫星稳定、突变率低、具有频繁CTNNB1基因突变的1和2级子宫内膜样癌;(4)高拷贝数型(copy number abnormalities high, CN-H):具有较多拷贝数改变,突变率低,频繁TP53、FBXW7和PPP2R1A突变,较少有PTEN和K-RAS突变,并且预后较差。4种类型中,POLE基因突变型通常具有高的组织学分级,但预后好,患者通常无疾病进展[12];其次是MSI-H型,最差的是CN-H型,而CN-L型的预后界于CN-H与MSI-H组之间[11,13]。研究发现,CN-H包含研究中的所有浆液性癌和25%的FIGO 3级子宫内膜样癌。这些结果表明,在对子宫内膜癌的分型诊断中,鉴别CN-H型与POLE基因突变型和MSI-H型具有非常重要的意义[14]。
TCGA对子宫内膜样癌和浆液性癌的重新分类能更好的反应预后及提高诊断的一致性,但这项研究也存在一定的临床局限性。首先,它只研究子宫内膜样癌、浆液性癌和混合癌,其他非子宫内膜癌,如癌肉瘤和透明细胞癌的分子分型尚待分析;其次,TCGA检测方法费用高,诊刮标本和手术切除标本检测结果不能很好与之对应[15],因此在外科手术之前无法进行该分类;找出能够准确反映分子亚型的标志物是克服这一障碍的可行途径。
由于POLE基因突变型与良好的预后及免疫治疗相关[12-13,16-18],因此TCGA分子分型的研究发表后,国外研究组的兴趣主要集中于POLE基因突变型肿瘤的研究,同时寻找适用于临床的检测法替代繁琐而高昂的TCGA法,以期将TCGA分类应用于临床[19-20]。
4.2 TCGA的替代检测方法目前分子分类器是研究最多的替代检测方法[19,21],应用免疫组化和分子检测手段,分别对4种类型的肿瘤进行检测。POLE基因突变型检测方法:(1)单独对POLE 9和13号外显子进行一代测序,分析其突变;(2)同时检测POLE基因突变情况和PTEN突变状态(PTEN免疫组化染色有无丢失),尽管PTEN突变在MSI和CN-L中部分存在,但是PTEN突变和POLE突变同时发生的情况更常见于POLE型。MSI-H检测:使用MMR 免疫组化(mlh1、msh2、msh6和pms2)的替代检测方法,并且已证明该方法与MSI分析[22]结果高度一致,更具成本效益和实用性。CN型子宫内膜癌检测方法:TP53突变(p53免疫表型)检测确定CN-H组;均不具备其他3型特点时,归于CN-L型。POLE基因突变型检测与MSI-H型检测无先后顺序,但是一定在检测CN型之前。也有学者建议首先进行POLE基因突变型检测,因为MSI及TP53突变可能是POLE突变后的继发改变(图1)。应用上述方法,Talhouk等对143例子宫内膜癌患者进行分类,结果发现:143例子宫内膜癌中,POLE基因突变型占9%、MSI-H占32%、CN-L占18%、CN-H/浆液样占39%。在多变量分析中,分子分类和临床风险分组与预后相关。作者认为这种方法有可能在福尔马林固定的石蜡包埋中被常规应用,并得到与TCGA通过整合基因组特征分类相同的预后信息[19,21,23]。Ellen Stelloo小组也获得类似的结果,并强调增加CTNNB1突变检测以更好地确定CN-L型[17],并于2017年进一步提出1q32.1扩增的检测可有助于分子分型,但仍需要大量临床研究[24]。此外,Ellen Stelloo小组就肿瘤内异质性问题对分子分型检测方法可行性进行分析,得出结论:由于肿瘤内异质性使分子分型有10.2%的不准确率,通过选取有代表性的蜡块可降低该风险[25]。除上述两个研究小组的检测方法外,还有其他检测方式,虽与TCGA有所出入,但也有重叠,并且均得到与TCGA检测方法相似的预后[26-27]。
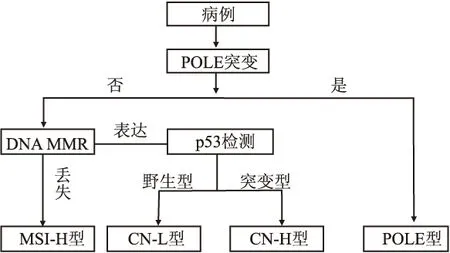
图1 TCGA分子分型替代检测方法示意图
综上所述,目前子宫内膜癌的分类已从单纯形态学分类到结合免疫表型和分子检测的分类,直至以分子遗传学特征进行TCGA分类,但由于各种分类方式均存在一定的局限性,因此仍然需要相互补充。TCGA分类方法有助于更好地定义3级子宫内膜癌和浆液性癌之间的灰色区域,有助于准确地对子宫内膜癌亚型分型,更好地预测患者的预后。但由于TCGA分类方法的复杂性和高昂的费用,寻求简便、低成本的可用于临床常规检测的替代方法,有可能成为未来子宫内膜癌分型的主流。
