辛伐他汀通过NFκ-B通路抑制破骨细胞的分化
2020-04-18于冬冬赵丹阳杨鸫祥杨关林
于冬冬,赵丹阳,杨鸫祥,杨关林
(1.辽宁中医药大学附属医院骨科,沈阳 110032;2.沈阳市第一人民医院神经内科,沈阳 110041;3.辽宁中医药大学附属医院中西医结合内科,沈阳 110032)
绝经后骨质疏松症(postmenopasal osteoporosis,PMOP)是最常见的原发性骨质疏松症。在PMOP的发病过程中,破骨细胞过度活化同时伴随过度骨吸收[1]。临床目前应用的防治PMOP药物都存在一定程度的不良反应,而且没有一种抗骨质疏松药物能够完全恢复丢失的骨量[2]。
他汀类药物是临床治疗高脂血症的常用药物[3]。研究[4]发现,他汀类药物影响破骨细胞的分化及骨吸收,但具体的作用机制尚不明确。本研究试图阐明辛伐他汀对破骨细胞分化调节及其潜在机制,为临床防治PMOP提供新思路及研究依据。
1 材料与方法
1.1 材料
1.1.1 细胞:小鼠单核/巨噬细胞RAW264.7(美国ATCC公司)。
1.1.2 试剂:辛伐他汀(Simvastatin,SIM,美国Sigma公司。溶于无水乙醇,储存浓度10-2mol/L,-20℃保存);重组人可溶性RNAK配体(recombinant human soluble RANK Ligand,sRANKL,美国Peprotech公司);重组人巨噬细胞集落刺激因子(recombinant human macrophage colony stimulating factor,M-CSF,美国Peprotech公司);DMEM(美国Hychone公司);胎牛血清(美国Hychone公司);TRAP染色试剂盒(美国Sigma公司);核因子κB(nuclear factor kappa B,NF-κB)免疫荧光检测试剂盒(中国Beyotime公司);WST-1检测试剂盒(中国Beyotime公司);p65、p-p65一抗(美国Cell signaling公司);鬼笔环肽检测试剂(美国AAT BiBe Questy公司)。
1.1.3 仪器:细胞孵箱(美国Thermo公司);倒置相差显微镜(日本Olympus公司);免疫荧光显微镜(日本Olympus公司);流式细胞仪(美国BD公司);AMR-100酶标仪(中国杭州奥盛仪器有限公司)。
1.2 实验方法
1.2.1 小鼠单核/巨噬细胞RAW 264.7培养及诱导分化:RAW 264.7细胞在DMEM未分化培养基中培养(含10%胎牛血清、不含抗生素、37℃、5%CO2孵箱内培养,注意调节培养基的pH值,宁偏酸性勿碱性)。细胞接种于10 cm2培养板内,细胞传代可用胰酶,但一定要注意控制胰酶消化的时间。也可以用无菌枪头把细胞从贴壁的状态直接吹打成悬浮细胞。诱导分化培养基(DMEM、10%胎牛血清、15 ng/mL sRANKL、15 ng/mL M-CSF)继续培养7 d。
1.2.2 WST-1检测细胞增殖活性:研究分为对照组、10-5~10-9mol/L的SIM组。细胞以5×103/孔平铺于96孔平板中,24 h后更换诱导分化培养基,诱导培养基培养7 d后,细胞经SIM处理3、12、24、48 h,每孔加20 μL WST-1检测剂。在孵箱中孵育1 h。450 nm读取吸光度值。光密度(optical delnsity,OD)值=(处理后细胞OD值-对照组细胞OD值/N),n> 3。
1.2.3 TRAP染色检测破骨细胞分化:诱导分化培养基中加入不同浓度的sRANKL+M-SCF(0、5 ng/mL、15 ng/mL、50 ng/mL)诱导分化 7 d。TRAP染色根据Sigma试剂盒进行操作。分析SIM对成骨细胞分化影响的分析共分5组,分别为A组(对照组)、B组(sRANKL+M-SCF组)、C组(SIM+sRANKL+M-SCF组)、D组(PDTC+sRANKL+M-CSF)、E组(SIM+PDTC+sRANKL+M-CSF)。RAW264.7细胞(5×104/孔)在24孔板内培养,在含和不含SIM(10-6mol/L)的条件下进行诱导分化培养及药物干预。
1.2.4 肌动蛋白检测破骨细胞吸收活性:吸收活性检测分为4组。A组(对照组)、B组(sRANKL+MSCF组)、C组(SIM+sRANKL+M-SCF组)和D组(PDTC+sRANKL+M-CSF组)。RAW264.7细胞(5×104细胞/孔)在24孔板内培养,在含和不含SIM(10-6mol/L)的条件下诱导分化7 d。用免疫固定液在室温下固定15 min,用免疫洗涤液(含0.1%的Triton X-100)在冰上冲洗3 min后,用鬼笔环肽检测试剂染色40 min,用DAPI溶液染色细胞核5 min。使用共焦显微镜拍照。使用滤光器鬼笔环肽检测试剂(激发:492 nm;发射:518 nm)。
1.2.5 免疫荧光检测NF-κB核转位:免疫荧光检测共分为4组。A组(对照组)、B组(sRANKL+M-SCF组)、C组(SIM+sRANKL+M-SCF组)、D组PDTC+sRANKL+M-CSF组。细胞在盖玻片上并培养过夜,在含和不含SIM(10-6mol/L)的条件下诱导分化7 d。细胞固定后,用p-p65抗体孵育细胞(以1 ∶400的比例稀释)过夜,用DAPI染色细胞核(5 min),免疫荧光显微镜检测。
1.2.6 Western blotting检测:分别用sRANKL+M-SCF和SIM+sRANKL+M-SCF进行处理。细胞在含和不含SIM(10-6mol/L)的条件下诱导分化7 d。提取蛋白,定量,上样,蛋白电泳,转膜,封闭,一抗孵育过夜,二抗标记,ECL发光法曝光成像。Image J软件测定平均灰度值,与内参值进行标准化后进行统计分析。
1.3 统计学分析
2 结果
2.1 SIM抑制RAW264.7细胞增殖活性
采用WST-1方法对RAW264.7细胞增殖活性进行检测,结果显示,SIM(10-5mol/L、10-6mol/L)均能抑制破骨细胞的增殖活性,但是SIM(10-6mol/L)作用24 h、48 h能稳定抑制RAW264.7细胞的增殖活性。因此,SIM(10-6mol/L)作用24 h作为实验用药浓度及作用时间。见表1。
2.2 破骨细胞的形态学观察
未分化的RAW264.7细胞呈圆形,透光度好,边界清晰。加入诱导液后,细胞触角逐渐增多,细胞略呈短梭形,细胞透光度下降,继而细胞融合成巨大的多核破骨细胞(细胞核数≥3)(B组破骨细胞数量44%±0.15%),加入SIM(C组破骨细胞数量18%±0.12%,P=0.004)及PDTC(D组破骨细胞数量33%±0.23%,P=0.034)后,破骨细胞的分化受到抑制,融合的破骨细胞数量明显减少,SIM+PDTC组(E组破骨细胞数量21%±0.12%,P=0.064)的作用效果与单独SIM组及PDTC相似。见图1。
表1 SIM对RAW264.7细胞增殖活性的影响(±s,n=6)Tab.1 Effect of SIM on RAW264.7 cell proliferation(±s,n=6)

表1 SIM对RAW264.7细胞增殖活性的影响(±s,n=6)Tab.1 Effect of SIM on RAW264.7 cell proliferation(±s,n=6)
1)compared with control group,P < 0.05.
2.3 TRAP染色检测破骨细胞分化
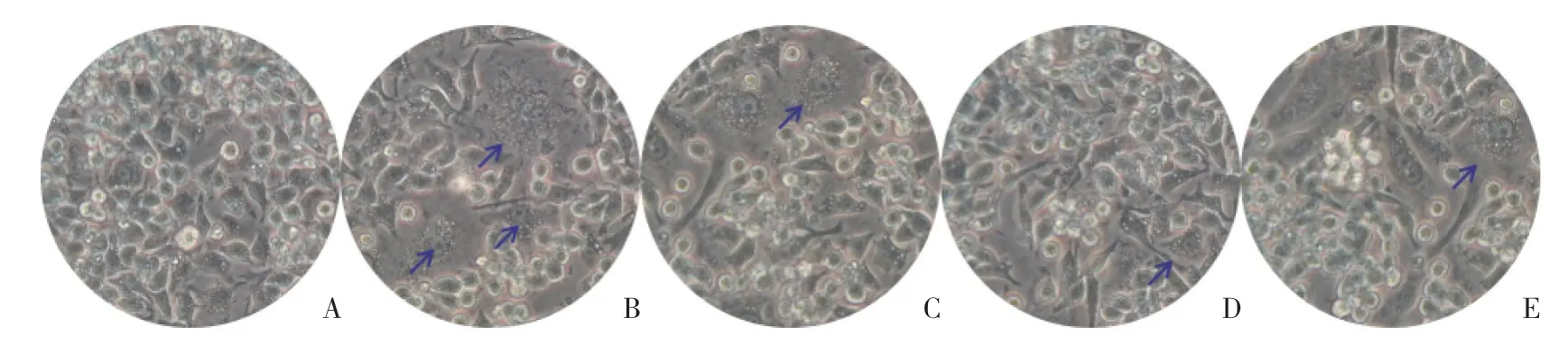
图1 SIM抑制破骨细胞形成 ×200Fig.1 SIM inhibited osteoclast formation ×200
TRAP检测不同浓度的sRANKL+M-CSF对破骨细胞分化的影响,RAW264.7细胞在不同浓度的sRANKL+M-CSF诱导分化7 d,结果按破骨细胞数(细胞核数≥3)/总细胞数来确定破骨细胞的分化效果。对照组没有破骨细胞分化,5 ng/mL 组为8%±0.15%,15 ng/mL 组为40%±1.5%,而50 ng/mL组为。其中,浓度为15 ng/mL组的sRANKL+M-CSF具有最大的诱导RAW264.7细胞向破骨细胞分化的效果。因此,将浓度为15 ng/mL的sRANKL+M-CSF诱导分化7 d作为本研究诱导分化的浓度及时间。见图2。
2.4 SIM抑制破骨细胞的分化
RAW264.7细胞在15 ng/mL的sRANKL+M-CSF诱导分化7 d,结果按破骨细胞数核细胞)/总细胞数确定破骨细胞的分化效果,在诱导分化培养基中单独加入SIM(10-6mol/L,C组破骨细胞数为18%±0.12%)及PDTC(10-5mol/L,D组破骨细胞数为35%±0.13%,B组破骨细胞数为48%±0.25%)和SIM+PDTC(20%±0.11%)的情况下,破骨细胞的分化受到抑制,SIM+PDTC组的一致分化效果与单独SIM组及PDTC相似(P> 0.05)。见图3。
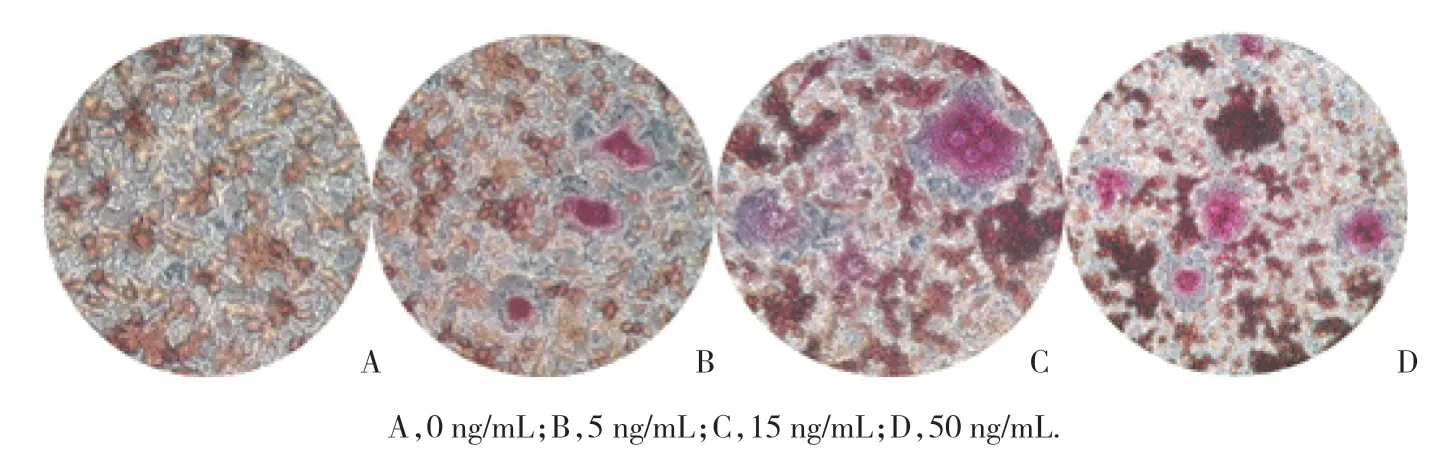
图2 不同浓度的sRANKL+M-CSF诱导破骨细胞分化 ×200Fig.2 Osteoclast differentiation induced by different concentrations of sRANKL+M-CSF ×200
2.5 SIM抑制破骨细胞肌动蛋白环的形成

图3 SIM抑制破骨细胞的分化 ×200Fig.3 SIM inhibits osteoclast differentiation ×200
用荧光显微镜检测肌动蛋白环,以观察成熟的破骨细胞肌动蛋白环的结构。sRANKL+M-CSF能够诱导明显诱导肌动蛋白环的形成(B组:41%±0.15%),SIM能够抑制肌动蛋白环的形成(C组:10%±0.08%),加入PDTC后的作用效果与SIM相似(D组:11%±0.13%)。见图4。
2.6 SIM抑制NF-κB的核转位
免疫荧光检测结果显示,破骨细胞分化后,p65向细胞核内转位,SIM能够抑制其向细胞核内转位。见图5。
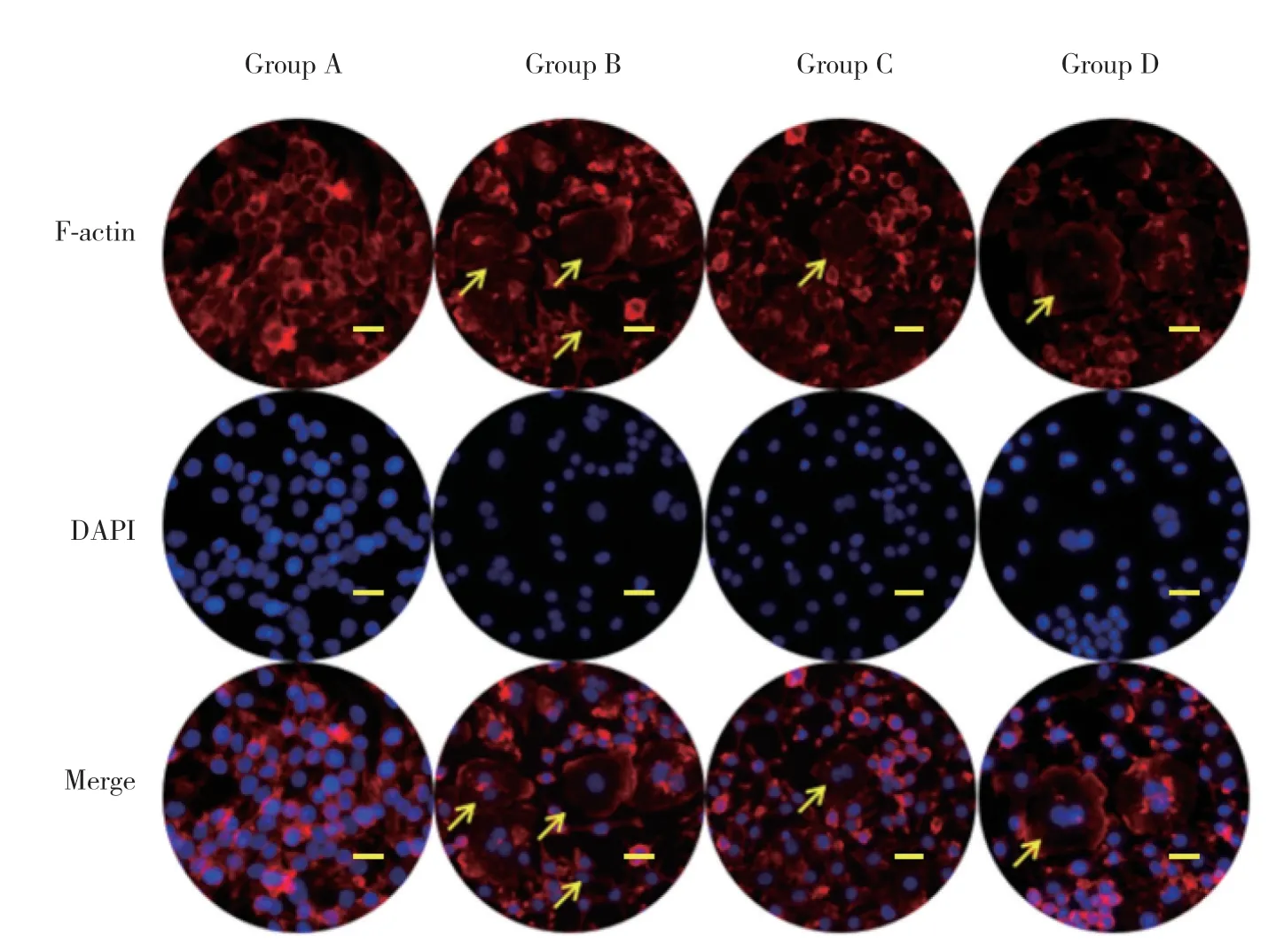
图4 SIM抑制破骨细胞肌动蛋白环的形成Fig.4 SIM inhibits actin ring formation in osteoclasts
2.7 Westerm blotting结果
进一步分析SIM抑制成骨细胞分化的潜在机制,免疫印迹检测通路蛋白显示,sRANKL+MCSF能促进细胞核内p65的磷酸化(0 min,5 min,30 min,60 min),尤以60 min时p65磷酸化明显,加入SIM后p65的细胞核内转位受到抑制,60 min时抑制效果明显,提示SIM发挥其抑制破骨细胞分化的药效学机制是通过抑制NF-κB信号通路完成的(P<0.05)。见图6。

图5 SIM抑制p65细胞核内转位Fig.5 SIM inhibits intranuclear translocation of p65 in cells

图6 SIM抑制p65磷酸化Fig.6 SIM inhibits p65 phosphorylation
3 讨论
PMOP与雌激素缺乏密切相关,具有骨质疏松症的一般特征,如骨小梁结构破坏和骨折风险增加[5]。研究[6-8]表明,雌激素能抑制破骨细胞的形成。在PMOP的发病过程中,过度激活破骨细胞形成和过度骨吸收是一个重要的因素,因此,抑制破骨细胞分化仍是PMOP治疗的一个重要策略。
他汀类药物具有抗血栓、抗氧化和抗炎和多效性的治疗作用。研究[9]表明,他汀类药物对骨骼具有一定的药理学作用。还有研究[10-11]表明,他汀类药物增加了卵巢切除的骨形成、抑制破骨细胞生成,但其潜在机制尚不清楚。
本研究揭示了辛伐他汀抑制破骨细胞分化的潜能,TRAP染色检测显示,辛伐他汀抑制sRANKL和M-CSF诱导的RAW264.7细胞向破骨细胞的形成和分化。破骨细胞形成过程中,细胞骨架重排导致肌动蛋白环的形成。这些肌动蛋白环在维持细胞结构中起着至关重要的作用[12]。F-肌动蛋白环检测结果表明,辛伐他汀能够抑制破骨细胞吸收活性,这对预防和治疗PMOP具有重要意义。
NF-κB信号通路是调节破骨细胞成熟、分化、凋亡的重要通路[13],进一步研究辛伐他汀发挥抑制破骨细胞分化的潜在机制。结果显示,辛伐他汀抑制NF-κB通路的核心蛋白p65的激活,抑制p65的细胞核内转位,进而抑制破骨细胞的分化。因此,本研究为临床应用辛伐他汀防治PMOP提供了依据。
