TMEM206促进表皮生长因子诱导的结直肠癌上皮-间质转化
2020-04-18郑启智赵劲博盛伟伟周建平董明
郑启智,赵劲博,盛伟伟,周建平,董明
(中国医科大学附属第一医院胃肠外科/疝外科,沈阳 110001)
结直肠癌是最常见的恶性肿瘤和癌症相关死亡原因之一,目前在全世界范围内其发病率和死亡率仍较高[1]。结直肠癌的发生、发展是一个多基因、多阶段、长期形成的复杂病变过程,局部侵袭和远处转移是导致结直肠癌患者死亡的最重要因素[2]。上皮-间质转化(epithelial-mesenchymal transition,EMT)被认为是影响结直肠癌侵袭、转移的重要作用机制之一。生长因子如转化生长因子β(transforming growth factor-β,TGF-β)、表皮生长因子(epidermal growth factor,EGF)等介导EMT的发生,同时TGF-β、Wnt、Notch等多种信号通路相互交错调控EMT的过程[3]。跨膜蛋白(transmembrane protein,TMEM)家族成员被证实在肿瘤发生、发展中起重要作用[4-5]。而本课题组前期研究[6]表明,TMEM206过表达可通过与AKT和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路相互作用,促进结直肠癌的恶性进展。本研究的目的是探讨TMEM206影响结直肠癌EMT的机制。
1 材料与方法
1.1 材料
人结直肠癌细胞系HCT116和SW480(中科院上海细胞库),TMEM206兔抗人多克隆抗体(英国Abcam公司),pCMV6、pCMV6-Myc-DDK-206(RC202838)(美国OriGene公司),Lipofectamine 3000(美国Invitrogen公司),PVDF膜(美国Millipore公司),p-ERK和c-Myc抗体(美国Cell Signaling Technology公司),纤连蛋白(Fibronectin)、Zeb1、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、Snail1、Snail2和β-actin抗体(美国Proteintech公司),二抗(中国中杉金桥),IgG抗体(美国Santa Cruz公司),磁珠(美国Bio-Rad公司),EGF(美国Proteintech公司),牛血清白蛋白(美国Sigma公司),24孔板(美国Corning Costar公司),基质胶(美国BD Biosciences公司)。
1.2 方法
1.2.1 细胞培养:HCT116、SW480细胞均使用RPMI 1640培养基(含10%胎牛血清和100 IU/mL青-链霉素),置于37 ℃、5%CO2的孵箱中培养,隔天消化传代。
1.2.2 细胞转染:用Lipofectamine 3000等相关转染试剂作为溶液,分别使用TMEM206质粒和NC-PCMV6空载质粒对HCT116、SW480细胞进行转染,将细胞分为TMEM206(206组)和对照组(NC组)。将2种细胞接种至6孔板后,在细胞密度约为60%时,将相容的质粒和Lipofectamine 3000、p3000加入,细胞培养8 h后用于其他实验。
1.2.3 EMT构建:质粒转染后的2种细胞用50 ng/mL EGF在48~72 h内处理2次。使用1%牛血清白蛋白为对照,分为NC组、206组、NC+EGF组和206+EGF组,用含有1%胎牛血清的推荐生长培养基培养细胞,以增强EGF的作用。
1.2.4 Western blotting:收集进行上述EMT构建后的HCT116、SW480细胞,提取总蛋白。通过10% SDSPAGE分离样品蛋白,并转移至PVDF膜。然后将膜置于5%脱脂奶粉中封闭2 h。与TMEM206、p-ERK、c-Myc、Fibronectin、Zeb1、E-cadherin、N-cadherin、Vimentin、Snail1、Snail2和β-actin抗体在4 ℃孵育过夜。之后将膜与二抗在室温下孵育2 h。ECL发光方法检测蛋白条带,运用Image J软件分析各条带灰度值。该实验重复3次。
1.2.5 侵袭和迁移实验(Transwell实验):在24孔板中进行细胞侵袭和迁移测定。将转染后细胞的密度调整为2×105/孔,将上述EMT构建中的NC组、206组、NC+EGF组 和206+EGF组 的HCT116及SW480细胞接种到小室中。将300 μL细胞悬液接种到上室中,下室中加入600 μL含有20%胎牛血清的RPMI 1640培养基。侵袭实验中上室用200 mg/mL基质胶包被,其余同迁移实验,37 ℃下孵育3 h后进行侵袭测定。24 h后取出小室,冰甲醇固定30 min,0.1%结晶紫染色30 min。每孔任意选取3个视野(200×)获得细胞图像。结果表示为每个视野迁移的细胞数。每个实验重复3次。
1.2.6 免疫共沉淀:TMEM206质粒转染细胞以增加其表达。48 h后提取蛋白。将质粒标签Myc-tag和IgG抗体与磁珠室温孵育1 h后,将磁珠与样品蛋白在4 ℃孵育过夜。煮沸样品后用于SDS-PAGE,然后进行Western blotting分析。
1.3 统计学分析
应用SPSS 19.0软件进行统计学分析。计量数据均通过3次以上的独立实验获得。Western blotting、细胞迁移和侵袭测定结果用±s表示,采用t检验进行比较。P< 0.05为差异有统计学意义。
2 结果
2.1 TMEM206过表达促进EGF诱导的EMT样细胞形态
EGF诱导后,HCT116和SW480细胞均表现出EMT样细胞形态:大多数细胞丧失其上皮特征并呈现纺锤形和成纤维细胞样形态(图1)。同时发现,TMEM206上调增强了EGF诱导的EMT样细胞形态。大多数HCT116细胞中,206+EGF组细胞较206组细胞出现了明显的细胞形态改变,纺锤形和成纤维细胞样形态更为显著(图1)。SW480细胞中,这种促进作用更为明显。
2.2 TMEM206过表达促进EGF诱导2种结直肠癌细胞中EMT相关蛋白表达的变化

图1 转染质粒、EGF处理后结直肠癌细胞的形态 ×100Fig.1 Cell morphology of plasmid-transfected colorectal cancer cells after EGF treatment ×100
对比2种细胞转染后的NC组、206组、NC+EGF组和206+EGF组EMT相关蛋白表达的变化,结果发现,EGF显著诱导2种细胞中E-cadherin减少以及Fibronectin、Vimentin、Zeb1、N-cadherin、Snail1、Snail2蛋白增加。然而,TMEM206过表达部分促进了EGF诱导的EMT相关蛋白变化,包括促进EGF诱导的E-cadherin减少以及Fibronectin、Zeb1、Snail1、Snail2蛋白增加(Vimentin和N-cadherin除外)。见图2。
2.3 TMEM206过表达在2种结直肠癌细胞中促进EGF激活的ERK/MAPK-cMyc信号传导
EGF在HCT116和SW480细胞中显著激活ERK/MAPK-cMyc信号传导,随后pERK和c-Myc蛋白表达增加(图2)。无EGF刺激下,单独TMEM206过表达不影响相关蛋白表达。然而,TMEM206过表达促进了EGF诱导的pERK和c-Myc蛋白增加(图2)。上述结果提示,TMEM206和ERK/MAPK-cMyc信号通路特异性相互作用。
另外,TMEM206过表达部分上调EGFR-ERK/MAPK-c-Myc信号传导的关键蛋白,包括Fibronectin、c-Myc和p-ERK(图2)。接下来,通过免疫共沉淀测定来证实这些结果。结果显示,TMEM206与c-Myc和E-cadherin免疫共沉淀(图3)。但TMEM206并不与ERK直接结合,这与之前的共沉淀结果一致。结果表明,结直肠癌细胞中TMEM206和EGF诱导的EGFR-ERK/MAPK-c-Myc信号通路之间相互作用。
2.4 TMEM206过表达促进EGF增强的结直肠癌细胞侵袭和迁移
EMT在结直肠癌细胞的侵袭和转移中具有重要作用,EGF能够显著增强结直肠癌细胞的侵袭和迁移。本研究发现,TMEM206过表达质粒转染HCT116细胞后的206组细胞,其侵袭和迁移能力明显增强。同时,TMEM206过表达进一步促进了EGF增强的细胞侵袭和迁移。EGF诱导后,与NC+EGF组相比,206+EGF组中细胞侵袭和迁移明显增加。结果提示,TMEM206过表达促进了结直肠癌细胞中EGF诱导的EMT。在SW480细胞中发现了同样的现象。见图4。
3 讨论
TMEM206是TMEM家族成员,在神经、肾脏和肠道组织中高度表达。之前的研究[6]表明,TMEM206在结直肠癌组织中上调,其表达与T分期和UICC分期呈正相关,与结直肠癌分化呈负相关。TMEM206能够增加结直肠癌细胞系中的p-AKT水平,而AKT在肿瘤增殖、侵袭和迁移中起重要调节作用[7-8],同时,p-ERK(p44/p42)也明显变化,其参与Ras/Raf/MEK/ERK途径[9]。进入细胞核的ERK活性形式作用于各种转录因子,参与细胞分化、增殖和转移的调节[10-11],在肿瘤EMT中也起着重要作用。
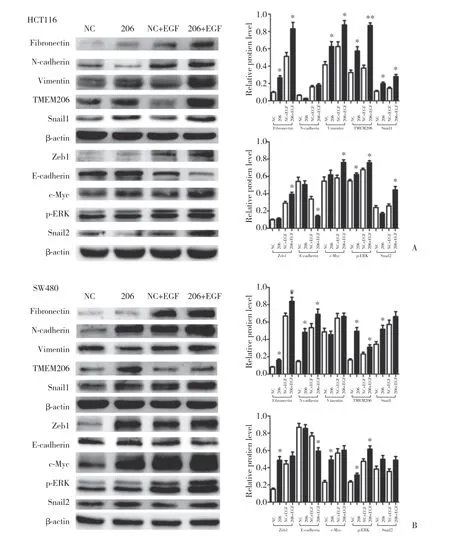
图2 转染质粒、EGF处理后结直肠癌细胞中EMT和EGFR-ERK/MAPK信号传导相关蛋白表达的变化Fig.2 Changes in the expression of EMT and EGFR-ERK/MAPK signaling-related proteins in plasmid-transfected colorectal cancer cells after EGF treatment

图3 通过免疫共沉淀检测Myc-tag、E-cadherin和c-Myc之间的相互作用Fig.3 Interaction between Myc-tag,E-cadherin,and c-Myc as observed by immunoprecipitation

图4 转染质粒、EGF处理后结直肠癌细胞的侵袭和迁移能力 ×200Fig.4 Invasion and migration of plasmid-transfected colorectal cancer cells after EGF treatment ×200
本研究探讨了TMEM206在结直肠癌中对EMT的作用。在EMT过程中,上皮细胞标志蛋白E-cadherin表达下调,Vimentin、Snail、Slug及其他间质特性蛋白表达上调[12-13],导致细胞极性改变、细胞骨架重建以及细胞间黏附丧失,从而使细胞获得高迁移、高侵袭、抗凋亡等间质表型特征。本研究首次发现,TMEM206过表达促进EGF诱导的2种结直肠癌细胞系中的EMT。众所周知,EMT(从E-cadherin减少的良性至浸润性癌的初始转化)和间充质-上皮细胞转化被认为是癌症转移的关键事件。TMEM206过度表达促进了结直肠癌中EGF诱导的EMT相关蛋白(E-cadherin、Fibronectin)的变化,进一步表明TMEM206还在结直肠癌中EGF诱导的EMT中起重要作用。
本研究中,EGF在结直肠癌细胞中激活EGFRERK/MAPK-c-Myc信号通路,而TMEM206过表达促进了EGF诱导的p-ERK和c-Myc蛋白增加,同时也促进了EMT相关蛋白的改变,如E-cadherin减少,Fibronectin、Zeb1、Snail1、Snail2增加。功能学实验也表明,TMEM206过表达进一步增强了EGF对结直肠癌细胞侵袭和迁移能力的诱导。上述指标均表 明,TMEM206与EGFR-ERK/MAPK-c-Myc信号通路在EGF诱导的EMT中发生了密切的相互作用。可以得出结论,TMEM206通过ERK/MAPK-c-Myc信号通路促进结直肠癌细胞中EGF诱导的EMT。而EGFR-ERK/MAPK-c-Myc信号通路也具有重要的抗癌药物,通过Smad2阻断转化生长因子-β信号通路的激活来抑制纤维连接蛋白原纤维形成,减少细胞迁移并最终抑制结直肠癌中EMT[14]。综合之前的研究,TMEM206和ERK/MAPK-c-Myc信号通路协同作用促进结直肠癌的侵袭和转移。当然,还需进一步研究其中相应的分子机制。
此外,越来越多的证据表明,各种癌细胞中Ca2+细胞内稳态的改变与肿瘤的发生、进展和转移密切相关。Ca2+传感器钙调蛋白以Ca2+依赖性方式增强Myc转录和致癌活性[15]。所以,TMEM206与肿瘤细胞内Ca2+的关系也需进一步明确,未来的研究将进一步探讨。这些结果有望为结直肠癌的治疗、预后评估和新靶向治疗药物的开发提供新的理论和实验基础。
综上所述,本研究结果为TMEM206在结直肠癌中的潜在作用提供了重要的依据。虽然结直肠癌的预后优于其他类型癌症,但其远处转移极大地影响了一些结直肠癌患者的预后。因此,研究TMEM206在鉴定新型靶向治疗或良好的诊断标志物中的作用至关重要。
