成功抢救疑似顺式阿曲库铵致全身麻醉下过敏性休克1例报道
2020-04-18赵雅丽龙波
赵雅丽,龙波
(中国医科大学附属盛京医院麻醉科,沈阳 110004)
甲状腺癌是临床较为常见的一种恶性肿瘤,主要治疗手段为手术治疗,与其他恶性肿瘤相比较恶性程度较低,预后良好[1]。对顺式阿曲库铵引起全身麻醉诱导期间发生严重过敏性休克并抢救成功的患者,国内外相关报道很少。我院1例患者在行甲状腺癌根治术麻醉诱导期间出现疑似顺式阿曲库铵致严重过敏性休克并导致室颤,抢救成功后转入ICU,经治疗后转出,患者放弃手术出院。
1 临床资料
患者男性,67岁,体质量80 kg,体质量指数26 kg/m2。半个月前于别院行甲状腺彩超,提示甲状腺结节,为求进一步诊治来我院。门诊以“甲状腺肿物”为诊断收入院。既往患者2012年于雅加达行鼻息肉切除术,2017年12月行心脏起搏器植入术。高血压病史20年,口服降压药(具体药物不详),头孢类药物过敏。术前心电图检查示窦性心律,61次/min;一度房室传导阻滞;头CT示右侧脑室旁、基底节腔梗。实验室检查基本正常。
13:46患者进入手术室,开放外周静脉通路,行心电图、心率、血氧饱和度监测。无创血压180/90 mmHg,心率62次/min,脉搏血氧饱和度99%,10 min后无创血压165/85 mmHg,心率60次/min,呼吸15次/min,血氧饱和度98%,开始麻醉诱导。13:57静脉给予舒芬太尼25 μg,3 min后给予顺式阿曲库铵10 mg,依托咪酯20 mg。面罩通气供氧。患者意识消失,供氧过程中出现全身大汗,皮肤潮红,脉搏血氧波形减弱,心率增快至110次/min,无创血压测量未测出数值。立即行7.0号气管导管插管,连接呼吸机后呼气末二氧化碳分压12 mmHg,心率上升至140次/min,颈动脉搏动弱,立即静脉给予肾上腺素12.5 μg,随后无创血压测出血压50/37 mmHg。此时发现皮肤出现橘皮样改变,周身荨麻疹连接成片(图1)。随即给予地塞米松20 mg静脉注射、甲强龙300 mg静脉滴注,同时间断静脉推注肾上腺素维持血压。紧急行颈内静脉穿刺置管和桡动脉穿刺置管。于直接动脉压监测下持续泵注肾上腺素,中心静脉快速补液,使平均动脉压维持在70~80 mmHg。患者短暂好转后于14:33出现室颤,立即进行200 J双相电除颤,肾上腺素1 mg静脉注射,恢复窦性心律。对症治疗,14:39患者再次出现室颤,200 J电除颤成功,恢复窦性心率,继续对症治疗,纠正酸中毒、补钙补钾。患者有所好转出现体动,给予咪唑进行镇静。15:40观测尿量为600 mL。继续对症治疗后患者生命体征逐渐平稳,肾上腺素用量由1.5 mg/h逐渐减少到0.4 mg/h,带气管导管送往ICU。14:19、14:32、15:19的血气分析结果见表1。
患者转入ICU后,先后给予力月西、诺扬及艾贝宁进行适度镇痛镇静,西地兰强心,甲强龙冲击治疗,持续泵入肾上腺素及去甲肾上腺素维持血压,根据血压变化调整泵入速度。呼吸机支持通气,密切观察患者神志及尿量,补液维持离子稳态。第4天患者神志清,拔除气管插管行面罩吸氧,咳痰差并有舌后坠,血氧饱和度下降至90%,心率迅速增高,丙泊酚麻醉下行气管插管并继续进行呼吸机辅助通气,给予丙泊酚及瑞芬镇静镇痛。患者入ICU后第2、3及7天超敏肌钙蛋白、C反应蛋白及IgE的数值见表2。第7天呼吸氧合良好,神志清楚,行纤维支气管镜治疗拔除气管插管。随后患者放弃手术,按其要求办理出院。
2 讨论
2.1 过敏反应的定义
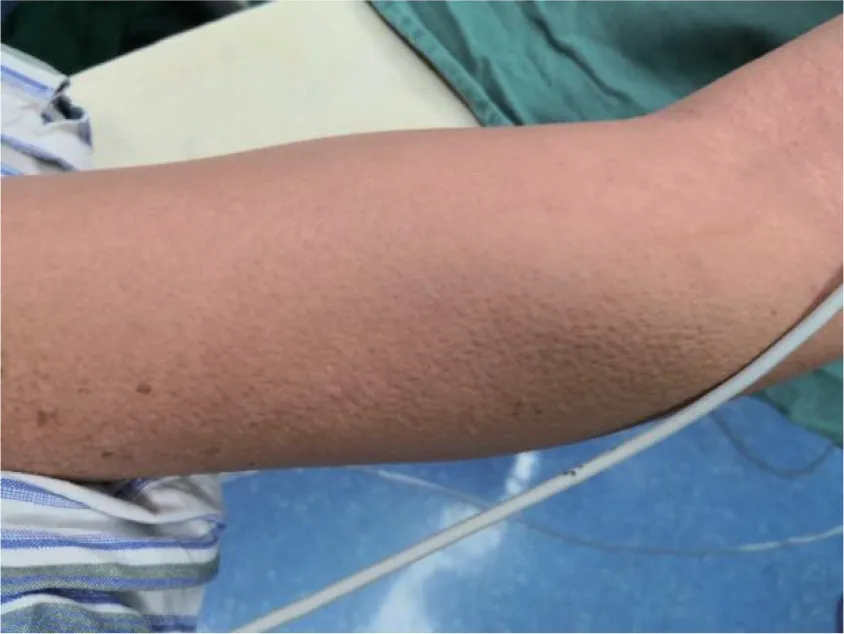
图1 皮肤出疹样改变
过敏反应是指机体再次接受特种抗原作用后引起的一种异常反应,这是由于抗原与致敏肥大细胞或嗜碱性粒细胞上IgE结合,使之脱颗粒释放组胺和其他血管活性物质,并引起局部或全身症状。围术期严重过敏反应的常见临床表现包括皮肤黏膜表现(皮肤瘙痒,出现红斑或荨麻疹、风团、水肿等)、气道表现(支气管痉挛,咽部水肿,呼吸困难)、消化系统症状(恶心,呕吐,腹痛,腹泻)及心血管系统表现(血压下降,心律失常,甚至短时间内休克致死)[2-4]。本例患者出现了过敏性休克,诊断依据主要根据临床证据和体征:满身大汗,皮肤出疹样改变,血压迅速下降,心率增快,脉搏血氧波形减弱。随后ICU的实验室检查证实患者出现了过敏反应

表1 不同时间的血气分析结果
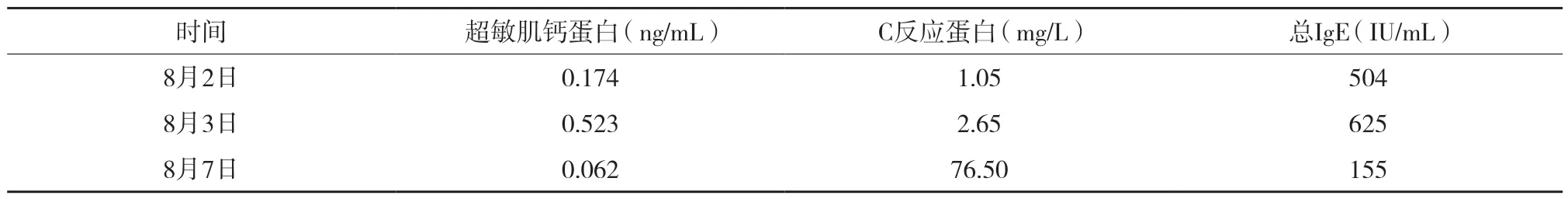
表2 不同时间的超敏肌钙蛋白、C反应蛋白及IgE数值
2.2 引起过敏的药物
围术期使用的多种药物都可能导致过敏反应。本例患者只给予依托咪酯、舒芬太尼和顺式阿曲库铵进行麻醉诱导。催眠镇静药依托咪酯及舒芬太尼诱发过敏反应非常罕见,且患者在ICU内曾行丙泊酚麻醉下气管插管、泵入丙泊酚和瑞芬镇痛镇静,均未再次发生过敏反应。因此,推断顺式阿曲库铵引发过敏性休克的可能性最大。肌肉松弛药是复合全身麻醉用药的重要组成部分,其导致的过敏占69.2%[5]。肌肉松弛药引起的过敏反应可能发生在围术期的任何时间,90%发生在麻醉诱导期或其后数分钟。众多肌肉松弛药中,顺式阿曲库铵的药物交叉过敏反应低,刺激肥大细胞释放组胺的可能性很小,国内外关于其引起过敏性反应的报道很少[6-8]。但其仍可能诱发IgE介导的过敏反应。
2.3 过敏性休克的抢救措施
(1)立即停用所有麻醉药物及有关的致敏药物。(2)保证患者氧供。(3)进行抗过敏及过敏性休克的药物治疗。一旦怀疑诊断为过敏性休克,肾上腺素为首选药物。肾上腺素是一种内源性儿茶酚胺,可以直接兴奋β和α受体,通过增强心肌收缩力、加快心率等途径使心输出量和心肌需氧量提高,并可以松弛支气管平滑肌缓解气道痉挛。一般采用静脉滴注或肌肉注射,出现严重过敏反应时考虑静脉注射。对于多次注射无效的患者,可采用持续泵入形式。使用肾上腺素治疗引起严重过敏反应时,剂量不足、不恰当的静脉滴注和过量使用是肾上腺素在治疗过程中引起不良反应的主要原因[9]。肾上腺素过量会导致左心衰竭、心肌缺血、室性心律失常、肺水肿、呼吸功能衰竭、肾衰竭等严重并发症。抗组胺类药物和皮质醇类归为二线药物,不应替代或在肾上腺素前应用。常用的几种激素类药物有甲强龙、氢化可的松、地塞米松。甲强龙是一种中效糖皮质激素,具有较强的抗炎、抗过敏和免疫抑制作用。氢化可的松为短效皮质激素,相对于氢化可的松,甲强龙抗炎、糖代谢效果更强,对水钠储留作用小,能迅速有效减轻临床症状,控制病情发展。地塞米松为长效糖皮质激素,抗炎效力强,作用时间长,但对下丘脑-垂体-肾上腺轴的抑制较严重,只可作为临时性用药[10]。因此,对于过敏的治疗,甲强龙更具有优势,其效果显著、安全性高且控制病情迅速。(4)抗休克治疗在发生严重过敏反应时,血管的通透性增加,因此在严重过敏反应早期应及时进行快速补液,补充由于外周血管扩张和间质毛细血管液体渗出造成的容量损失。(5)纠正酸中毒。(6)监测生命体征,密切观察患者脉搏、血压、呼吸意识、体温、尿量等。
2.4 Kounis综合征
Kounis综合征为急性冠状动脉综合征并发严重过敏反应。与肥大细胞激活、脱颗粒,释放出大量生物胺、活性酶及细胞因子等炎性介质,诱发冠状动脉痉挛,冠状动脉斑块糜烂、破裂和冠状动脉支架内血栓形成等相关[11]。冠状动脉内膜层及动脉粥样硬化斑块中均存在肥大细胞。本例患者既往有腔梗病史,高血压病史20余年,且置入心脏起搏器,在纠正休克的过程中泵注肾上腺素、维持平均动脉压在70~80 mmHg时发生室颤,随后在ICU的治疗过程中需要长时间使用血管活性药物维持血流动力学稳定,当日于ICU测得超敏肌钙蛋白显著增高,考虑可能与Kounis综合征有关。由于术前没有相关检查,因此难以确诊。但是此类患者一旦发生过敏性休克,会显著增加急性心肌梗死的发病风险,应引起格外注意。
2.5 过敏及过敏性休克的预防
用药前详细询问过敏史,了解容易引起过敏及过敏性休克的药物,过敏体质患者用药中、用药后严密观察,减少不良反应的发生。过敏性休克是临床常见的急症之一,特别是药物过敏性休克,因其常在静脉滴注短时间内发生,具有未知性及不可预测性。过敏性休克进展迅速,病情凶险,过敏原繁多,首发症状常不典型,如不及时恰当地处理会危及生命。所以,诊断明确、处理果断是关键。
