多巴胺受体D5基因5’端单核苷酸多态性与偏执型精神分裂症的关联及对基因表达的影响
2020-04-18张静静邢佳鑫吴雪许凤玲宣金锋姚军王保捷
张静静,邢佳鑫,吴雪,许凤玲,宣金锋,姚军,王保捷
(中国医科大学 1.法医学院法医物证学教研室,沈阳 110122;2.附属第一医院中心实验室,沈阳 110001)
精神分裂症作为一种大脑神经系统功能障碍性疾病,发病机制十分复杂。全世界大约有1%的人患有精神分裂症,研究[1-2]表明这一比例还在持续增高,而其中偏执型发病率最高。有关精神分裂症发病机制的研究至今仍在进行,最新的研究[3]表明,遗传因素和环境因素共同作用导致了疾病的发生,其中遗传因素为主导。多巴胺受体属于G-蛋白偶联受体,根据其生理及药理学特性,目前发现的5种受体被分为2个亚群,多巴胺受体D5(dopamine receptor D5,DRD5)属于D1亚群,包括药物成瘾以及精神分裂症等许多精神疾病的治疗药物都将其作为靶点。在大脑的边缘系统、下丘脑、额叶的皮质以及纹状体等重要部位的神经元中,DRD5是发挥信息传递作用、传递神经冲动的重要功能性物质[4-6],发生位点突变可能会造成DRD5表达量的变化,继而影响与多巴胺的结合能力,从而导致磨牙症、偏执型精神分裂症以及药物成瘾等精神性疾病的发生[7-9]。本课题组在对DRD5基因的前期研究中,在分子水平上探索了4个单核苷酸多态性(single nucleotide polymorphism,SNP)与偏执型精神分裂症发病的相关性[1],最终证实了一些核苷酸位点的突变与精神分裂症的发生存在一定的联系。为了进一步探索在精神分裂症发病机制中DRD5基因发挥的作用,本研究以包含DRD5基因的rs77434921和rs2076907位点的5’端核苷酸序列为基础,分析不同单倍型是否可以影响DRD5基因的表达;以及5’端的不同片段在DRD5基因表达中的作用。
1 材料与方法
1.1 材料
人神经母细胞瘤SK-N-SH细胞和人胚肾(human embryo kidney,HEK)293细胞购于中国科学院;JM109化学感受态细胞购于中国Trans公司;pGL3萤火虫荧光素酶报告基因载体与双荧光素酶报告基因检测试剂盒均购于美国Promega公司;限制性内切酶KpnⅠ和BglⅡ及T4 DNA连接酶均购于美国Thermo公司;质粒提取试剂盒和凝胶回收试剂盒均购于美国Axygen公司;Lipofectamine®3000购于美国Invitrogen公司;Prime STAR HS DNA聚合酶、序列特异性引物、250 bp DNA Ladder和PrimScript™RT Reagent试剂盒均购于日本TaKaRa公司。
1.2 方法
1.2.1 扩增目的片段:根据pGL3载体存在的酶切识别位点,在引物5’端添加限制性内切酶KpnⅠ和BglⅡ的识别序列。以转录起始位点为基准,rs77434921位于-1 095位置处,而rs2076907位于+171位置处。
P1~P4载体分别包含4种单倍型G-G、G-C、A-G、A-C,均采用正义序列F1:5’-GGGGTACCCCT TCGGAGTAGTGAAAGGAGAAGAAGCA-3’ 和反义序 列R1:5’-GAAGATCTTCCAGCAGGGTCCAGATG ATGAGTAGG-3’扩增,产物长度均为2 163 bp。P5和P6载体仅含rs77434921位点G和A,采用正义序列F1和反义序列R2:5’-GAAGATCTTCGTGTCTGGTT CGGAGCGAGAGAAG-3’扩增,产物长度均为1 681 bp。P7和P8载体仅含rs2076907位点G和C,采用正义序列F2:5’-GGGGTACCCCGCCGAAACACTTCAC AAATGCAACT-3’和反义序列R1扩增,产物长度均为1 498 bp。P9、P10、P11和P12为DRD5基因5’截短后的载体,分别采用正义序列F9:5’-GGGGTACCCC AACACACTGACGGTGTTTCATCAGG-3’、F10:5’-GGGGTACCCCCAAACAGGATGGAGGAGGCAC AAT-3’、F11:5’-GGGGTACCCCATGGTCTTGCCCT CTCCAGCG-3’、F12:5’-GGGGTACCCCATGGTCTT GCCCTCTCCAGCG-3’和对应公共下游引物反义序列R1进行扩增,产物长度分别为2 030、1 908、1 777和1 620 bp。见图1。

图1 扩增产物长度及位置Fig.1 PCR product length and the location of primers
PCR反应总体系50 μL,2×Prime STAR GC Buffer(含Mg2+)25 μL,dNTP 4 μL,浓度为15 pmol/L的引物各3 μL,Prime STAR HS DNA聚合酶1 U,模板DNA 0.1 μg。PCR反应条件为95 ℃ 5 min;98 ℃ 10 s,64.2℃ 5 s,72 ℃ 2 min,30个循环;72 ℃ 7 min。
1.2.2 纯化目的片段:在1%的琼脂糖凝胶中进行PCR产物的电泳,使用试剂盒回收DNA,并测浓度。将纯化的目的片段进行平末端的加A反应,总体系20 μL,DNA片 段15 μL,5×Tailing-A Reaction Buffer 4 μL,Tag DNA聚合酶1 μL,72 ℃反应30 min。T-A连接反应总体系为10 μL,10×T4 DNA Ligation 缓冲液1 μL,T4 连接酶1 μL,T-载体50 ng,目的片段400 ng,16 ℃反应8~12 h。
1.2.3 构建载体:将构建好的质粒转化到JM109感受态细胞中进行培养,产物测序验证后,采用限制性内切酶KpnⅠ和BglⅡ构建PGL3荧光素酶载体。PGM-T酶切反应体系10 μL,PGM-T载体7 μL,10×Buffer、KpnⅠ和BglⅡ各1 μL,37 ℃酶切30 min后,80 ℃灭活5 min。PGL3载体酶切反应体系10 μL,灭菌去离子水6 μL,30 ng/μL的PGL3-Basic载体、10×Buffer、KpnⅠ和BglⅡ各1 μL,37 ℃酶切30 min后,80 ℃灭活5 min。连接反应体系10 μL,DNA片段90~240 ng,30 ng/μL的PGL3载 体、10×T4 DNA Ligation Buffer和T4 DNA Ligation各1 μL,16 ℃反 应8~12 h。
1.2.4 荧光素检测:通过HEK293和SK-N-SH两种细胞株进行转染。培养24 h后收集细胞,使用管式化学发光检测仪(Berthold LB 9508,德国Berthold公司)检测萤火虫荧光素酶活性,每组样品一式3份,每份重复3次。
1.2.5 提取RNA及分析:将P6及P4载体分别与TK载体一起转染,用Trizol法提取样品RNA,进行逆转录。然后用实时定量PCR法对重组载体与TK载体在cDNA水平进行相对的定量分析,观察RNA表达变化。反转录体系20 μL,5×PrimeScript 缓冲液4 μL,PrimeScript RT Enzyme Mix 1 μL,Oligo dT Primer 1 μL,Random 6 mers 4 μL,RNA 500 ng。
PGL3引物,正义序列:5’-ACGGATTACCAGG GATTTCA-3’,反义序列:5’-AGCGACACCTTTAGGC AGAC-3’;Tk引物,正义序列:5’-GCTTGGAGCGAA CGACC-3’,反义序列:5’-CGAAACCCGACAGGACT A-3’。使用日本TaKaRa公司Prime Script™RT Reagent试剂盒,反应条件参照试剂盒操作手册。
1.3 统计学分析
采用SPSS 18.0软件对荧光素酶报告分析的数据进行分析。相对荧光强度结果以表示,不同片段重组载体之间的多重比较采用LSDt检验。P<0.05为差异有统计学意义。
2 结果
2.1 验证克隆载体
应用DNA克隆方法结合PCR法,将目的序列扩增并插入PGL3载体中,完成载体构建。采用限制性内切酶处理的产物经琼脂糖凝胶电泳检测后进行测序,测序结果一致。
P1、P2、P3、P4重组载体酶切产物经电泳检测,长片段为4 787 bp的PGL3载体片段,短片段为2 163 bp的目的片段。见图2。

图2 P1、P2、P3、P4重组载体酶切产物电泳图Fig.2 Electrophoresis of the enzyme-digested products of P1,P2,P3,and P4 recombinant vectors
对rs77434921和rs2076907 2个SNP分别进行克隆,成功构建P5、P6、P7、P8重组载体,酶切产物经电泳检测,长片段为4 787 bp的PGL3载体片段,短片段为目的片段(P5:1 700 bp,P6:1 700 bp,P7:1 518 bp,P8:1 518 bp)。见图3。
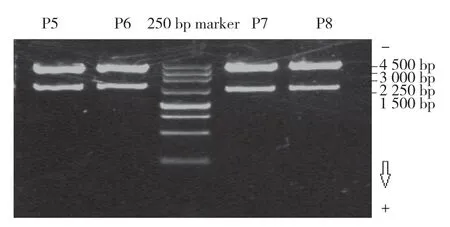
图3 P5、P6、P7、P8重组载体酶切产物电泳图Fig.3 Electrophoresis of the enzyme-digested products of P5,P6,P7,and P8 recombinant vectors
为了研究DRD5基因5’端区域在基因表达中的调控趋势,对5’端的-1 599~-934这段序列进行了多次截短,完成了P9~P12载体的构建,酶切产物经电泳检测,长片段为4 787 bp的PGL3载体片段,短片段为目的片段(P9:2 050 bp,P10:1 797 bp,P11:1 928 bp,P12:1 640 bp)。见图4。
2.2 双荧光素酶报告分析
随机以单倍型G-G的相对荧光强度为标准,在HEK293和SK-N-SH两种不同的细胞中对4种单倍型对荧光素酶活性的影响进行分析。与G-G相比,A-G、G-C、A-C三者荧光素酶活性的表达在2种细胞系中均未发生显著变化(P> 0.05)。

图4 P9、P10、P11、P12重组载体酶切产物电泳图Fig.4 Electrophoresis of the enzyme-digested products of P9,P10,P11,and P12 recombinant vectors
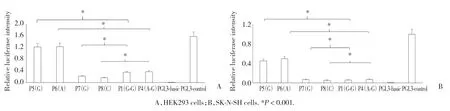
图5 P5、P6、P7、P8以及P1、P4重组载体相对荧光强度分析图Fig.5 Relative fluorescence intensity of P5,P6,P7,P8,P1,and P4 recombinant vectors in HEK293 and SK-N-SH cells
2个 SNP位点的不同单倍型在2种细胞中均没有产生明显的荧光强度改变(P> 0.05)。然而在对序列进行截短后,发现其相对荧光强度显著变化,P5载体与P1载体相比、P6载体与P4载体相比,相对荧光强度均显著升高(P< 0.001)。P7载体与P1载体相比、P8载体与P4载体相比,相对荧光强度均显著下降(P< 0.001)。见图5。
在HEK293细胞中,P9载体与P4载体相比,相对荧光强度显著下降,而P8载体与P12载体相比,相对荧光强度显著升高(P< 0.001)。然而在SK-N-SH细胞中,P9载体与P4载体相比、P11载体与P10载体相比、P8载体与P12载体相比,相对荧光强度均有不同程度下降(P< 0.001)。P10载体与P9载体相比、P12载体与P11载体相比,相对荧光强度表现为不同程度升高(P< 0.001)。见图6。
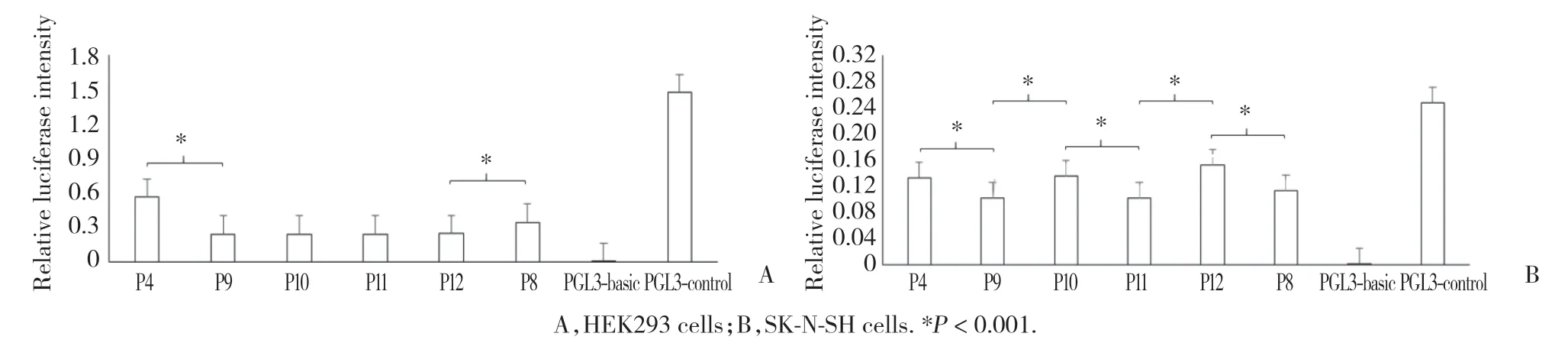
图6 截短片段重组载体相对荧光强度分析图Fig.6 Relative fluorescence intensity of P4,P9,P10,P11,P12,and P8 recombinant vectors in HEK293 and SK-N-SH cells
2.3 实时定量PCR进行mRNA水平分析
+82~+171这段区域属于DRD5基因的5’端非翻译区(untranslated region,UTR)。将P6载体和P4载体转染细胞,通提取样品RNA,逆转录并进行定量。结果表明,与P4载体相比,P6载体的相对RNA水平显著升高,相对荧光强度和相对RNA水平升高在HEK293细胞中约为3.2倍和1.6倍,而在SK-N-SH细胞中分别约为6.7倍和7倍。
3 讨论
本研究在转录水平对DRD5基因的rs77434921和rs2076907这2个SNP对基因表达的影响进行了探索。在本课题组的前期研究中,没有发现4种单倍型的相对荧光强度存在显著差异。对于这一结果,可能的原因是存在一些与编码区的致病SNP有连锁关系的非编码区SNP,在一些频率调查中发现的非编码区SNP与某些疾病存在关联,根本原因是与其连锁的编码区SNP的致病性[10-13]。另外,不排除在发挥调控作用时,存在的多个SNP之间发生了相互作用,因此本研究将2个SNP单独进行了研究,然而仍然没有发现单独存在时SNP的不同单倍型对基因表达水平有明显影响。当然本研究结果依然存在很多局限性,如很可能因为细胞系选择的局限,从而未能对DRD5基因表达的调控机制进行全面分析。
本研究仅选择了2种在精神系统疾病的相关研究中常用的细胞系HEK293和SK-N-SH[14]。研究发现,与P4载体相比,P9载体相对荧光强度在HEK293和SK-N-SH细胞中均有不同程度降低,说明-1 599~-1 486这段序列可能存在正调节因子的结合位点;在2种不同的细胞系中,-1 076~-934这段序列表现出不同的调节作用,在HEK293细胞中抑制基因表达,而在SK细胞中促进表达;此外在SK-N-SH细胞中-1 364~-1 233这段序列能够促进表达,而-1 233~-1 076和-1 486~-1 364序列对基因表达存在负调控。可能是由于不同细胞之间本来就有很大的差异,SK-N-SH细胞作为一种神经细胞,其生长速度、代谢速率都与HEK293细胞不同,表达的各自转录调节因子也有差别,因而表现出的调控作用才会不同[15]。因此,在对基因的表达进行研究时,最好可以更全面地进行细胞实验,以便调控机制的研究更科学、全面、准确。
在对5’端序列进行截短的研究发现,+82~+564这段序列对基因的表达具有很显著的下调作用。+82~+564这段序列存在部分DRD5基因的5’端UTR,而5’端UTR的主要作用是参与RNA的翻译以及转录后的调控。结果表明,-1 599~+82这段5’端UTR部分缺失的片段,其RNA水平与相对荧光素酶活性在2种细胞系中均有不同水平的升高。这一结果表明,在DRD5基因中5’端UTR存在对RNA转录以及转录后调控的抑制作用。有研究报道在紧接5’端UTR启动子下游的重要的操纵元件,是阻遏蛋白识别并且结合的区域,阻遏蛋白通过抑制启动子复合物的形成对基因表达存在负调控作用。基因表达的转录及翻译是一个极其复杂的过程,并且由于DRD5基因本身构成具有复杂性[10],因而对机制的深入研究造成了困难。
本研究探讨了DRD5基因5’端序列及SNP位点对基因转录水平的调控,旨在为DRD5基因表达的调控机制的深入研究提供参考信息,为进一步探讨其与偏执型精神分裂症发病的关联性提供思路。
