PI3K和VEGF-C在口腔颌面部淋巴管畸形中的表达
2020-04-18宋柏璇于丽赵振坤赵志国王秋旭
宋柏璇,于丽,赵振坤,赵志国,王秋旭
(1.中国医科大学附属盛京医院口腔颌面外科,沈阳 110004;2.辽阳市中心医院口腔科,辽宁 辽阳 111009;3.杭州口腔医院特诊科,杭州 310012;4.中国医科大学附属盛京医院病理科,沈阳 110004)
淋巴管畸形是由淋巴管扩张形成的大小不等的囊腔,其病理性质历来是众多学者的关注热点,其中以畸形和肿瘤学说最具有代表性[1]。前者认为淋巴管畸形是一种发育畸形,由淋巴管先天性发育异常或淋巴管后天受外界刺激扩张而成;后者认为淋巴管畸形是一种良性肿瘤,由淋巴管内皮细胞异常增殖而成。研究[2]发现,淋巴管畸形的淋巴管内皮细胞具有高度增殖潜力,注射到小鼠体内时可形成淋巴管畸形样病变。在国际脉管性疾病研究学会分类中,淋巴管畸形未被认为是肿瘤[3]。研究发现[4-8],磷脂酰肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)介导的PI3K/AKT信号通路及血管内皮生长因子-C(vascular endothelial growth factor-C,VEGF-C)参 与肿瘤淋巴管生成。本研究通过应用免疫组化SP法检测淋巴管畸形组织及正常淋巴组织标本中PI3K和VEGF-C的表达情况,探讨PI3K和VEGF-C在口腔颌面部淋巴管畸形中的表达。
1 材料与方法
1.1 标本来源
淋巴管畸形组织来源于中国医科大学附属盛京医院2009年至2014年间手术治疗的淋巴管畸形患者,共35例,其中以颊部、腮腺、颌颈部多见,占总量的85.71%,均经病理证实为淋巴管畸形。正常淋巴组织从腮腺及颌下腺病变组织中分离而来,共10例,经HE染色后确定为正常淋巴组织。
1.2 方法
兔抗人VEGF-C抗体、兔抗人PI3K p110α抗体,购自武汉博士德有限公司。
将35例淋巴管畸形组织和10例正常淋巴组织于切片机上做4 μm的连续切片。切片用二甲苯脱蜡2次,依次置于95%、80%、70%乙醇中脱苯。采用高压修复抗原。用3%过氧化氢浸泡,以灭活内源性过氧化物酶。加入一抗(兔抗人VEGF-C抗体、兔抗人PI3K p110α抗体)和通用型二抗,在37 ℃水浴箱中孵育,每次孵育后PBS冲洗。二氨基联苯胺显色,苏木素轻度复染,常规脱水、透明、封片,镜检。分别用PBS代替2种一抗作为阴性对照。
1.3 结果判定
免疫组化以细胞质和细胞膜中出现棕黄色颗粒为阳性表达。按照阳性细胞所占比例分别记1~4分:1分,<25%;2分,25%~<50%;3分,50%~<75%;4分,≥75%。按染色强度分别记0~3分:0分,阴性,不着色;1分,弱阳性,浅棕色;2分,阳性,棕黄色;3分,强阳性,棕褐色。二者相乘,0~1分为阴性,2~12分为阳性。染色结果由2名高年资病理医生独立进行判定。
1.4 统计学分析
采用SPSS 20.0软件进行分析。PI3K、VEGF-C在淋巴管畸形和正常淋巴组织中阳性表达率的比较采用χ2检验;PI3K、VEGF-C在淋巴管畸形中的相关性采用Spearman相关分析。P< 0.05为差异有统计学意义。
2 结果
免疫组化结果表明,PI3K、VEGF-C位于细胞质及细胞膜中,在淋巴管畸形组织中高度表达(图1)。
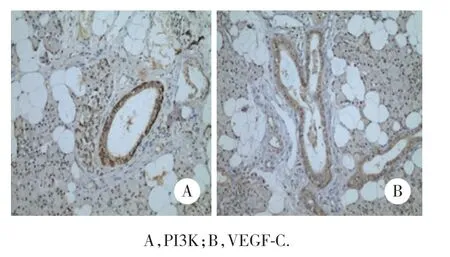
图1 淋巴管畸形组织中PI3K和VEGF-C阳性表达 ×200Fig.1 Positive expression of PI3K and VEGF-C in lymphatic malformations ×200
淋巴管畸形组织中,PI3K的阳性表达率为80.00%(28/35),VEGF-C的阳性表达率为88.57%(31/35);正常淋巴组织中,PI3K和VEGF-C的阳性表达率均为0%(0/10)。淋巴管畸形组织中PI3K、VEGF-C的阳性表达率明显高于正常淋巴组织(χ2=17.910,P< 0.05;χ2=24.487,P< 0.05)。
淋巴管畸形组织,PI3K与VEGF-C的阳性表达呈正相关(r=0.495,P< 0.05)。
3 讨论
PI3K是一种异二聚体,由PIK3CA基因编码的p110α催化亚基和PI3KR1编码的调节亚基(p85)组成[7]。PI3K介导的PI3K/AKT信号通路是细胞内重要的信号传导通路之一,调控多种细胞活动。PI3K/AKT信号通路是近年来研究的热点通路,在人类多种肿瘤的发生、发展中起着重要作用。研究[6,8-11]还发现,该通路参与肿瘤血管及肿瘤淋巴管生成,促进肿瘤的远处转移。VEGF-C是VEGF家族的重要成员,是重要的淋巴管生成因子之一,在肿瘤组织中高度表达。许多临床研究[12]显示,VEGF-C表达水平与淋巴结转移呈正相关。VEGF-C可与淋巴管内皮细胞上表达的酪氨酸激酶受体VEGFR-3结合,促进淋巴管的增殖,从而诱导肿瘤淋巴管的生成和淋巴转移[7]。
目前关于VEGF-C与肿瘤淋巴管生成及转移的研究较多,而关于PI3K/AKT与肿瘤淋巴管生成及转移的研究较少。近年来研究[11,13]发现,PI3K介导的PI3K/AKT信号通路可被上游分子激活,通过作用下游底物分子促进VEGF-C的表达及分泌。研究[11]发现,纤维蛋白的额外结构域A可能通过PI3K/AKT信号通路上调结直肠癌中VEGF-C的表达,从而诱导肿瘤淋巴管生成。在单侧输尿管梗阻诱导的肾淋巴管生成中,发现巨噬细胞通过C-C基序趋化因子受体2(C-C motif chemokine receptor 2,CCR2)激活PI3KAKT-mTOR信号传导以介导缺氧诱导因子-1α表达,然后驱动VEGF-C表达以促进淋巴管生成[13]。然而现阶段人们对 PI3K介导的PI3K/AKT信号通路及VEGF-C如何促进肿瘤淋巴管生成及淋巴转移仍存在许多未知,并且两者之间的具体作用机制仍不清楚,期待对该通路进行深入的研究。
本研究从分子水平检测淋巴管畸形和正常淋巴组织中PI3K、VEGF-C表达情况,发现在淋巴管畸形组织及正常淋巴组织中PI3K、VEGF-C阳性表达存在显著差异,提示PI3K、VEGF-C与淋巴管畸形内皮细胞增殖有关。淋巴管畸形组织中,PI3K、VEGF-C阳性表达存在相关性,提示在淋巴管畸形中PI3K 介导PI3K/AKT 信号通路被上游分子激活,通过下游分子作用促进 VEGF-C 表达及分泌,共同参与淋巴管畸形的发生及发展。本研究表明,PI3K和VEGF-C的异常表达可能与淋巴管畸形的发生、发展有关,可作为淋巴管畸形病因学研究的指标之一。
迄今为止,淋巴管畸形的发病机制及病理性质尚不明确。临床上可表现为一个孤立的病灶或弥漫性病灶,或作为混合血管病灶的一部分,或作为各种过度生长综合征重要的并发症,常伴有外观及功能的改变。手术及硬化剂治疗可以改善患者的局部症状和外观,但完全缓解较为罕见[14]。目前对淋巴管畸形病因学的研究仍很肤浅,所以,该领域仍存在大量的未知问题有待进一步深入研究和解决。通过对淋巴管畸形发病机制的研究,寻找更好的治疗方法,进而改善患者预后。
