PPARα对肥胖大鼠神经病理性疼痛的作用及其机制
2020-04-18郭欣欣张博涵赵梦楠王品莹陶学恕
郭欣欣,张博涵,赵梦楠,王品莹,陶学恕
(1.锦州医科大学附属第三医院麻醉科,辽宁 锦州 121000;2.中国医科大学附属第一医院疼痛科,沈阳 110001)
研究[1]显示,肥胖与胰岛素抵抗、血脂异常、2型糖尿病和神经退行性疾病相关。最新研究[2]表明肥胖与疼痛易感性增加有关。饮食诱导的肥胖大鼠或肥胖的Zucker大鼠在皮内注射角叉菜胶时表现出增强的外周炎症和炎症痛觉过敏[3-4]。目前没有预防或治愈肥胖相关疼痛的方法,所以阐明其作用机制非常重要。
过氧化物酶体增殖物激活受体α(peroxidosome proliferators activate receptors α,PPARα)与许多脂代谢性疾病(肥胖症等)有关。研究[5]发现在肥胖人群肝脏中PPARα下调。PPARα已被证实在许多炎症相关的神经病理性疼痛(neuropathic pain,Nep)中发挥止痛作用。Nep与中枢小胶质细胞活化及其随后释放的促炎性细胞因子白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)有关[6],研究[7]表明小胶质细胞最终引起脊髓等部分的神经细胞凋亡。有研究[8]发现炎症痛时脊髓中的PPARα激活,并迅速参与到痛觉传导的过程中。另外还有研究[9]发现给予PPARα激动剂可以有效降低硫酸镁注射引起的疼痛,而敲除PPARα基因后发现大鼠的痛觉敏感性增加,而给予PPARα激动剂后却没有显示出明显的抗疼痛作用。肥胖是全身低度的慢性炎症状态,外周脂肪细胞变性坏死促进炎症介质释放,脂肪细胞凋亡导致促炎性细胞因子增多[10],造成疼痛敏感性增强。人外周血单核细胞中PPARα激活还具有抗氧化、抗炎、抗凋亡等重要作用[11]。
本研究采用高脂肪饮食诱导建立肥胖大鼠模型,进而建立Nep模型,探讨PPARα在肥胖大鼠Nep中的作用及其机制。
1 材料与方法
1.1 实验动物及试剂
体质量约70 g的雄性SD大鼠(辽宁长生生物中心),饲养在23~25 ℃,12 h光照/黑暗循环的房间中,随意提供食物和水。所有实验均按照《动物和人类研究指导原则》进行。实验程序经中国医科大学动物保护与使用委员会批准。PPARα、Bax、Bcl-2抗体购自美国Cell Signaling Technology公司;PPARα激动剂(PEA)、PPARα抑制剂(GW6471)购自美国APEx-BIO公司。
1.2 方法
1.2.1 大鼠饲养及分组:取SPF级SD大鼠60只,采用随机数字表法随机分为高脂(high fat,HF)组、HF+坐骨神经分支损伤(spared nerve injury,SNI)组、HF+SNI+PEA组、HF+SNI+GW6471组、低脂(low fat,LF)组、LF+SNI组。连续高脂/低脂饲料喂养12周,HF组大鼠给予高脂饮食(含脂肪45% kcal;美国New Brunswick公司)诱导肥胖,具体方法见文献[12],LF组大鼠给予低脂饮食(含脂肪10% kcal)。采用SNI法制备Nep模型,HF或LF组大鼠喂养12周后处死,每组收集部分大鼠L4-6脊髓(spinal cord,SC)和脊髓背根神经节(dorsal root ganglion,DRG)。在大鼠Nep模型建立后14 d收集大鼠L4-6SC和DRG。HF+SNI+PEA组、HF+SNI+G6471组术后14 d时,鞘内分别给予PEA(0.03 μmol/kg)、GW6471(0.03 μmol/ kg),连续7 d,期间每天测量机械性异常性疼痛,7 d后收集大鼠SC和DRG。
1.2.2 大鼠机械刺激缩爪潜伏期(paw withlraw threshold,PWT)测定:采用Von Frey实验评估机械性异常性疼痛,具体方法见文献[13]。将大鼠置于具有网状底部的笼中,并将校准的Von Frey针垂直施用于动物的后爪,直至观察到阳性反应(缩爪和舔或摇动爪)。
1.2.3 大鼠SNI模型制备:模拟制作与神经损伤相关的Nep的SNI模型。通过吸入3%异氟烷使大鼠麻醉,并且暴露主要坐骨神经及其后肢的分支。结扎或切断胫神经和腓总神经,保留细小腓肠神经。24 h在后爪和足外侧产生显著疼痛反应。
1.2.4 脊髓蛛网膜下腔的腰椎导管插入术:按照文献[14]方法进行鞘内置管。吸入3%异氟烷麻醉大鼠,制作中线侧面切口,并将引导插管(20 G)插入蛛网膜下腔。动物清醒后通过导管施用2%利多卡因(10 μL),通过尾甩动作和后肢麻痹表明定位正确。
1.2.5 Western blotting实验:取出大鼠L4-6SC和DRG,在含有RIPA裂解物(P0013B)的400 μL匀浆缓冲液中匀浆。然后将样品0 ℃温育30 min,在4 ℃ 15 000 r/min离心10 min。收集上清液并使其变性,在十二烷基硫酸钠聚丙烯酰胺凝胶上进行电泳,然后转移到聚偏二氟乙烯膜上。用含有5%脱脂奶粉的封闭缓冲液封闭膜,然后与PPARα一抗(1∶1 000)和GAPDH(1∶1 000)孵育。洗涤膜并与适当二抗(1∶10 000)温育。用ECL试剂(Millipore Bio-science)显色印迹,获得图像并用分子成像仪(Gel Doc TMXR,170-8170)和相关的Quantity One 4.6.5软件分析。
1.3 统计学分析
2 结果
2.1 各组大鼠体质量、PWT比较
结果显示,喂养6、8、10、12周时HF组大鼠比LF组大鼠体质量增加显著(P< 0.05)。见图1。
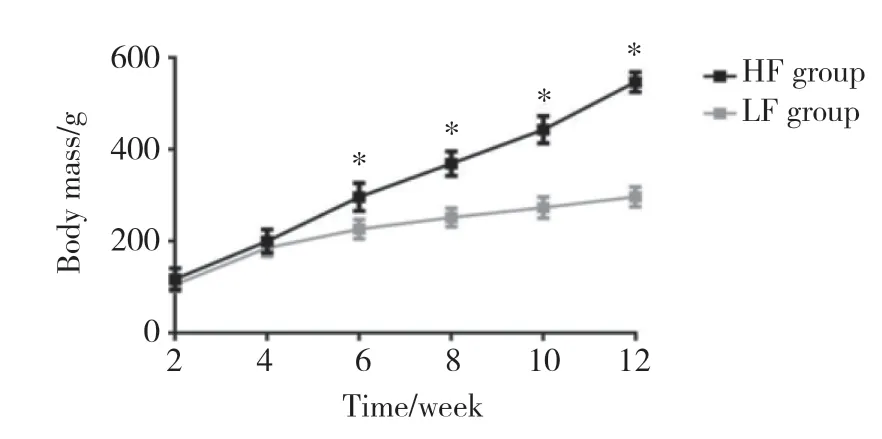
图1 各组大鼠体质量变化情况Fig.1 Comparison of body mass of rats in each group
喂养12周后LF组、HF组、HF+SNI组、LF+SNI组、HF+SNI+PEA组、HF+SNI+GW 6471组50%PWT分别为(13.8±1.10)g、(5.98±1.22)g、(0.11±0.02)g、(0.17±0.40)g、(3.70±1.10)g、(0.07±0.01)g。与LF组比较,HF组大鼠的50%PWT显著降低(P< 0.05);与HF组比较,HF+SNI组大鼠50%PWT进一步降低(P< 0.05);与LF+SNI组比较,HF+SNI组50%PWT也显著降低(P< 0.05);与HF+SNI组比较,HF+SNI+PEA组50%PWT显著提高(P< 0.05),HF+SNI+GW6471组显著降低(P< 0.05)。
2.2 各组大鼠SC中PPARα、Bax、Bcl-2表达比较
结果显示,与LF组比较,HF组SC中凋亡蛋白Bax表达显著提高(P< 0.05),凋亡蛋白Bcl-2表达显著降低(P< 0.05);与HF组比较,HF+SNI组Bax表达进一步上调(P< 0.05),Bcl-2表达进一步下调(P< 0.05)。与HF+SNI组比较,HF+SNI+PEA组SC中凋亡蛋白Bax表达显著降低,Bcl-2表达显著升高(P< 0.05),HF+SNI+GW6471组凋亡蛋白Bax表达显著升高,Bcl-2表达显著降低(P< 0.05)。见表1、图2。
与LF组比较,HF组PPARα表达显著降低(P<0.05);与HF组比较,HF+SNI组PPARα表达进一步降低(P< 0.05)。与HF+SNI组比较,HF+SNI+PEA组SC中PPARα表达显著提高(P< 0.05),而HF+SNI+GW 6471组PPARα表达显著降低(P< 0.05)。见表1、图2。
3 讨论
研究[15]显示,SC中的PPARα途径在介导Nep中起主要作用,PEA能够逆转SNI野生型小鼠的机械性疼痛和热痛觉过敏,PEA已被证明是通过恢复小鼠SNI中的谷氨酸突触功能来改善疼痛。研究[16-17]显示,PEA通过激活PPARα在慢性疼痛中发挥抗炎、镇痛、免疫调节和神经保护作用。
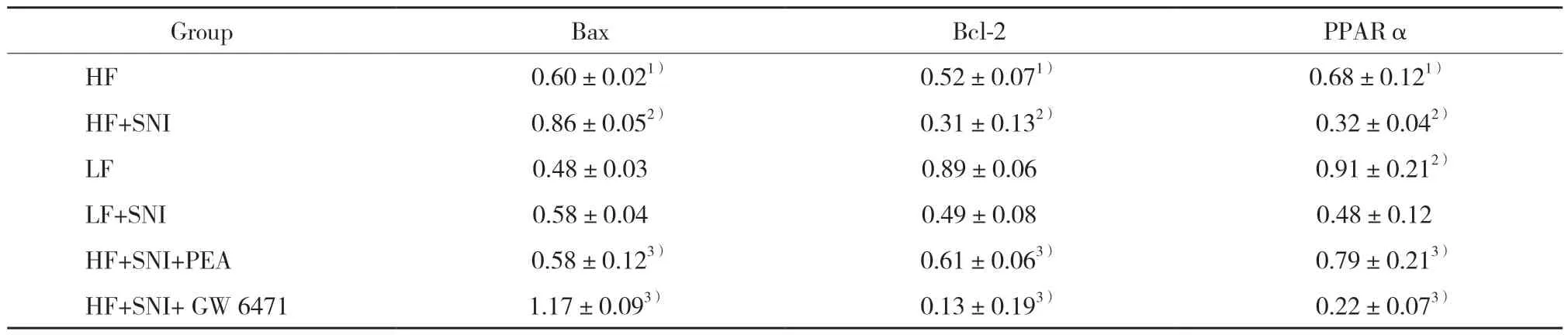
表1 各组SC中PPARα表达、细胞凋亡蛋白Bax和Bcl-2表达的比较Tab.1 Comparison of PPARα expression,apoptosis protein Bax and bcl-2 expression in the SC of each group
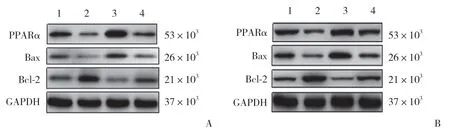
图2 各组大鼠SC中PPARα,细胞凋亡蛋白Bax、Bcl-2表达情况Fig.2 Expression of apoptosis proteins Bax and bcl-2,PPARα in the SC of rats in each group
本研究结果显示,HF诱导的肥胖Nep大鼠机械疼痛敏感性增强,而鞘内注射PPARα激活剂PEA可减轻症状,而鞘内注射PPARα抑制剂(GW6471)则症状加重。HF诱导的肥胖Nep大鼠SC中PPARα表达下降,细胞凋亡因子Bax表达增加,Bcl-2表达降低。而PEA逆转大鼠SC中相关因子的表达。可见鞘内注射PEA可增加HF诱导的肥胖Nep大鼠SC中PPARα活性,导致机械疼痛敏感性降低。相反,鞘内注射GW6471降低SC中PPARα活性,导致机械疼痛敏感度增高。提示HF诱导的肥胖Nep大鼠疼痛增强是SC中PPARα活性降低导致细胞凋亡增加引起的。因此SC中PPARα活性受损是HF诱导的肥胖Nep大鼠疼痛增强的主要原因。
促凋亡蛋白和抑凋亡蛋白共同存在于细胞内,当凋亡信号发出时,2种蛋白平衡模式破坏,促调亡蛋白增多,使细胞发生凋亡[18]。本研究结果显示,HF诱导的肥胖Nep大鼠SC中细胞凋亡过程激活。有研究[19]证实肥胖与氧化应激及慢性炎症反应相关。在肥胖小鼠外周脂肪组织、肝脏、骨骼肌、心肌、血清、关节液等中ROS、SOD、MDA含量显著增加,炎症细胞因子TNF-α、IL-β等明显增加[20-21]。肥胖患者机体激活的免疫细胞产生大量ROS,促进氧化应激、炎症反应等发生,继而引起神经元损伤,引起Nep增强。
综上所述,HF诱导的肥胖大鼠SC中PPARα活性降低。PPARα活性降低导致SC中细胞凋亡蛋白Bax增加,Bcl-2减少,进而促进HF诱导的SNI大鼠疼痛增强。因此推测肥胖诱导的大鼠SC中PPARα活性降低,PPARα可能成为预防和治疗肥胖相关Nep的新靶点。
