软骨藻酸多克隆抗体的制备及间接竞争ELISA检测法的建立
2020-04-17李炳喜叶剑敏
李炳喜, 刘 靖, 李 扬, 叶剑敏
(华南师范大学生命科学学院∥广东省水产健康安全养殖重点实验室, 广州 510631)
赤潮是全球性海洋问题,中国亦是赤潮发生较严重的国家,近30年来,赤潮发生的频率、海域范围,以及导致的经济损失均呈逐年上升趋势[1-2]. 赤潮的危害形式主要有2大类[3]:一类是形成高密度的微藻生物量,导致海域生态系统结构的单一化和不稳定性增加;另一类是通过产生藻毒素(赤潮毒素),藻毒素可以在鱼贝类等海产品中富集,污染水产品,人类食用这类水产品后会出现中毒现象[4]. 根据藻类引发的人类中毒症状和藻源的不同,将藻毒素分为5大类[4-7]:腹泻性贝毒(Diarrheic Shellfish Poisoning, DSP)、西加鱼毒(Ciguatera Fish Poisoning, CFP)、麻痹性贝毒(Paralytic Shellfish Poisoning, PSP)、神经性贝毒(Neurotoxic Shellfish Poisoning, NSP)和记忆缺失性贝毒(Amnesic Shellfish Poisoning, ASP).
软骨藻酸(Domoic Acid, DA)又名多莫酸,是记忆缺失性贝毒的主要成分,是由某些拟菱形藻属(Pseudo-nitzschia)和菱形藻属(Nitzschia)海洋硅藻产生的藻毒素[8]. DA可在鱼贝类的体内富集,并通过食物链传递作用转移给高能量级的动物,造成动物死亡,或转移给人类. 当人体内的毒素达到一定浓度即可产生呕吐、腹泻和腹痛等中毒症状,严重者能导致短期记忆功能的丧失,甚至导致死亡[9-10]. 1987年加拿大爱德华王子岛居民因食用受污染的紫贻贝而造成中毒事故,事故造成100多人中毒,其中3人死亡[11]. 之后,陆续有人和高等动物的DA中毒事件的报道[12-16]. 加拿大率先制定了DA安全限量标准为20 μg/g,以贝肉计[17]. 随着赤潮发生的频率上升和范围扩大,DA对人类健康的潜在威胁越来越严峻,因此迫切需要研发一种快速、便捷和适合基层人员使用的DA检测技术.
目前已建立的DA检测方法主要有:小鼠生物法检测、高效液相色谱(HPLC)、气相色谱、毛细管电泳、免疫学方法和生物传感器法等[4]. 酶联免疫吸附法(ELISA)具有操作简便、快速、可同时检测多个样品、灵敏度高、特异性强、检测限低、结果可目测和既可定性也可定量等优点,被广泛应用于药物、致病微生物和藻毒素等的检测. 因此,本研究在制备DA完全抗原免疫小鼠,获得DA多克隆抗体的基础上,运用间接酶联免疫技术,创建了一种准确快速检测样品中DA含量的间接竞争ELISA法,旨在实现适合基层人员使用的高效、简易、经济和准确的水产品检测试剂盒的开发与应用,为建立完整的赤潮毒素监督体系提供良好的实验基础.
1 材料与方法
1.1 材料
实验用6周龄雌性Balb/c小鼠购于广东省医学实验动物中心;4种待检测的贝类:紫怡贝(青岛)、扇贝(獐子岛)、北极贝(日本)和美国贝(朝鲜)购于广州黄沙海鲜市场;软骨藻酸(DA)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、牛血清白蛋白(BSA)、N-羟基琥珀酰亚胺(NHS)、钥孔血蓝蛋白(KLH)、二甲基亚砜(DMSO)购于Sigma公司;BCA显色试剂盒购于Biosharp公司;HRP标记山羊抗小鼠IgG二抗购于Southern Biotech公司;常规分析纯化学试剂购于天津大茂化学试剂厂;透析袋购于美国Specturm光谱医学公司;Multiskan FC酶标仪购于Thermo公司;超声波细胞粉碎机购于宁波新芝生物科技有限公司;UV2450紫外分光光度计购于日本岛津公司;PB203-N电子天平购于上海梅特勒拖利仪器公司;多孔道移液枪购于德国Eppendorf公司;96孔酶标板购于美国Coning Costar公司.
1.2 方法
1.2.1 偶联抗原的制备 软骨藻酸0.5 mg溶于DMSO中(DA质量浓度为20 mg/mL),加入0.615 mg EDC(15 mg/mL,现配)和0.372 5 mg NHS(15 mg/mL,现配),混合均匀,放于25 ℃恒温摇床中160 r/min反应4 h;后转移至4 ℃冰箱静置2 h;再加入1 mg KLH或BSA(溶于0.1 mL硼酸(3.708 mg/mL)中),混合均匀后置于25 ℃恒温摇床160 r/min,反应3 h;将总体系吸入0.5 mL超滤离心管中,13 000 r/min离心10 min,再将滤管倒扣,4 500 r/min离心2 min收集抗原;用BCA试剂盒检测偶联抗原(完全抗原)的质量浓度,抗原分装后置于-20 ℃冰箱保存备用.
1.2.2 偶联抗原的鉴定 将DA、BSA、KLH、DA-BSA和DA-KLH用DMSO稀释到1 mg/mL,测定200~400 nm波长的紫外光吸收光谱,同时进行SDS-PAGE凝胶电泳检测. 通过比较偶联抗原DA-BSA、DA-KLH与DA、BSA、KLH最大吸收峰的变化和蛋白质相对分子量大小的差异来判断偶联效果. 根据文献[18-19]中的方法,偶联比率=(CDA/MDA)/(CBSA/MBSA),计算偶联蛋白DA-KLH和DA-BSA的偶联比(CDA、CBSA为质量浓度,MDA、MBSA为摩尔浓度).
1.2.3 多克隆抗体的制备及抗血清效价检测 将DA-KLH与弗氏佐剂混合作为抗原,腹腔注射免疫小鼠. 初次免疫选用完全佐剂,每只小鼠注射100 μg偶联蛋白,再次免疫则用不完全佐剂,每只注射50 μg偶联蛋白,每次免疫时间间隔2周,一共免疫4次. 小鼠尾部静脉取血后,4 ℃静置过夜,取上层血清备用. 使用ic-ELISA方法测定抗体效价,计算方法为:抗体效价(units/mL)=1 000/最大速率的一半所对应的抗血清体积[20].
1.2.4 间接竞争ELISA标准曲线的建立
(1)DA-BSA抗原包被质量浓度和多抗稀释比的选择 采用方阵滴定法,用包被液将DA-BSA稀释至8 μg/mL,底物质量浓度纵向倍比稀释加入到96孔酶标板中,A~H行分别为8.000、4.000、2.000、1.000、0.500、0.250、0.125、和0 μg/mL,50 μL/孔,37 ℃温育2 h;封闭液(含0.5% BSA的TTBS)200 μL/孔,37 ℃封闭1 h;1×TTBS洗4次;多抗按1∶100稀释后横向倍比稀释加入到酶标板中,同时设空白对照组,1~12列多抗稀释倍数分别为1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600、1∶51 200、1∶102 400和0,50 μL/孔,37 ℃温育1 h;1×TTBS洗4次;用稀释液将0.7 mg/mL HRP标记的山羊抗小鼠IgG二抗按1∶2 000稀释后加入酶标板中,50 μL/孔,37 ℃温育1 h;1×TTBS洗4次;加入100 μL/孔 显色液后使用酶标仪检测;根据OD、最大速率(vmax)及抗体用量确定最合适包被质量浓度和多抗稀释比.
(2)二抗稀释比的选择 选用最适抗原包被质量浓度和最合适多抗稀释比,用稀释液将0.7 mg/mL HRP标记山羊抗小鼠IgG二抗分别按1∶1 000、1∶2 000、1∶4 000、1∶8 000稀释,50 μL/孔,37 ℃温育1 h,每板同时做阴性对照和空白对照,其余操作不变. 根据各孔OD、最大反应速率(vmax)、孔间差异系数(Cv)及阳性孔与阴性孔OD的比值(P/N)来选择最合适的二抗稀释比.
(3)包被方式的选择 以最适包被质量浓度包被,分别4 ℃过夜、37 ℃温育0.5 h、37 ℃温育1 h、37 ℃温育2 h、25 ℃孵育1 h和25 ℃孵育2 h,多抗和二抗均选用确定的最适稀释比,每板对照组设置同上,其余操作不变,进行ELISA检测. 采用同种方法确定最适的抗原包被方式.
(4)封闭时间的选择 以最适质量浓度及方式包被酶标板,弃掉包被抗原,加入封闭液,200 μL/孔,分别37 ℃温育0.5、1.0、2.0 h,多抗和二抗均选用确定的最适稀释比,每板对照组设置同上,其余操作不变,完成ELISA检测. 采用同种方法选择出最适封闭时间.
(5)多抗和二抗孵育时间的选择 以最适条件包被和封闭后,多抗分别37 ℃孵育0.5、1.0、2.0 h,二抗分别37 ℃孵育0.5、1.0、2.0 h,多抗和二抗使用最适工作质量浓度,每板对照组设置同上,其余操作不变. 采用同种方法确定最适多抗和二抗孵育时间,确定多抗时间后再进行二抗最适孵育时间的选择.
(6)标准曲线的绘制 以确定的最适抗原包被质量浓度、抗原包被方式、封闭时间、多抗质量浓度、二抗质量浓度及多抗与二抗孵育的时间进行ic-ELISA检测. 将一定质量浓度的DA(半抗原)与最适质量浓度多抗混合作为一抗加入酶标板,DA质量浓度分别为10 000、5 000、2 500、1 000、500、100、50、25、10、5.0、2.5、1.0、0 ng/mL(空白对照),完成ELISA检测. 以DA质量浓度为横坐标,抑制率(B/B0×100%)为纵坐标绘制标准曲线,并选择最佳拟合模型,其中B为样品的OD,B0为空白对照的OD.
1.2.5 贝类样品处理及DA的提取和检测 将购买的新鲜贝类用清水洗净,用刀取出贝肉和消化腺,置于网孔细小金属网上沥干. 根据文献[21]的方法,各取5 g不同贝类组织样品,分别加入10 mL匀浆液(甲醇和水按1∶1体积比配置),匀浆后漩涡震荡1 min,超声提取5 min后,4 500 r/min离心20 min. 离心后将上清液用0.22 μm滤膜过滤后转移至透析袋中,使用PEG20000进行浓缩,最后用匀浆液把体积调整至5 mL. 用建立好的最佳ic-ELISA检测方法对样品进行DA含量的检测.
2 结果与分析
2.1 偶联抗原的鉴定
2.1.1 紫外光光谱分析 将DA、BSA、KLH、DA-BSA、DA-KLH稀释到1 mg/mL,通过分析200~400 nm波长紫外光的吸收光谱,比较偶联蛋白DA-BSA、DA-KLH与DA、BSA、KLH的峰形和最大吸收峰(图1、图2). DA、KLH、BSA紫外的最大吸收峰分别为242、280、278 nm,偶联蛋白DA-KLH、DA-BSA光谱的峰型和最大吸收峰明显与DA、KLH和BSA的不同. 这种偶联蛋白、半抗原、载体蛋白之间光谱峰型和最大吸收峰的差异,在紫外的吸光值约等于半抗原与载体蛋白吸光值叠加的特点,表明DA-KLH与DA-BSA均成功偶联.
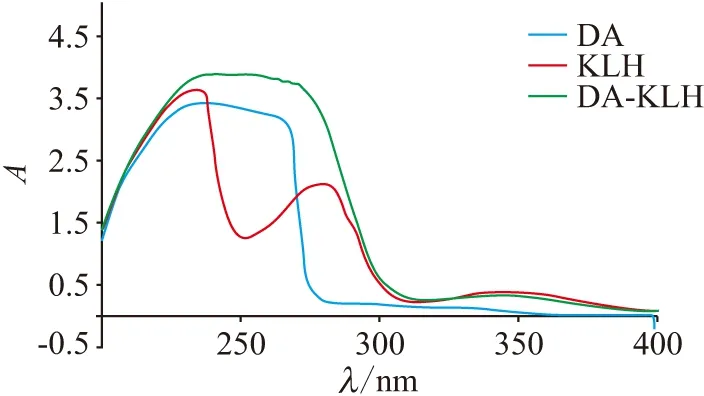
图1 免疫抗原DA-KLH的紫外光谱扫描图
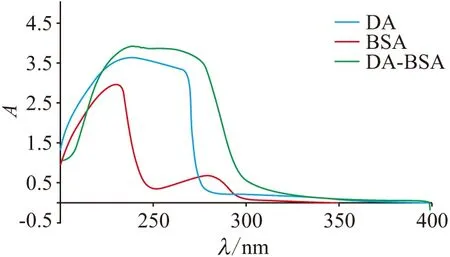
图2 包被抗原DA-BSA的紫外光谱扫描图
2.1.2 DA-BSA的SDS-PAGE鉴定 通过10% SDS-PAGE凝胶电泳检测(图3),第2泳道的偶联蛋白DA-BSA在凝胶图上的条带迁移距离明显滞后于第3泳道的BSA. 因为蛋白质的相对分子量大小与凝胶电泳迁移速率成反比,因此第2泳道的蛋白质的相对分子量明显大于第3泳道的,这说明有部分DA偶联到了BSA上,表明DA-BSA蛋白偶联成功.
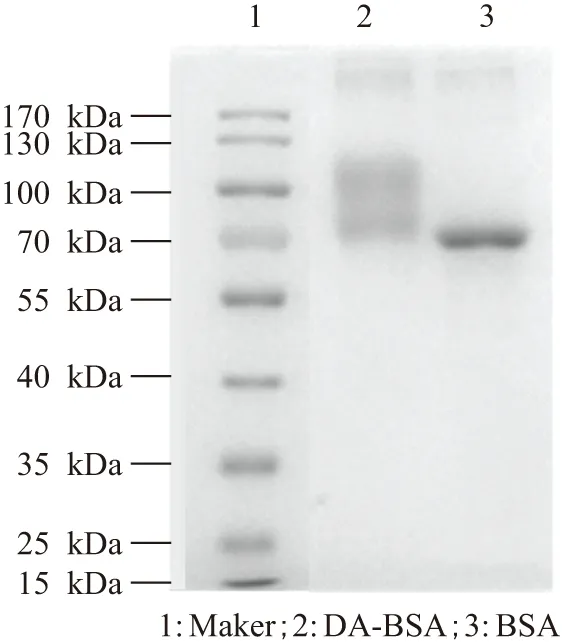
图3 SDS-PAGE的凝胶电泳检测分析
2.1.3 蛋白的质量浓度检测及偶联比的计算 用BCA显色试剂盒检测偶联蛋白的质量浓度. 测得DA-KLH和DA-BSA的质量浓度分别为2.55 mg/mL(总体积450 μL)和3.3 mg/mL(总体积300 μL). 通过计算得到DA-KLH和DA-BSA的偶联比分别为44∶1和16∶1.
2.2 抗血清效价的检测
用ic-ELISA法测小鼠的抗血清效价,其结果如图4所示. 以最大反应速率vmax的50%(13.9 OD/min)处所对应的抗血清体积(0.004 762 μL)即为含有一个单位效价的抗体,小鼠抗血清的效价达到210 000 units/mL.
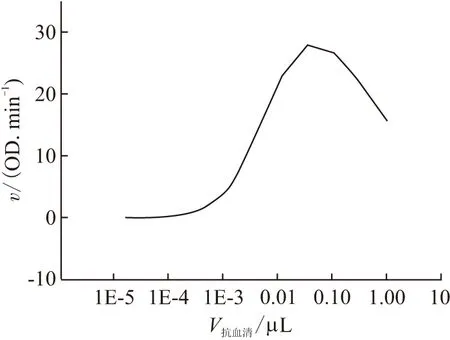
图4 小鼠抗血清效价
2.3 间接ELISA标准曲线的建立
2.3.1 包被抗原质量浓度和多抗使用稀释比的确定 方阵滴定法实验结果如表1所示. 选取OD在1.0左右的抗原包被质量浓度和多抗使用稀释比,从结果(表1)可知:在低抗原质量浓度(0.250、0.500 μg/mL)低多抗稀释比(1∶100、1∶200)时,和高抗原质量浓度(8.000、4.000 μg/mL)高多抗稀释比(1∶12 800、1∶25 600)时OD接近1. 从实验精度控制和节约抗体等综合因素考虑,最终选取0.500 μg/mL和1∶3 200作为各自最适工作质量浓度和稀释比.
2.3.2 二抗稀释比的确定 将二抗用稀释液按不同比例稀释,其实验结果见表2. 当P/N大于2.1时表示实验检测结果可靠,结果显示:使用不同稀释比的二抗,P/N均大于2.1,且随着二抗稀释倍数的增加,平均OD逐渐减小. 以选择平均OD较大、P/N较大、Cv较小、阴性对照及空白对照OD较小和节约抗体的原则,据此选择1∶2 000作为二抗的最适稀释比.
2.3.3 包被条件的确定 底物以疏水作用吸附到酶标板的固相载体上,底物的包被温度、时间都会影响底物与载体的吸附效果,从而影响抗原抗体反应. 不同包被方式结果见表3,其中37 ℃ 包被1 h的平均OD、最大速率与P/N均较大,Cv最小,故选择37 ℃、1 h作为最适包被方式.
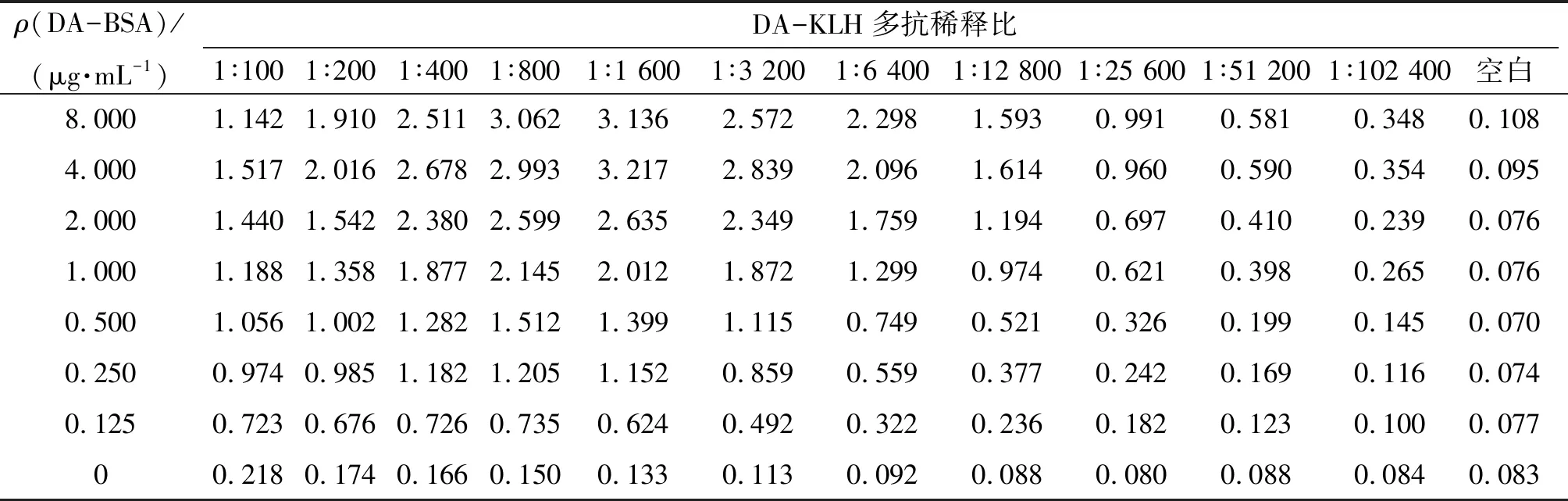
表1 不同包被抗原质量浓度及多抗稀释比的OD
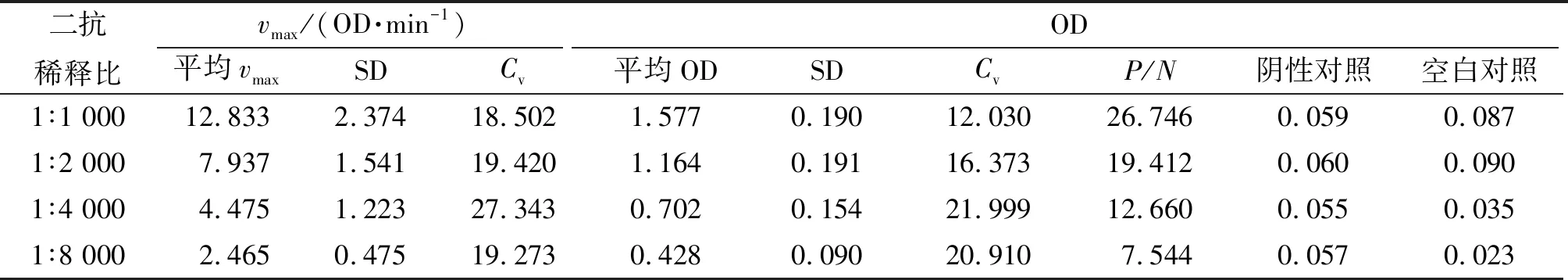
表2 二抗稀释比对vmax和OD的影响
注:Vmax:最大反应速率;SD:方差;OD:吸光值;Cv:孔间差异系数;P/N:及阳性孔与阴性孔OD的比值.
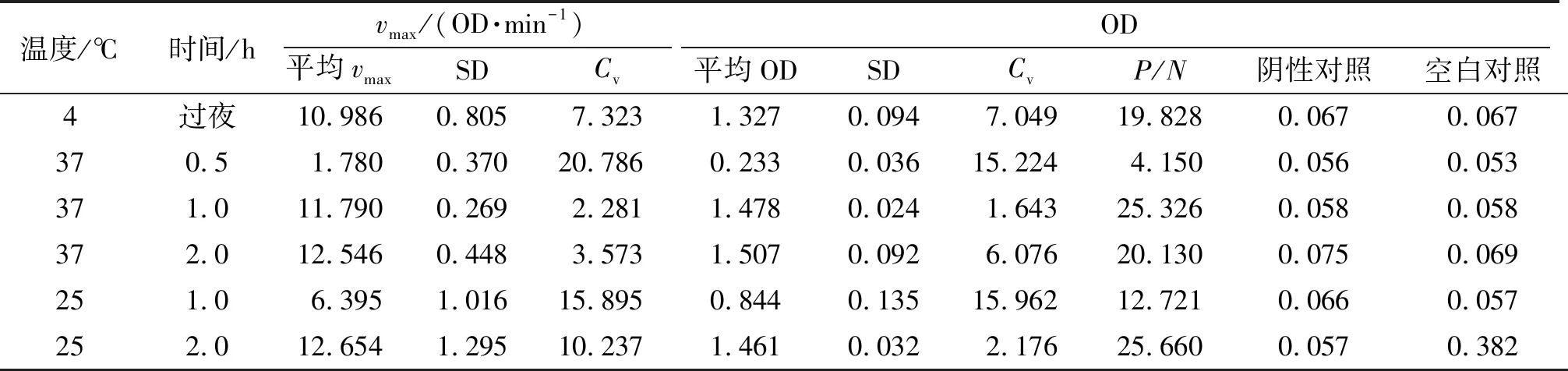
表3 抗原包被温度和时间对vmax和OD的影响
2.3.4 封闭时间的确定 封闭液通过范德华力与酶标板固相载体上未被包被液包被的空隙结合,使空隙被大量与抗原抗体不相关的蛋白占据,从而避免后续反应中有物质再吸附到固相载体上对试验造成干扰. 不同时间封闭的检测结果见表4. 各组之间的最大反应速率和平均OD相近,但封闭0.5 h的P/N最大,其Cv最小,因此选择0.5 h作为最适封闭时间.
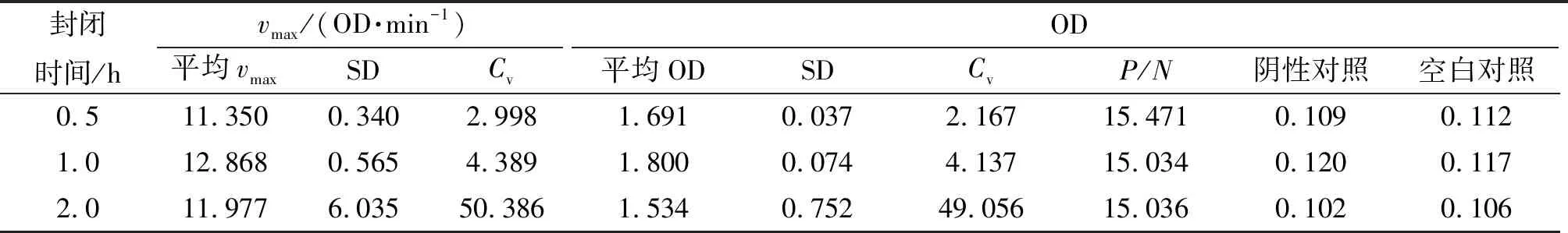
表4 封闭时间对vmax和OD的影响
2.3.5 多抗孵育时间的确定 抗原与抗体是逐渐结合的过程,二者的反应时间对结合效果有一定影响. 多抗不同孵育时间对vmax和OD的影响的结果见表5. 在37 ℃孵育0.5 h的平均OD、P/N最高和Cv最低,所以选择0.5 h作为多抗的最适孵育时间.
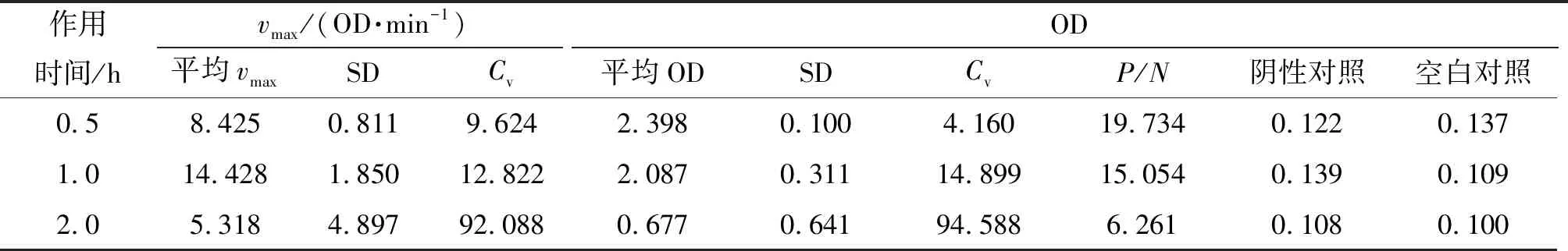
表5 抗原与多抗作用时间对vmax和OD的影响
2.3.6 二抗孵育时间的确定 最适质量浓度二抗、37 ℃温育不同时间的实验结果如表6所示,二抗孵育2 h后其最大速率最大,平均OD、P/N最大和Cv最小,因而选择2 h作为二抗最适孵育时间.
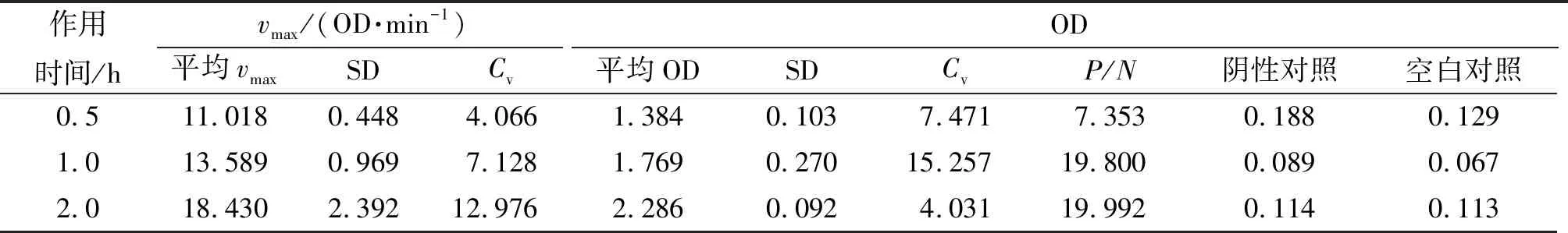
表6 二抗作用时间对vmax和OD的影响
2.3.7 标准曲线的绘制 DA按照10 000、5 000、2 500、1 000、500、250、100、50、25、10、5.0、2.5、1.0、0 ng/mL 稀释,用优化后的最适条件进行ic-ELISA检测,实验结果如表7所示. 以DA质量浓度为横坐标,抑制率(B/B0×100%)为纵坐标绘制曲线,其中B为样品的OD,B0为空白对照的OD. 通过检测发现DA质量浓度在5~2 500 ng/mL之间时,检测结果呈良好的线性关系,曲线斜率较大,选此区域进行线性回归方程拟合(图5),在该区域拟合曲线具有良好的趋势. 最后在该质量浓度区间绘制标准曲线(图6),通过计算得到标准曲线方程式为y=-22.74x+89.04(R2=0.943).
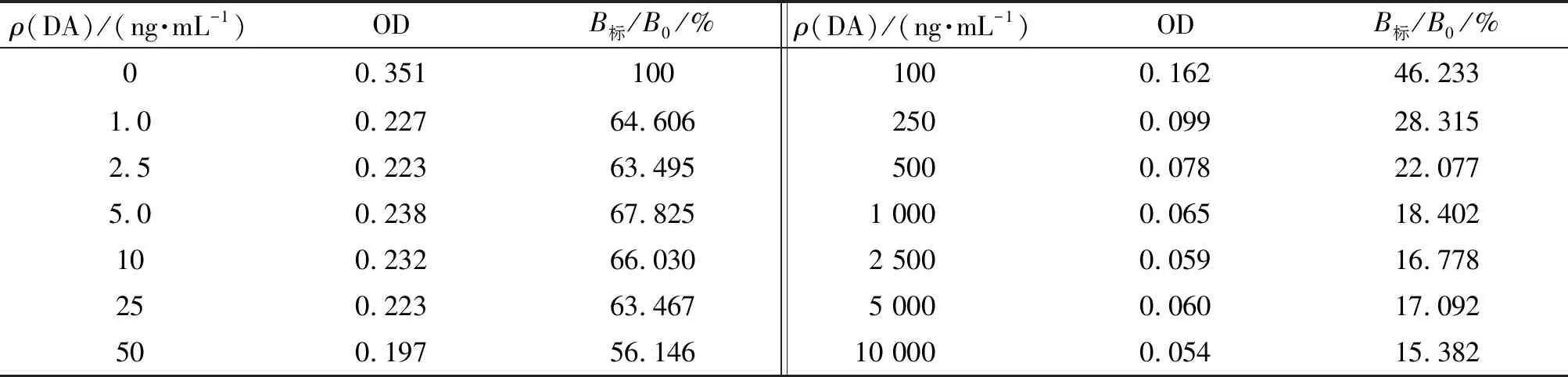
表7 间接ELISA法测定不同质量浓度DA的结果
2.4 贝类样品中DA质量分数的检测
制备好的贝类样品在和制备标准曲线相同的条件下用ic-ELISA法进行检测. 5 g贝类样品组织匀浆浓缩后,用匀浆液调整体积至5 mL,得到质量浓度为1 g/mL的待测样品. 将分光光度计测出的平均OD代入标准曲线方程中计算出匀浆样品中的检测质量浓度后,再根据贝类匀浆样品的质量浓度计算出贝类样品中DA的质量分数,其最终计算结果如表8所示.
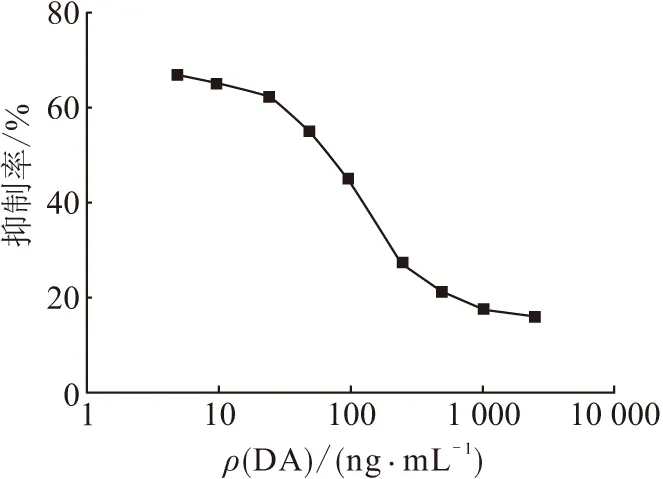
图5 间接竞争ELISA法测定DA质量浓度的标准曲线拟合曲线
Figure 5 The fitting DA curve with ic-ELISA
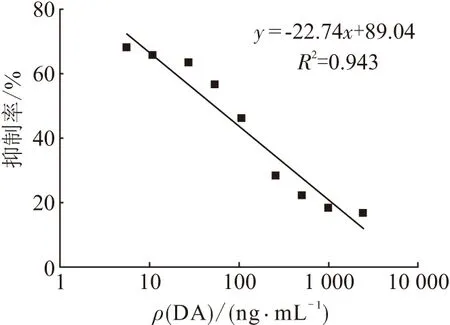
图6 间接竞争ELISA法测定DA质量浓度的标准曲线
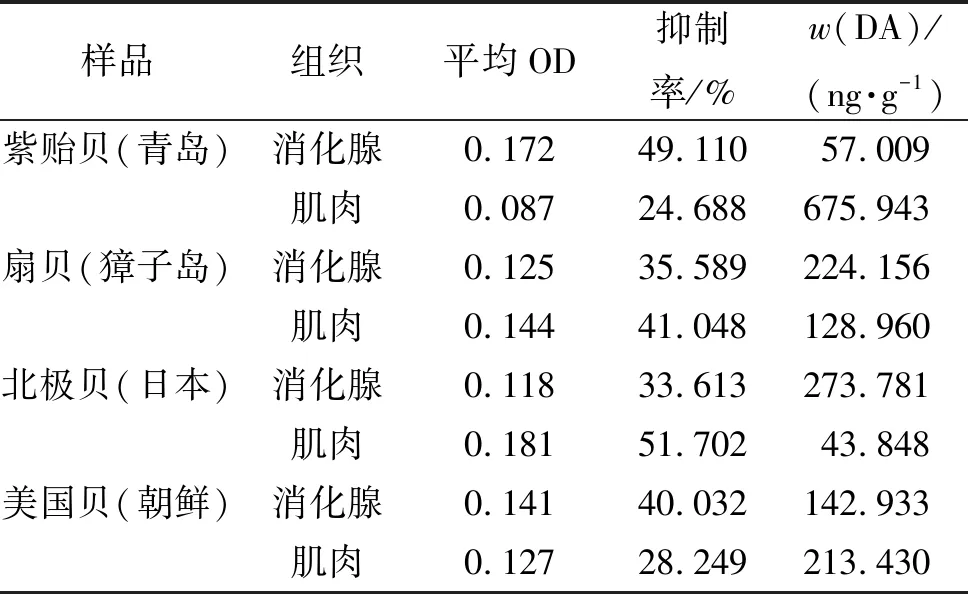
表8 贝类样品中DA质量分数的检测
3 讨论
随着不断增长的赤潮事件,藻毒素污染日益严重[1-2],时刻危害着水生动物和人类生命健康安全[11-16,22]. 鉴于DA对人类潜在的威胁较大,生活在海边的人们更是易受害群体,因此建立一个简单、快速、准确的DA检测方法尤为必要.
DA是小分子半抗原,只有反应原性,不具备免疫原性,其必须与大分子载体蛋白偶联制备成完全抗原,才能刺激机体产生免疫应答反应[23]. 目前已经有多种制备完全抗原的偶联方法[24-26]. 本研究运用活泼酯法[27],通过EDC和NHS来提高偶联效率,将DA分别与载体蛋白KLH和BSA偶联. 通过计算得出DA-KLH和DA-BSA的偶联比分别为44∶1和16∶1,高于其它研究[23]. 免疫小鼠后获得的抗体效价高达210 000 units/mL(图4),进一步证实了偶联蛋白的良好效果,为后续检测方法的建立奠定了基础.
目前检测软骨藻酸最成熟的方法是高效液相色谱法[28]. HPLC检测快速灵敏、检测限低,非常适用于科研单位对产品的精细检测,但是高效液相色谱仪过于昂贵,检测过程中对操作人员与样品预处理的要求较高,基层养殖与检测单位条件有限,往往无法实现用HPLC对样品的大规模检测[29]. 免疫胶体金技术是近年来发展最快的检测手段之一[30],因其简单快速、便于携带、对地域及使用人员不受限、无需仪器和试剂、价格低廉等优点而被广泛应用,但是免疫胶体金技术只能进行样品含量的定性检测,无法对样品精确定量,灵敏度较低. 而本实验选用的ic-ELISA是将抗原-抗体特异性结合,通过酶与底物的催化作用发生显色反应的一种免疫学检测技术. 在样品检测方面具有高效、操作简便、灵敏度高、可批量和定量检测等优点,因此建立一个标准化ELISA检测方法的实践性更强. 在ELISA反应中,由于抗原、抗体的使用量有最佳搭配比的反应特性,酶制剂催化效果易受环境影响和整体实验时长等多方面因素的考虑,本研究在获得软骨藻酸抗血清的基础上,对间接竞争ELISA检测反应中各个因素逐步进行优化,根据反应中抗体使用量、反应时长、各孔OD、最大速率、孔间差异系数Cv及阳性孔与阴性孔OD的比值(P/N)等来选择最适工作条件. 在确定的最佳条件基础上,对1 ng/mL~10 μg/mL范围内的DA进行检测(表7),发现在5~2 500 ng/mL范围内检测结果有良好的线性趋势(图5),通过线性回归方程的拟合,成功建立了可在该质量浓度范围内检测DA质量浓度的ELISA标准曲线(图6). 得出其标准曲线方程式为y=-22.74x+89.04 (R2=0.943).
市场购买的贝类样品DA质量分数检测显示:4种贝类样品的消化腺和肌肉中均检测出一定量的DA,样品总检出率高达100%(表8),比陈西平等[31](检出率50%)、吉薇等[21](检出率82%)以及文献[32-34]中的检出率都要高. 这可能是由于近年来全球日益严重的赤潮现象造成的. 4种贝类样品的检出质量分数在43.848 ~675.943 ng/g之间(表8),其中紫贻贝肌肉中检出质量分数最高为675.943 ng/g,而北极贝肌肉中检出质量分数最低为43.848 ng/g,均远低于加拿大制定的安全限量标准20 μg/g[17]. 这为DA检测试剂盒的研发与应用提供了直接实验基础,也进一步提高了基层人员能定量检测海产品中DA质量分数的可能性. 在一线基层人员的使用中,由于没有足够条件开展样品的透析浓缩等预处理,水产品组织样品仅能进行简单的匀浆过滤就检测. 这种简单处理可能会给检测结果带来一定的偏差,比如小块组织的残留会导致假阳性的增加. 关于一线基层人员使用条件的摸索和优化,将会在后续的研究中开展.
本研究的不足之处在于:DA质量分数检测的最低限为5 ng/mL. 最低限检测的灵敏度有待进一步提高,或许通过制备DA的单克隆抗体来进行检测能解决这一问题.
