miR-495-3p通过调控HDAC9表达对缺氧/复氧诱导的神经细胞凋亡及炎症反应的影响
2020-04-16郭延兵姚庆和王新军
郭延兵,姚庆和,王新军
·论著·
miR-495-3p通过调控HDAC9表达对缺氧/复氧诱导的神经细胞凋亡及炎症反应的影响
郭延兵,姚庆和,王新军
471009 洛阳,郑州大学附属洛阳中心医院神经外科(郭延兵、姚庆和);470000,郑州大学第五附属医院神经外科(王新军)
探讨微小 RNA-495-3p(miR-495-3p)对缺氧/复氧(H/R)诱导的神经细胞凋亡及炎症反应的影响及机制。
体外培养神经母细胞瘤细胞 SK-N-SH,建立 H/R 损伤细胞模型。实验分组:Con 组、H/R 组、H/R + miR-NC 组、H/R + miR-495-3p 组、H/R + si-NC 组、H/R + si-HDAC9 组、H/R + miR-495-3p + pcDNA 组、H/R + miR-495-3p + pcDNA-HDAC9 组。采用qRT-PCR与Western blot分别检测细胞中 miR-495-3p、组蛋白去乙酰化酶 9(HDAC9)的表达;采用膜联蛋白 V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)双染法检测细胞凋亡情况;采用酶联免疫吸附(ELISA)法检测炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素 6(IL-6)水平;双荧光素酶报告基因检测 miR-495-3p 与 HDAC9 的靶向关系;Western blot 检测 B 淋巴细胞瘤-2 相关蛋白(Bax)、B 淋巴细胞瘤-2(Bcl-2)蛋白表达水平。
与 Con 组比较,H/R 组神经细胞中 miR-495-3p 的表达水平显著降低(< 0.05),HDAC9 的表达水平显著升高(< 0.05);H/R 处理后细胞凋亡率升高(< 0.05),细胞中 Bax 蛋白表达水平升高(< 0.05),TNF-α、IL-1β、IL-6 水平升高(< 0.05),而 Bcl-2 蛋白表达水平降低(< 0.05);miR-495-3p 过表达或抑制 HDAC9 表达后细胞凋亡率降低(< 0.05),Bax 蛋白表达水平降低(< 0.05),TNF-α、IL-1β、IL-6 水平降低(< 0.05),而 Bcl-2 蛋白表达水平升高(< 0.05);miR-495-3p 可靶向结合到 HDAC9 的 3′UTR 区,并下调 HDAC9 的表达;HDAC9 过表达可逆转 miR-495-3p 过表达对 H/R 诱导的神经细胞凋亡及炎症因子表达水平的抑制作用。
miR-495-3p 可通过靶向下调 HDAC9 的表达抑制 H/R 诱导的神经细胞凋亡及抑制炎性因子的产生进而对神经细胞发挥保护作用。
miR-495-3p; HDAC9; 缺氧/复氧; 神经细胞; 凋亡; 炎症
缺氧缺血引起的脑组织功能损伤是常见病理过程,脑组织缺氧缺血可促使神经功能障碍,研究表明神经细胞凋亡、炎症反应是引起神经功能障碍的重要原因[1]。微小 RNA(microRNA,miRNA)是一种内源性非编码小 RNA,miRNA 可参与调控细胞增殖、分化、凋亡等多种生理过程,还可参与多种疾病发生及发展过程[2]。既往研究显示部分 miRNA 在脑组织中异常表达,并可参与神经细胞凋亡等过程[3-4]。但关于其具体作用机制尚未完全阐明。研究表明微小 RNA-495-3p(microRNA-495-3p,miR-495-3p)在脂多糖刺激的人牙周膜细胞(hPDLC)中表达下调,miR-495-3p 过表达可抑制炎症因子的产生进而减缓疾病进展[5]。但 miR-495-3p 对神经细胞凋亡及炎症反应的影响尚未可知。TargetScan 预测显示组蛋白去乙酰化酶 9(histone deacetylases 9,HDAC9)可能是 miR-495-3p 的靶基因,研究表明 HDAC9 在 ox-LDL 诱导的内皮细胞凋亡中表达上调[6]。相关报道指出 HDAC9 在神经元细胞损伤中高表达,下调 HDAC9 的表达可减少神经细胞凋亡[7]。但 miR-495-3p 是否可通过调控 HDAC9 的表达从而影响神经细胞凋亡及炎症反应尚未可知。本研究通过体外建立缺氧/复氧(hypoxia/reoxygenation,H/R)神经细胞损伤模型,探讨 miR-495-3p 对神经细胞凋亡及炎症反应的影响及其机制,为明确脑缺氧神经损伤发生机制及 miR-495-3p 在神经细胞损伤中的作用提供参考依据。
1 材料与方法
1.1 材料与试剂
神经母细胞瘤细胞 SK-N-SH 购自美国 ATCC公司;RPMI1640 培养基购自上海康朗生物科技有限公司;miR-495-3p 模拟物(mimics)及阴性对照(miR-NC)、HDAC9 小干扰 RNA(si-HDAC9)、乱序无意义阴性对照序列(si-NC)、miR-495-3p 特异性寡核苷酸抑制剂(anti-miR-495-3p)及其阴性对照(anti-miR-NC)均购自广州锐博生物科技有限公司;pcDNA3.1 购自上海索宝生物科技有限公司;Lipofectamine2000 购自上海阳光生物科技有限公司;膜联蛋白 V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡试剂盒购自大连美仑生物技术有限公司;Trizol、反转录及荧光定量 PCR 试剂均购自美国 Thermo Fisher 公司;TNF-α、IL-1β、IL-6 检测试剂盒购自南京建成生物工程研究所;RIPA 裂解液、二喹啉甲酸(bicinchoninicacid,BCA)蛋白定量检测试剂盒、增强型化学发光试剂(electrochemiluminescence,ECL)均购自美国 Sigma 公司;兔抗鼠 HDAC9 抗体购自北京百奥莱博科技有限公司;兔抗鼠 B 淋巴细胞瘤-2 相关蛋白(Bcl-2-associated X protein,Bax)、B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体购自美国 Abcam 公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 缺氧/复氧(H/R)模型建立 SK-N-SH 细胞培养于含有 10% 胎牛血清的 RPMI1640 培养基,置于 37 ℃、体积分数 5% CO2培养箱内进行培养,待细胞稳定传代 3 ~ 5 代后收集对数生长期细胞进行后续实验。采用 95% N2-5% CO2混合气体饱和 15 min 培养基,置于缺氧盒内并充入 95% N2-5% CO2混合气体(1 L/min 流速),出口氧气浓度达到 1% 时停止通气,闭紧进气管与出气管,缺氧环境培养 4 h,弃缺氧液后加入新鲜培养基,置于 37 ℃、体积分数 5% CO2培养箱内继续培养2 h 复氧,建立 H/R 损伤细胞模型[8]。
1.2.2 实验分组 取对数生长期 SK-N-SH 细胞,按照随机数字表法随机分为 Con 组(正常培养的 SK-N-SH 细胞)、H/R 组(缺氧/复氧处理的 SK-N-SH 细胞)、H/R + miR-NC 组(miR-NC 转染至SK-N-SH 细胞 48 h 后进行缺氧/复氧处理)、H/R + miR-495-3p 组(miR-495-3p mimics 转染至 SK-N-SH 细胞 48 h 后进行缺氧/复氧处理)、H/R + si-NC 组(si-NC 转染至 SK-N-SH 细胞 48 h 后进行缺氧/复氧处理)、H/R + si-HDAC9 组(si-HDAC9 转染至 SK-N-SH 细胞 48 h 后进行缺氧/复氧处理)、H/R + miR-495-3p + pcDNA组(miR-495-3p mimics 与 pcDNA 共转染至 SK-N-SH 细胞 48 h后进行缺氧/复氧处理)、H/R + miR-495-3p + pcDNA-HDAC9 组(miR-495-3p mimics 与 pcDNA-HDAC9 共转染至 SK-N-SH 细胞 48 h 后进行缺氧/复氧处理),严格按照 Lipofectamine2000 转染试剂说明书进行操作。
1.2.3 实时荧光定量聚合酶链反应检测细胞miR-495-3p、HDAC9 mRNA 表达水平 各组对数生长期细胞,RNA 提取:加入 Trizol 裂解细胞提取细胞总 RNA,冰上孵育 5 min,加入 200 μl 氯仿,室温放置 5 min,经 12 000 r/min 转速离心 15 min,吸取水相层,加入 500 μl 异丙醇,室温放置 20 min,12 000 r/min 转速离心 15 min,弃上清,加入 75% 乙醇混合,12 000 r/min 转速离心 5 min,弃上清,RNA 沉积于管底,置于超净工作台晾干,加入适量无 RNA 酶水,利用紫外分光光度计检测 RNA 浓度,置于–80 ℃超低温冰箱保存。反转录:按照反转录试剂盒将总 RNA 合成 cDNA。miR-495-3p 正向引物5' ACACTCCAGCTGGGAA ACAAACATGGTGCA 3',反向引物5' TGGTGTCG TGGAGTCG 3';U6 正向引物 5' CTCGCTTCGGC AGCACA 3',反向引物5' AACGCTTCACGAATT TGCGT 3';HDAC9 正向引物5' GCAACTCCGAC ATCGGTAAG 3',反向引物 5' GCCCAAGGACATC GAGTTT 3';GAPDH 正向引物 5' AACGGATTTG GTCGTATTG 3',反向引物5' GGAAGATGGTGAT GGGATT 3',引物均由生工生物工程(上海)股份有限公司合成。qRT-PCR 反应:根据试剂盒说明书配置反应体系,置于实时荧光定量 PCR 仪检测各基因 Ct 值,反应条件:95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共循环 40 次。miR-495-3p 以 U6 为内参,HDAC9 以 GAPDH 为内参,采用 2-ΔΔCt法计算 miR-495-3p、HDAC9 mRNA 相对表达量。
1.2.4 流式细胞术检测细胞凋亡 收集各组细胞,PBS 洗涤,胰蛋白酶消化,1000 r/min 转速离心 5 min,加入 PBS 洗涤,加入 1 ml 结合缓冲液,1000 r/min 转速离心 5 min,加入 200 μl 结合缓冲液,加入 5 μl Annexin V-FIT 与 5 μl PI,室温避光孵育 20 min,加入 400 μl 结合缓冲液置于流式细胞仪检测细胞凋亡。
1.2.5 酶联免疫吸附(ELISA)法检测炎症因子表达水平 采用酶联免疫吸附(ELISA)法检测各组细胞培养液中炎症因子 TNF-α、IL-1β、IL-6 的水平,严格按照试剂盒说明书进行操作。
1.2.6 荧光素酶报告基因检测 TargetScan 预测显示 miR-495-3p 与 HDAC9 的 3'UTR 存在结合位点,将含有结合位点与突变位点的 HDAC9-3'UTR片段分别插入荧光素酶报告基因载体构建野生型载体 WT-HDAC9 与突变型载体 MUT-HDAC9,取生长状态良好的 SK-N-SH 细胞,分别将WT-HDAC9、MUT-HDAC9 与 miR-NC、miR-495-3p mimics 共转染至 SK-N-SH 细胞,置于 37 ℃、体积分数 5% CO2培养箱内继续培养 48 h,检测各组细胞荧光素酶活性。
1.2.7 蛋白免疫印迹检测HDAC9、Bax、Bcl-2 蛋白表达 取各组对数生长期细胞,加入RIPA 裂解液提取细胞总蛋白,采用 BCA 法测定蛋白浓度,经SDS-PAGE电泳分离蛋白,反应结束后将分离的蛋白凝胶转移至 PVDF 膜,封闭后分别加入各蛋白一抗稀释液,TBST 洗膜,加入二抗稀释液,TBST 洗膜,滴加 ECL 显影,应用凝胶成像系统及 Quantity one 软件检测条带灰度值。
1.3 统计学处理
2 结果
2.1 miR-495-3p 和 HDAC9 在缺氧/复氧诱导的神经细胞损伤中的表达
与 Con 组比较,H/R 组神经细胞中 miR-495-3p的表达水平显著降低(< 0.05),HDAC9 mRNA及蛋白表达水平均显著升高(< 0.05),见图 1、表 1。
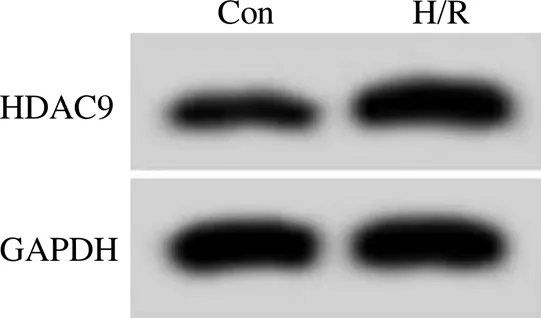
图 1 HDAC9 蛋白表达
Figure 1 Expression of HDAC9
2.2 miR-495-3p 过表达对缺氧/复氧诱导的神经细胞凋亡的影响
实验结果显示,与 Con 组比较,H/R 组神经细胞凋亡率显著升高(< 0.05),Bax蛋白相对表达量显著升高(< 0.05),Bcl-2 蛋白相对表达量显著降低(< 0.05);与 H/R + miR-NC 组相比,H/R + miR-495-3p 组神经细胞凋亡率显著降低(< 0.05),Bax 蛋白相对表达量显著降低(< 0.05),Bcl-2 蛋白相对表达量显著升高(< 0.05),见图 2、表 2。
2.3 miR-495-3p 过表达对缺氧/复氧诱导的神经细胞炎症因子表达的影响
相对于 Con 组,H/R 组神经细胞炎症因子 TNF-α、IL-1β、IL-6 水平均显著升高(< 0.05);与 H/R + miR-NC 组比较,H/R + miR-495-3p 组神经细胞炎症因子 TNF-α、IL-1β、IL-6 水平均显著降低(< 0.05),见表 3。
2.4 抑制 HDAC9 表达对缺氧/复氧诱导的神经细胞凋亡和炎症因子表达的影响
Western blot 检测结果显示,与 H/R + si-NC 组相比,H/R + si-HDAC9 组神经细胞中HDAC9 蛋白相对表达量显著降低(< 0.05),提示成功降低神经细胞中 HDAC9 的高表达水平。与 H/R + si-NC 组比较,H/R + si-HDAC9 组神经细胞凋亡率显著降低(< 0.05),Bax 蛋白相对表达量显著降低(< 0.05),Bcl-2 蛋白相对表达量显著升高(< 0.05),炎症因子 TNF-α、IL-1β、IL-6 水平均显著降低(< 0.05),见图 3、表 4。
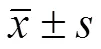
表 1 miR-495-3p 和 HDAC9 在缺氧/复氧诱导的神经细胞损伤中的表达(,n = 9)
注:与Con 组比较,*< 0.05。
Note: Compared with Con group,*< 0.05.

图 2 miR-495-3p 过表达对缺氧/复氧诱导的神经细胞凋亡的影响(A:凋亡相关蛋白表达;B:细胞凋亡流式图)
Figure 2 Effect of miR-495-3p overexpression on neuronal apoptosis induced by hypoxia/reoxygenation (A: Apoptosis-related protein expression; B: Apoptosis flow cytometry)
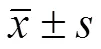
表 2 miR-495-3p 过表达对缺氧/复氧诱导的神经细胞凋亡的影响(,n = 9)
注:与Con 组比较,*< 0.05;与H/R + miR-NC 组比较,#< 0.05。
Notes: Compared with Con group,*< 0.05; compared with H/R + miR-NC group,#< 0.05.
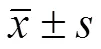
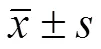

分组 GroupsTNF-αIL-1βIL-6 Con53.47 ± 6.8531.48 ± 5.3267.48 ± 7.32 H/R874.32 ± 56.17*551.23 ± 39.47*1247.56 ± 84.28* H/R + miR-NC895.47 ± 67.32564.87 ± 41.651286.87 ± 89.48 H/R + miR-495-3p198.36 ± 18.44#157.32 ± 14.22#397.54 ± 37.65# F872.088759.540814.810 P 0.000 0.000 0.000
注:与Con 组比较,*< 0.05;与H/R + miR-NC 组比较,#< 0.05。
Notes: Compared with Con group,*< 0.05; compared with H/R + miR-NC group,#< 0.05.
2.5 miR-495-3p 靶向调控 HDAC9 的表达
TargetScan 预测显示 HDAC9 的 3'UTR 中含有与 miR-495-3p 互补的核苷酸序列,见图 4A。双荧光素酶报告实验结果显示,转染突变型载体 MUT-HDAC9 实验中,miR-495-3p 组与 miR-NC 组比较,荧光素酶活性差异无显著性(>0.05);转染野生型载体 WT-HDAC9 实验中,miR-495-3p 组与 miR-NC 组比较,荧光素酶活性明显受到抑制(< 0.05),见表 5。Western blot 检测结果显示,与 miR-NC 组比较,miR-495-3p 组神经细胞中HDAC9 蛋白相对表达量显著降低(< 0.05);与 anti-miR-NC 组比较,anti-miR-495-3p 组神经细胞中 HDAC9 蛋白相对表达量显著升高(< 0.05),见图 4B、表 6。
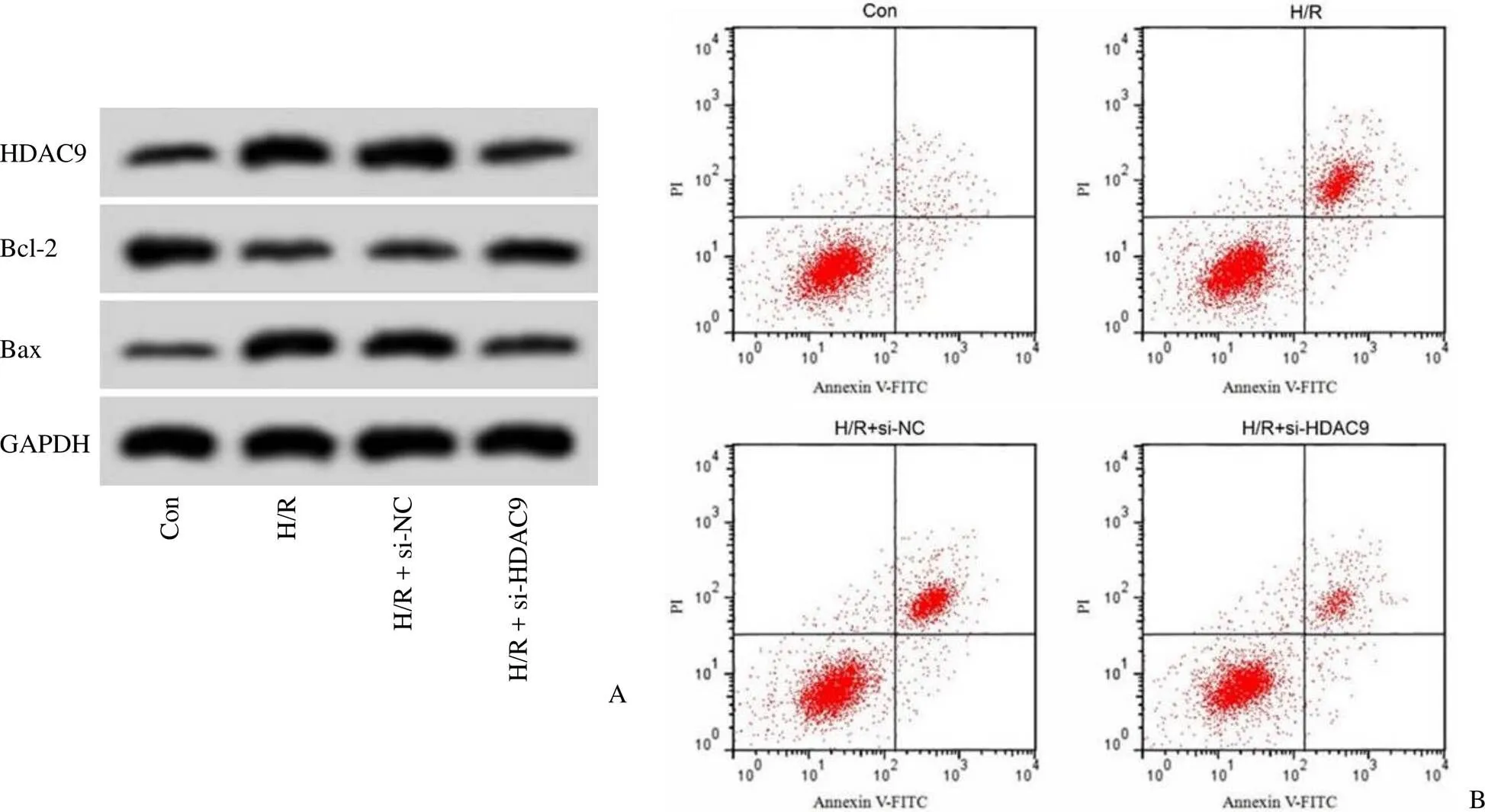
图 3 抑制 HDAC9 表达对缺氧/复氧诱导的神经细胞凋亡的影响(A:HDAC9 和凋亡相关蛋白表达;B:细胞凋亡流式图)
Figure 3 Effect of inhibition of HDAC9 expression on hypoxia/reoxygenation-induced neuronal apoptosis(A: HDAC9 and apoptosis-related protein expression; B: Apoptosis flow cytometry)
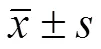
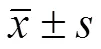

分组GroupsHDAC9 蛋白HDAC9 protein凋亡率(%)Apoptosis rate (%)Bcl-2 蛋白Bcl-2 proteinBax 蛋白Bax proteinTNF-α(μg/ml)IL-1β(μg/ml)IL-6(μg/ml) Con0.39 ± 0.046.87 ± 0.690.73 ± 0.070.24 ± 0.0361.32 ± 6.4739.78 ± 5.2169.48 ± 7.36 H/R0.88 ± 0.07*22.48 ± 2.27*0.31 ± 0.03*0.66 ± 0.06*863.98 ± 49.57*574.32 ± 44.74*1226.54 ± 88.45* H/R + si-NC0.89 ± 0.0824.18 ± 2.630.28 ± 0.030.69 ± 0.06873.54 ± 51.44583.14 ± 49.761238.47 ± 79.32 H/R + si-HDAC90.51 ± 0.05#13.54 ± 1.37#0.55 ± 0.05#0.39 ± 0.04#234.87 ± 31.12#198.45 ± 19.66#487.68 ± 41.22# F153.097163.037176.967174.8041049.069549.225754.325 P 0.000 0.000 0.000 0.000 0.000 0.000 0.000
注:与Con 组比较,*< 0.05;与H/R+si-NC 组比较,#< 0.05。
Notes: Compared with Con group,*< 0.05; compared with H/R + si-NC group,#< 0.05.

图 4 miR-495-3p 靶向调控 HDAC9 的表达(A:HDAC9 的 3'UTR 中含有与 miR-495-3p 互补的核苷酸序列;B:HDAC9 蛋白表达)
Figure 4 miR-495-3p targets HDAC9 expression (A: The 3'UTR of HDAC9 contains a nucleotide sequence complementary to miR-495-3p; B: The expression of HDAC9)
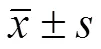
表 5 双荧光素酶报告实验(,n = 9)
注:与 miR-NC 组比较,*< 0.05。
Note: Compared with miR-NC group,*< 0.05.
2.6 HDAC9 过表达逆转了 miR-495-3p 过表达对缺氧/复氧诱导的神经细胞凋亡和炎症因子表达的作用
与 H/R + miR-495-3p + pcDNA 组相比,H/R + miR-495-3p + pcDNA-HDAC9 组神经细胞凋亡率显著升高(< 0.05),Bax 蛋白相对表达量显著升高(< 0.05),Bcl-2 蛋白相对表达量显著降低(< 0.05),炎症因子 TNF-α、IL-1β、IL-6 水平均显著升高(< 0.05),见图 5、表 7。
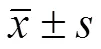
表 6 miR-495-3p 调控 HDAC9 蛋白的表达(,n = 9)
注:与miR-NC 组比较,*< 0.05;与anti-miR-NC 组比较,#< 0.05。
Notes: Compared with miR-NC group,*< 0.05; compared with anti-miR-NC group,#< 0.05.
3 讨论
缺血性脑疾病已严重威胁人类生命安全,脑部缺氧缺血性损伤是诱发中枢神经元细胞凋亡的主要原因,其中脑动脉硬化及脑出血等均可导致脑神经细胞缺氧缺血[9]。研究表明,部分miRNA 可参与血管生成及细胞生长等过程[10-11]。因而深入研究 miRNA 与神经细胞凋亡的相关性可为缺血性脑疾病治疗提供潜在靶点。
miR-495-3p 在心肌缺血再灌注大鼠中的表达显著降低,LncRNA NEAT1 通过抑制miR-495-3p的表达加重心肌缺血再灌注损伤[12]。研究表明,LPS诱导的牙周膜细胞中miR-495-3p 的表达水平明显降低,并可参与疾病发生发展过程[13]。相关报道指出,miR-495-3p 可能通过靶向抑制 S1PR3 的表达而负调控 EMT 进程从而减轻肺纤维化[14]。但 miR-495-3p 在缺氧缺血性脑部疾病中的表达尚未可知。本研究通过缺氧/复氧诱导神经细胞建立神经细胞损伤模型,结果显示 H/R 诱导的神经细胞中 miR-495-3p 的表达水平显著降低,与上述研究报道结果相似。进一步研究发现,H/R 可提高神经细胞凋亡率,提示 H/R 可能通过抑制 miR-495-3p 的表达从而促进神经细胞凋亡,进而参与神经细胞损伤过程。研究表明 Bax 表达水平升高可促进细胞凋亡,Bcl-2 表达水平升高可抑制细胞凋亡,Bax、Bcl-2 可共同调控细胞凋亡过程[15]。本研究结果显示 H/R 诱导的神经细胞中 Bax 的表达水平显著升高,Bcl-2 的表达水平显著降低,而 miR-495-3p 过表达后神经细胞凋亡率显著降低,Bax 的表达水平显著降低,Bcl-2 的表达水平显著升高,说明 miR-495-3p 过表达可逆转 H/R 对神经细胞凋亡的促进作用。提示 miR-495-3p 可能通过上调 Bcl-2 的表达及下调 Bax 的表达从而抑制 H/R 诱导的神经细胞凋亡。有研究表明,中枢神经系统的炎症反应是引发脑组织相关疾病的重要原因之一,炎症因子 TNF-α、IL-1β、IL-6 在脑缺血再灌注损伤中发挥重要作用,降低炎症因子水平可保护神经细胞[16-17]。本研究结果显示,H/R 诱导的神经细胞中炎症因子 TNF-α、IL-1β、IL-6 水平显著升高,而 miR-495-3p 过表达后可明显降低 TNF-α、IL-1β、IL-6 水平,提示 miR-495-3p 可能通过降低炎症因子水平从而抵抗 H/R 诱导的神经细胞炎症反应。

图 5 HDAC9 过表达逆转了 miR-495-3p 过表达对缺氧/复氧诱导的神经细胞凋亡的作用(A:HDAC9 和凋亡相关蛋白表达;B:细胞凋亡流式图)
Figure 5 HDAC9 overexpression reverses miR-495-3p overexpression on hypoxia/reoxygenation-induced neuronal apoptosis (A: HDAC9 and apoptosis-related protein expression; B: Apoptosis flow cytometry)
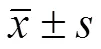
表 7 HDAC9 过表达逆转了 miR-495-3p 过表达对缺氧/复氧诱导的神经细胞凋亡和炎症因子表达的作用(,n = 9)
注:H/R + miR-NC 组比较,*< 0.05;与H/R + miR-495-3p + pcDNA 组比较,#< 0.05。
Notes: Compared with H/R + miR-NC group,*< 0.05; compared with H/R + miR-495-3p + pcDNA group,#< 0.05.
HDAC9 在脑组织中广泛分布,对神经系统的发育具有重要调控作用[18]。研究表明缺血再灌注损伤小鼠脑组织中 HDAC9 的表达水平明显升高,并可参与缺血再灌注损伤发生发展过程[19]。沉默 HDAC9 表达后可明显减轻脑组织缺血再灌注损伤后内皮损伤及神经功能障碍[20]。但关于 HDAC9 在缺血再灌注后神经损伤中的作用机制尚未阐明。与上述研究报道相似,本研究结果显示 H/R 诱导的神经细胞中HDAC9 的表达水平显著升高,抑制 HDAC9 的表达可使神经细胞凋亡率显著降低,Bax 的表达水平降低,Bcl-2 的表达水平升高,炎症因子 TNF-α、IL-1β、IL-6 水平均明显降低,提示抑制 HDAC9 的表达可抑制 H/R 诱导的神经细胞凋亡及减轻炎症损伤。本研究通过双荧光素酶报告实验与 Western blot 实验证实 miR-495-3p 可靶向结合HDAC9,并可负向调控 HDAC9 的表达。进一步研究显示,HDAC9 过表达联合 miR-495-3p 过表达处理后,H/R 诱导的神经细胞凋亡率明显升高,Bax 的表达水平升高,Bcl-2 的表达水平降低,炎症因子 TNF-α、IL-1β、IL-6 水平均明显升高,说明 HDAC9 过表达可逆转miR-495-3p 过表达对 H/R 诱导的神经细胞凋亡及炎症因子表达的作用。提示 miR-495-3p 可通过靶向抑制 HDAC9 的表达从而抑制 H/R 诱导的神经细胞凋亡及炎症反应,对神经细胞发挥保护作用。
综上所述,miR-495-3p 过表达可通过靶向抑制 HDAC9 的表达从而在 H/R 诱导的神经细胞损伤中发挥保护作用,其可能通过抑制细胞炎症反应、下调 Bax 表达及上调 Bcl-2 表达而发挥抗神经细胞凋亡的作用,可为进一步探究 H/R 诱导的神经细胞损伤提供参考依据,可为缺血性脑疾病的治疗提供新思路。
[1] Liu B, Li F, Shi J, et al. Gastrodin ameliorates subacute phase cerebral ischemia‑reperfusion injury by inhibiting inflammation and apoptosis in rats. Mol Med Rep, 2016, 14(5):4144-4152.
[2] Dong P, Zhang X, Zhao J, et al. Anti-microRNA-132 causes sevoflurane‑induced neuronal apoptosis via the PI3K/AKT/FOXO3a pathway. Int J Mol Med, 2018, 42(6):3238-3246.
[3] Nan A, Chen L, Zhang N, et al. A novel regulatory network among LncRpa, CircRar1, MiR-671 and apoptotic genes promotes lead-induced neuronal cell apoptosis. Arch Toxicol, 2017, 91(4):1671-1684.
[4] Qiu J, Zhou XY, Zhou XG, et al. Neuroprotective effects of microRNA-210 against oxygen-glucose deprivation through inhibition of apoptosis in PC12 cells. Mol Med Rep, 2013, 7(6):1955-1959.
[5] Zhang F, Yu GX, Wang LF. Effect of miR-495-3p on the proliferation of hPDLC and the production of inflammatory cytokines induced by LPS. Oral Biomed, 2017, 8(2):86-89. (in Chinese)
张帆, 余国玺, 王力锋. miR-495-3p对LPS刺激人牙周膜细胞增殖及炎性因子表达的影响. 口腔生物医学, 2017, 8(2):86-89.
[6] Han X, Han X, Wang Z, et al. HDAC9 regulates ox-LDL-induced endothelial cell apoptosis by participating in inflammatory reactions. Front Biosci (Landmark Ed), 2016, 21:907-917.
[7] Zhou HQ, Zhu DN, Zhao J, et al. HDAC9 silence inhibits oxygen-glucose deprivation/reperfusion injury of hippocampal neurons in neonatal rats. Chin J Neuroanatomy, 2018, 34(4):519-526. (in Chinese)
周厚勤, 朱登纳, 赵晶, 等. HDAC9沉默抑制新生大鼠海马神经元氧糖剥夺/再灌注损伤. 神经解剖学杂志, 2018, 34(4):519-526.
[8] Yuan R, Zhang YH, Cheng BL, et al. Effect of Ginkgo biloba extract (EGb50) on mitochondrial function in SH-SY5Y cells after hypoxia/reoxygenation injury. China J Chin Mater Med, 2018, 43(22): 4486-4490. (in Chinese)
袁蓉, 张业昊, 程冰丽, 等. 银杏酮酯EGb50对缺氧/复氧损伤后SH-SY5Y细胞线粒体功能的影响. 中国中药杂志, 2018, 43(22): 4486-4490.
[9] Radak D, Katsiki N, Resanovic I, et al. Apoptosis and acute brain ischemia in ischemic stroke. Curr Vasc Pharmacol, 2017, 15(2):115- 122.
[10] Ding N, Huang Y, Tian L. Effects of miRNA-210-3p on hypoxia induced apoptosis in hippocampal neuron HT22 cells. J Zhengzhou Univ (Med Sci), 2019, 54(2):275-279. (in Chinese)
丁娜, 黄月, 田龙. miRNA-210-3p对缺氧诱导海马神经细胞HT22凋亡的影响. 郑州大学学报(医学版), 2019, 54(2):275-279.
[11] Zhang JK, Wang XX, Chen X, et al. Research progress of circulating miRNA in acute ischemic stroke. Stroke Nervous Dis, 2016, 23(3): 213-215. (in Chinese)
张家康, 王枭雄, 陈鑫, 等. 急性缺血性脑卒中中循环miRNA的相关研究进展. 卒中与神经疾病, 2016, 23(3):213-215.
[12] Luo M, Sun Q, Zhao H, et al. Long noncoding RNA NEAT1 sponges miR-495-3p to enhance myocardial ischemia-reperfusion injury via MAPK6 activation. J Cell Physiol, 2020, 235(1):105-113.
[13] Du A, Zhao S, Wan L, et al. MicroRNA expression profile of human periodontal ligament cells under the influence of Porphyromonas gingivalis LPS. J Cell Mol Med, 2016, 20(7):1329-1338.
[14] Gong L, Wu X, Li X, et al. S1PR3 deficiency alleviates radiation-induced pulmonary fibrosis through the regulation of epithelial-mesenchymal transition by targeting miR-495-3p. J Cell Physiol, 2020, 235(3):2310-2324.
[15] Zhao YD, Liu PH, Wang XT, et al. Preliminary study on the mechanism of Tau protein in PC12 cell apoptosis induced by hypoxia/reoxygenation. Chin J Pathophysiology, 2015, 20(10):1918. (in Chinese)
赵严冬, 刘潘虹, 王晓彤, 等. Tau蛋白在缺氧/复氧诱导的PC12细胞凋亡中的机制初探. 中国病理生理杂志, 2015, 20(10):1918.
[16] Kong Y, Yang Y, Han CY, et al. Antrodia camphorata polysaccharide inhibited the inflammatory response in PC12 cell induced by LPS. Chin J Mod Appl Pharm, 2018, 35(11):1689-1693. (in Chinese)
孔云, 杨毅, 韩晨阳, 等. 樟芝多糖抵抗脂多糖诱导的神经细胞PC12炎症反应. 中国现代应用药学, 2018, 35(11):1689-1693.
[17] Wu YH, Hu WB. Resveratrol inhibits PC12 cell injury and apoptosis induced by OGD/R via activating mTOR/autophagy. Clin J Traditional Chin Med, 2019, 31(2):298-303. (in Chinese)
吴印华, 胡万保. 白藜芦醇通过激活mTOR/自噬抑制缺氧缺糖/复氧复糖诱导的PC12细胞损伤及凋亡. 中医药临床杂志, 2019, 31(2):298-303.
[18] Sugo N, Yamamoto N. Visualization of HDAC9 spatiotemporal subcellular localization in primary neuron cultures. Methods Mol Biol, 2016, 1436(1):119-127.
[19] Mai HT, Jiang T, Zhang AW, et al. Expression of HDAC9 in different brain regions in mice with cerebral ischemic stroke. J South Med Univ, 2017, 37(6):812-816. (in Chinese)
麦汉滔, 姜涛, 张爱武, 等. 小鼠脑梗死后脑组织HDAC9的表达及其意义. 南方医科大学学报, 2017, 37(6):812-816.
[20] Shi W, Wei X, Wang Z, et al. HDAC9 exacerbates endothelial injury in cerebral ischaemia/reperfusion injury. J Cell Mol Med, 2016, 20(6): 1139-1149.
Effect of miR-495-3p on apoptosis and inflammatory response of neurons induced by hypoxia/reoxygenation through the regulation of HDAC9 expression
GUO Yan-bing, YAO Qing-he, WANG Xin-jun
Department of Neurosurgery, Luoyang Central Hospital Affiliated to Zhengzhou University, Luoyang 471009, China (GUO Yan-bing, YAO Qing-he); Department of Neurosurgery, The Fifth Affiliated Hospital of Zhengzhou University, Zhengzhou 470000, China (WANG Xin-jun)
To investigate the effect and mechanism of microRNA-495-3p (miR-495-3p) on hypoxia/reoxygenation (H/R)-induced apoptosis and inflammatory response of neurons.
The neuroblastoma cells SK-N-SH were culturedto establish a H/R injury cell model. There were 8 experimental groups as following; Con group, H/R group, H/R + miR-NC group, H/R + miR-495-3p group, H/R + si-NC group, H/R + si-HDAC9 group, H/R + miR-495-3p + pcDNA group, H/R + miR-495-3p + pcDNA-HDAC9 group. Real-time quantitative polymerase chain reaction (qRT-PCR) and Western blot were used to detect the expression of miR-495-3p and histone deacetylase 9 (HDAC9), respectively. Apoptosis was detected by Annexin V-FITC/PI double staining. The levels of inflammatory factors TNF-α, IL-1β and IL-6 were detected by ELISA. Dual luciferase reporter assay was used to verify the targeting relationship of miR-495-3p to HDAC9. Western blot was used to detect the expression levels of Bax and Bcl-2 proteins.
As compared with the Con group, the expression level of miR-495-3p was significantly decreased in the H/R group (< 0.05) and the expression level of HDAC9 was significantly increased (< 0.05). The apoptosis rate (< 0.05), the expression of Bax protein (< 0.05), and the levels of TNF-α, IL-1β and IL-6 (< 0.05) were increased after H/R treatment, but the expression level of Bcl-2 protein was decreased (< 0.05). The apoptosis rate (< 0.05), Bax protein expression level (< 0.05) and TNF-α, IL-1β, IL-6 levels (< 0.05) were decreased after over-expression of miR-495-3p or the inhibition of HDAC9 expression, while Bcl-2 protein expression level was increased (< 0.05). miR-495-3p bound to the 3'UTR region of HDAC9 and down-regulated HDAC9 expression. Overexpression of HDAC9 reversed the inhibitory effect of miR-495-3p overexpression on H/R-induced apoptosis and inflammatory factor expression levels of neurons.
miR-495-3p can protect neurons by inhibiting H/R-induced apoptosis and the production of inflammatory factors through down-regulating HDAC9 expression.
miR-495-3p; HDAC9; Hypoxia/reoxygenation; Nerve cells; Apoptosis; Inflammation
WANG Xin-jun, Email: wangxj@zzu.edu.cn
王新军,Email:wangxj@zzu.edu.cn
10.3969/j.issn.1673-713X.2020.02.017
2019-10-18
