番茄红素对棕榈酸诱导的HepG2 细胞脂质蓄积的改善作用 及机制研究
2020-04-16陈啸阳张毅峰
陈啸阳,张毅峰
(苏州市第九人民医院,江苏 苏州)
0 引言
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)是以肝内脂肪变性为主要特征的一类疾病,已成为世界上影响人类健康最常见的肝脏疾病[1,2]。研究显示,约有20-33%的西方人和15-30%的中国人受到NAFLD 的困扰[3]。如果不加以控制,肝单纯的脂肪变性可进一步发展为非酒精性脂肪肝炎(nonalcoholic steatohepatitis, NASH)、肝纤维化和肝硬化,甚至肝癌[4,5]。除此之外,NAFLD 也是2 型糖尿病、动脉粥样硬化、心血管疾病和慢性肾病的风险因素[6,7]。NAFLD 发病机制尚不明确,目前治疗手段相对局限,主要包括生活习惯干预(节食和运动)、胰岛素增敏剂(吡格列酮)和他汀类降脂药等[8],但由于患者对生活干预的顺应性差及药物的不良反应,严重限制了NAFLD 的临床治疗效果[4]。因此,寻找有效治疗NAFLD 的药物迫在眉睫。
番茄红素(Lycopene, Lyc)属于类胡萝卜素家族,是一种无环、亲脂性的类胡萝卜素,广泛分布在红颜色的蔬菜和水果中,如番茄、西瓜、胡萝卜和红葡萄柚[9,10]。研究显示,番茄红素具有强大的抗氧化和抗炎作用,可调节机体代谢活动,改善肥胖并发症和修复肝功能[11]。大量动物研究发现,番茄红素可改善高脂饮食(high-fat diet, HFD)诱导的肝脂肪变性[9,12-14]。除此之外,Li 等[15]发现,番茄粉可通过激活Sirt1 抑制HFD 诱导的小鼠肝脂肪变性。番茄红素作为番茄粉的主要成分,其是否可通过激活Sirt1改善NAFLD,目前尚未有研究报道。本实验使用PA 诱导的体外NAFLD 模型,旨在探讨不同剂量番茄红素的降脂活性及其潜在机制,为临床使用番茄红素治疗NAFLD 提供理论基础。
1 材料与方法
1.1 主要试剂
DMEM 高糖培养基购自江苏凯基生物技术股份有限公司;Oil Red O 粉末和棕榈酸钠粉末购自Sigma 公司;番茄红素购自美国MCE 公司;TG 检测试剂盒购自南京建成生物工程研究所;Sirt1 和PPARα 抗体购自美国Cell Signaling Technology 公司;GAPDH 抗体购自武汉proteintech 公司;ECL 购自美国Pierce 公司。
1.2 细胞株及细胞培养
人肝癌细胞(HepG2)购自北京协和细胞库,细胞培养于含10% FBS 和1%(青霉素/链霉素)的DMEM 完全培养基中,培养条件为37℃、5% CO2 的饱和湿度培养箱,每两天换液一次,待细胞融合至60-80%时传代。
1.3 MTT 实验
将处于对数生长期的HepG2 以1×105个/mL 接种于96 孔板中,待细胞生长至60%~80% 时,使用不同浓度的番茄红素单独处理或与PA 共同处理24h,正常组给予空白培养基,处理结束后,每孔加MTT 母液10μL,37oC 培养箱孵育4h,酶标仪测定490nm 处的吸光度(OD)值。计算细胞相对存活率,细胞相对存活率=(实验孔OD 值- 空白孔OD 值)/(对照孔OD 值- 空白孔OD 值)×100%。
1.4 WB 实验
细胞刮收集细胞,RIPA 强裂解液冰上裂解30min,12000rpm离心15min,吸取上清,BCA 法测定蛋白浓度,将各组蛋白调至相同浓度后,加入SDS-PAGE 上样缓冲液,每孔加入40-60μg 蛋白,用12% SDS-PAGE 凝胶电泳分离蛋白,电转移至PVDF 膜上,5% BSA 室温封闭1-2h 后,分别用一抗4℃孵育过夜,HRP 标记二抗室温孵育1-2h,采用ECL 显色液显色。
1.5 统计学分析
应用Graphpad Prism 7 软件进行数据分析,数据用mean ± SEM 表示,多组间比较采用单因素方差分析 (one-wayANOVA),P<0.05 表示差异有统计学意义。
2 结果
2.1 番茄红素对模型状态下HepG2 细胞活力的保护作用
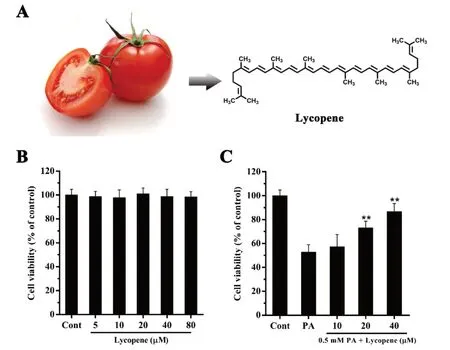
图1 番茄红素对模型状态下HepG2 细胞活力的保护作用
MTT 结果显示(图1B),番茄红素在80 μM 以下对HepG2 细胞活力无显著影响(P>0.05);与正常组相比,PA(0.5 mM)可显著抑制HepG2 细胞活力,而番茄红素可剂量依赖性的增加HepG2的细胞活力(图1D)(P<0.05)。这提示对番茄红素可改善PA 诱导的HepG2 细胞损伤。
2.2 番茄红素对PA 诱导的HepG2 细胞脂质蓄积的改善作用
肝细胞内脂质蓄积是NAFLD 的主要特征之一并可进一步引起肝细胞损伤,为了进一步探讨番茄红素对模型下HepG2 的保护作用,本实验使用Oil Red O 和TG 检测试剂盒检测HepG2 细胞内脂质含量变化。结果显示,番茄红素可剂量依赖性的降低HepG2 细胞内的脂质蓄积。这提示,番茄红素对HepG2 的保护作用可能与缓解细胞内脂质蓄积有关。
2.3 番茄红素对HepG2 细胞内Sirt1 和PPARα 表达的影响
Sirt1 和PPARα 是参与肝细胞脂质代谢的关键蛋白,为了阐明番茄红素的降脂机制,本实验使用Westernblot 检测细胞Sirt1和PPARα 的表达变化。结果显示,与正常组相比,PA 组细胞内Sirt1 和PPARα 的表达明显下调,番茄红素可剂量依赖性的上调PPARα 的表达,而对Sirt1 的表达无影响。这提示,番茄红素可能通过上调PPARα 的表达,促进细胞内的脂质代谢,缓解PA 诱导的HepG2 细胞内脂质蓄积。
3 讨论
NAFLD 已成为困扰人类健康的全球性问题,寻找有效治疗NAFLD 的药物是当今研究的热点。而天然产物具有安全性高、自然界含量丰富、药效显著等特点,一直以来是寻找有效药物的天然宝库。番茄红素作为一种自然界常见的天然产物,具有体内外强大的抗氧化作用,其抗氧化作用是维生素E 的100 倍,是谷胱甘肽的125 倍,对各种肝损伤具有保护作用[16,17]。本研究发现,番茄红素可以显著改善PA 诱导的HepG2 细胞内脂质蓄积,提高细胞活力。这种效应与上调细胞内PPARα 的表达,促进细胞内的脂质代谢密切相关。
Sirt1 是一种烟酰胺腺嘌呤二核苷酸依赖的去乙酰化酶,在脂质代谢和能量稳态的调整中起着重要作用[18]。研究显示,番茄粉可通过激活Sirt1 改善HFD 诱导小鼠肝脂肪变性[15]。而本实验结果显示,番茄红素对Sirt1 的表达无明显影响。这提示,番茄粉中的其他成分而非番茄红素可上调Sirt1 的表达。为了进一步明确番茄红素的降脂机制,我们考察了番茄红素对PPARα 的影响。PPARα 是参与脂肪酸氧化的关键靶蛋白[19]。实验结果显示,番茄红素可剂量依赖性的上调PPARα 的表达。综上,番茄红素可通过上调PPARα 的表达,促进脂质氧化代谢,改善肝细胞内脂质蓄积,增加细胞活力,进而治疗NAFLD。

图2 番茄红素对PA 诱导的HepG2 细胞脂质蓄积的改善作用
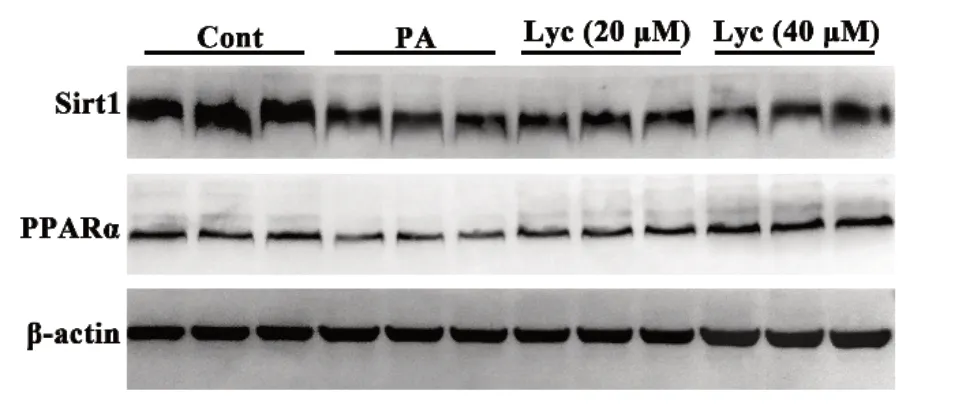
图3 番茄红素对HepG2 细胞内Sirt1 和PPARα 表达的影响
