木霉菌合成银纳米粒子条件的优化及其对甜瓜尖孢镰刀菌抑制作用
2020-04-15姚薇曲明星崔晓慧夏润玺刘限
姚薇,曲明星,崔晓慧,夏润玺,刘限
沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866
引起甜瓜枯萎病的尖孢镰刀菌是既可侵染植物又可在土壤内生存的兼性寄生真菌[1],一般从植物根部入侵,在不同时期均可使甜瓜枯萎致死,从而造成甜瓜产量和品质下降[2]。目前农业上通常采用化学农药防治枯萎病,但长期过量施用化学农药将严重污染土壤,造成土壤生态环境失衡和病原菌产生抗药性[3]。因此,生产上急需环境友好型且不易使病原菌产生抗药性的生物杀菌剂。纳米粒子由于其在大小、分散程度和形状等方面的特性表现出新的优点,在医学、农业和食品等领域引起广大学者的关注[4]。许多金属纳米粒子对病毒、细菌和真菌等微生物都具有较强的杀菌活性[5],其中AgNPs是被广泛研究利用的金属纳米粒子,可以作为抗微生物剂、抗癌剂、光催化剂、抗氧化剂和杀蚊剂[6]。AgNPs的合成因物理和化学法的生产成本高和高毒性物质的副作用而转向生物合成。以细菌、真菌等微生物代谢物和植物提取物为还原剂和稳定剂生物合成AgNPs,具有绿色环保和高安全性的特点[7-10],其中对金属具有高抗性和高聚合能力的真菌[11]能够分泌细胞外酶而广泛用于AgNPs的合成。目前已有多种木霉菌用于合成AgNPs,主要有棘孢木霉Trichoderma asperellum[12]、绿色木霉T.viride[13]、哈茨木霉T.harzianum[14]、盖木斯木霉T.gamsiiIPT853[15]和长枝木霉T.longibrachiatum[16],但不同木霉菌合成AgNPs的条件不同[17-18]。
本研究以橘绿木霉T.citrinoviride和毛簇木霉T.velutinous发酵液为还原剂和稳定剂合成AgNPs,以UV-vis光谱表征特征探究不同合成条件对不同木霉菌合成AgNPs影响,以期明确木霉菌合成AgNPs的最适条件。同时研究不同木霉菌合成的AgNPs对尖孢镰刀菌的抑菌活性,为农用新型药剂的开发和甜瓜枯萎病的防控奠定理论基础。
1 材料与方法
1.1 菌种
橘绿木霉T.citrinoviride和毛簇木霉T.velutinous,分离于柞树根系,保存于沈阳农业大学生物科学技术学院实验室。
尖孢镰刀菌Fusarium oxysporum分离于甜瓜枯萎病根系,保存于植物保护学院实验室。
1.2 供试培养基
PDA固体培养基:将马铃薯去皮洗净,称量200 g并切块,加入蒸馏水煮沸20–30 min,用纱布过滤后,将其滤液倒入锅中加热,加入琼脂条20 g,不断搅拌,待琼脂条完全溶解后加入葡萄糖20 g,搅拌均匀,稍冷却后再添加蒸馏水至1 000 mL,分装于锥形瓶中,灭菌后备用。
PDB培养基:制备方法同上,培养基中不加入琼脂。
1.3 试剂
硝酸银 (分析纯AR),西陇科学股份有限公司;氢氧化钠 (分析纯AR),西陇科学股份有限公司;盐酸 (分析纯AR),西陇科学股份有限公司。
1.4 银纳米粒子的合成
木霉菌在PDA培养基上活化后转移到PDB培养基中,在28 ℃、150 r/min下振荡培养3 d。然后用无菌Whatman滤纸1号过滤菌丝,收集滤液 (使用此滤液合成AgNPs方法命名为CL法)和木霉菌丝。木霉菌丝 (10 g) 用无菌去离子水洗涤2次以除去培养基,然后加入100 mL无菌去离子水中,振荡培养3 d,使用无菌Whatman滤纸1号过滤收集滤液 (使用此滤液合成AgNPs方法命名为CW法)。将200 μL AgNO3(1 mol/L) 加入100 mL滤液 (CL法或CW法) 中并在光照或黑暗条件下反应5 d。离心 (12 991×g,30 min)收集合成的AgNPs,用无菌水洗涤2次,再用75%乙醇洗涤1次。合成的AgNPs自然干燥后称重,备用。
1.5 银纳米粒子合成条件的优化
1.5.1 不同反应条件对合成银纳米粒子的影响
分别设置静置暗反应、静置光照、振荡暗反应、振荡光照4个反应条件,每12 h进行紫外可见光分光光度计全波长 (300–800 nm) 扫描,综合分析利于AgNPs合成的条件。
1.5.2 底物AgNO3浓度对合成银纳米粒子的影响
根据前面试验结果,设置100 mL反应液中AgNO3(1 mol/L) 的终浓度分别为1.0 mmol/L、2.0 mmol/L、3.0 mmol/L,于静置光照条件下反应24 h,分析反应液中AgNO3浓度对AgNPs合成的影响。
1.5.3 不同pH对合成银纳米粒子的影响
根据前面试验结果,反应液的pH分别调整为3、5、7、9,AgNO3浓度为2.0 mmol/L,于静置光照条件下反应24 h,分析pH对AgNPs合成的影响。
1.5.4 不同温度对合成银纳米粒子的影响
根据前面试验结果,将反应液 (pH:7;AgNO3浓度为2.0 mmol/L) 分别于25 ℃、35 ℃、45 ℃、55 ℃,静置光照条件下反应24 h,分析温度对AgNPs合成的影响。
1.6 AgNPs对尖孢镰刀菌的抑制作用
AgNPs沉淀于灭菌水中用超声波细胞破碎仪将其充分破碎分散后,制成AgNPs水溶液,然后加入PDA培养基中,使AgNPs最终浓度分别为0 mg/L、25 mg/L、50 mg/L、100 mg/L和200 mg/L。然后倒入培养皿中,晾干后接镰刀菌菌饼,28 ℃下倒置暗培养7 d,测量镰刀菌菌落直径,计算AgNPs对镰刀菌生长的抑制作用。每个处理重复3次。
1.7 数据处理
试验数据使用软件Excel (Office 2010) 整理和方差分析。
2 结果与分析
2.1 四种反应条件下橘绿木霉T.citrinoviride CW法合成AgNPs的比较
橘绿木霉在静置暗反应、静置光照、振荡暗反应、振荡光照4个反应条件下,采用CW法合成AgNPs,合成过程中每12 h进行紫外可见光分光光度计全波长扫描。扫描结果表明,在静置暗培养条件下从0–72 h、在400–500 nm范围内无宽吸收峰且波长位置几乎重合,且反应液颜色一直呈淡黄色 (图1A)。在静置光照条件下培养12 h后,438 nm处出现吸收峰,72 h达到最大值,且吸收峰位置基本保持不变,该特征吸收峰与文献中报道的纳米银的UV-vis光谱吸收峰是一致的;反应液颜色0 h时呈淡黄色,12 h变成棕色,72 h时颜色变深至黑褐色 (图1B)。振荡暗反应和振荡光照在0–48 h全波长扫描结果波形位置基本一致,60–72 h在400–500 nm之间吸收峰位置变高,反应液在0–48 h颜色几乎无变化,60–72 h变为深黄色 (图1C和1D)。因此,T.citrinovirideCW法合成AgNPs过程中静置光照的反应条件是最好的,吸光度达到2.6 。
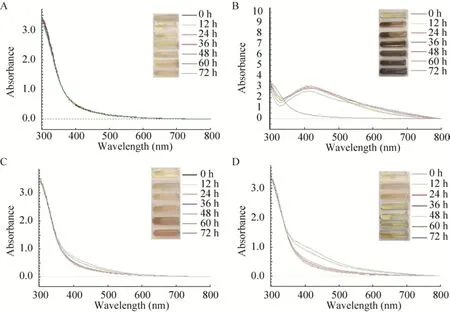
图1 4种反应条件对橘绿木霉CW法合成AgNPs的比较Fig.1 Effect of 4 reaction parameters on synthesis of AgNPs by T.citrinoviride with CW method.(A) Standing and dark.(B) Standing and light.(C) Shaking and dark.(D) Shaking and light.
2.2 四种反应条件下毛簇木霉T.velutinous CW法合成AgNPs的比较
毛簇木霉在4种反应条件下CW法合成AgNPs情况与橘绿木霉基本一致,也是在静置光照条件下合成效果最好。研究发现,静置光照条件下培养12 h后,438 nm处出现吸收峰,72 h达到最大值,且吸收峰位置基本保持不变 (图2B)。因此,T.velutinousCW法合成AgNPs中静置光照反应条件下合成AgNPs效果最佳,吸光度达到2.7。

图2 4种反应条件对毛簇木霉CW法合成AgNPs的比较 (A:静置暗反应;B:静置光照;C:振荡暗反应;D:振荡光照)Fig.2 Effect of 4 reaction parameters on synthesis of AgNPs by T.velutinous with CW method.(A) Standing and dark.(B) Standing and light.(C) Shaking and dark.(D) Shaking and light.
2.3 四种反应条件下橘绿木霉T.citrinoviride CL法合成AgNPs的比较
在4种反应条件下,橘绿木霉T.citrinoviride合成AgNPs CL法明显好于CW法,4种反应条件下颜色变化明显,都有AgNPs的生成。其中静置光照条件下反应颜色均在12 h开始变化,72 h时达到黑褐色,合成量明显增加 (图3)。结果显示,静置光照条件下培养12 h后,437 nm处出现吸收峰,72 h达到最大值,为10.2。根据反应颜色变化及紫外扫描得出结论T.citrinovirideCL法在静置光照条件下合成AgNPs合成效果好。

图3 4种反应条件对橘绿木霉CL法合成AgNPs的比较 (A:静置暗反应;B:静置光照;C:振荡暗反应;D:振荡光照)Fig.3 Effect of 4 reaction parameters on synthesis of AgNPs by T.citrinoviride with CL method.(A) Standing and dark.(B) Standing and light.(C) Shaking and dark.(D) Shaking and light.
2.4 四种反应条件下毛簇木霉T.velutinous CL法合成AgNPs的比较
毛簇木霉CL法合成AgNPs与T.citrinovirideCL法合成AgNPs基本一致,但最佳合成条件下吸收峰在24 h达到最高,为3.2,随着时间的延长吸收峰降低,推测可能是木霉菌发酵液中的部分还原性成分被破坏,发酵液的还原能力降低,AgNPs合成量降低。反应颜色均在12 h开始变化 (图4),且光照培养颜色变化均明显好于暗培养条件。根据反应颜色变化及紫外扫描得出结论:T.velutinousCL法合成AgNPs在采用静置光照条件合成AgNPs时合成效果最好。
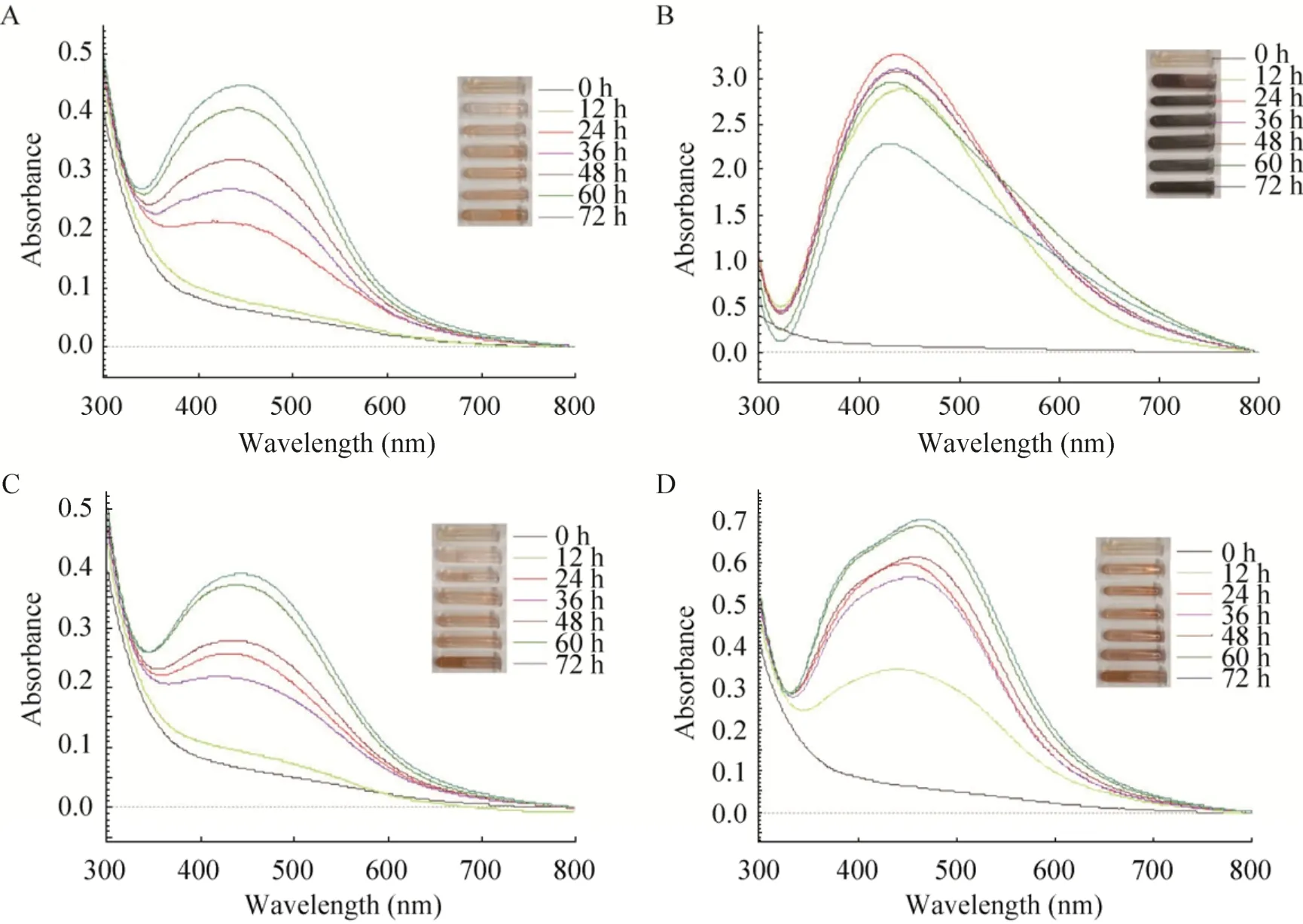
图4 4种反应条件对毛簇木霉CL法合成AgNPs的比较Fig.4 Effect of 4 reaction parameters on synthesis of AgNPs by T.velutinous with CL method.(A) Standing and dark.(B) Standing and light.(C) Shaking and dark.(D) Shaking and light.
综合两种木霉菌在两种合成方法和4种反应条件下合成AgNPs的情况,木霉菌合成AgNPs以静置光照下合成效果最佳,橘绿木霉的合成量高于毛簇木霉的。
2.5 硝酸银浓度对木霉菌发酵液合成AgNPs的影响
反应液中AgNO3浓度对两种木霉菌发酵液合成AgNPs的影响见图5。反应液中AgNO3浓度为1.0 mmol/L时,两种木霉菌都几乎无吸收峰出现,而其他两种浓度均在440 nm处出现吸收峰,说明合成了AgNPs。反应液中AgNO3的浓度为2.0 mmol/L时,合成AgNPs的特征吸收峰的峰值最高。橘绿木霉合成AgNPs的量高于毛簇木霉。
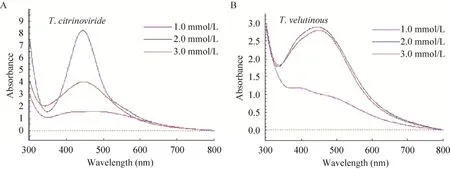
图5 反应液中AgNO3浓度对木霉菌合成AgNPs的影响Fig.5 Effect of AgNO3 concentration in the reaction solution on the synthesis of AgNPs by Trichoderma strains.
2.6 pH对木霉菌发酵液合成AgNPs的影响
不同pH对两种木霉菌发酵液合成AgNPs的影响见图6。当pH为3时,合成AgNPs吸收峰峰值较低,说明此条件下合成能力较弱;pH为7时,合成AgNPs的特征吸收峰的峰值最高,说明合成能力最好。在酸性条件下,合成的纳米银的特征吸收峰发生红移(图6)。当pH为5–9时,两种木霉菌发酵液合成AgNPs的量基本没有影响。

图6 pH对木霉菌合成AgNPs的影响Fig.6 Effect of pH on the synthesis of AgNPs by Trichoderma strains.
2.7 温度对木霉菌发酵液合成AgNPs的影响
不同温度对两种木霉菌合成AgNPs的影响见图7。45 ℃和55 ℃的特征吸收峰的峰值较高,55 ℃形成的是宽峰,说明AgNPs的粒径较大;45 ℃形成的是窄峰,说明纳米银的粒径较小。与45 ℃的特征吸收峰相比,其他条件下吸收峰发生红移。因此,木霉菌合成AgNPs的最适反应温度为45 ℃。温度对两种木霉菌发酵液合成AgNPs的量基本没有影响。
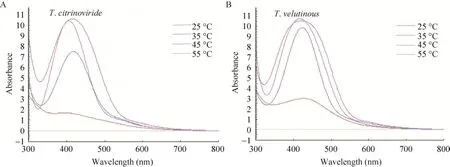
图7 温度对木霉菌发酵液合成AgNPs的影响Fig.7 Effect of temperature on the synthesis of AgNPs by Trichoderma strains.
2.8 AgNPs对尖孢镰刀菌的抑制作用
两种木霉菌均采用CL法合成AgNPs溶液,设置了0、25、50、100、200 mg/L五种不同的浓度,观察对尖孢镰刀菌的抑制效果。木霉菌合成的AgNPs对镰刀菌都有抑制作用,在相同浓度下,两种木霉菌合成的AgNPs对尖孢镰刀菌没有显著性差异。不同浓度的AgNPs对尖孢镰刀菌的抑制情况也有所不同。随着浓度的增加,抑制效果越好。两种木霉菌合成AgNPs都是在200 mg/L时抑制效果最好 (表1)。
3 讨论
近年来,随着绿色环保概念的普及,与传统的化学、物理合成法相比,生物合成银纳米粒子的备受关注。许多生物已经被用于合成金属纳米颗粒[19],而微生物尤其是真菌可产生大量生物活性成分,这些成分在生物合成AgNPs过程中常被用作辅助剂、封端剂和稳定剂,从而更有利于金属纳米粒子的合成[20]。本试验使用T.citrinoviride和T.velutinous合成AgNPs,通过改变反应合成条件,发现T.citrinoviride和T.velutinous发酵液均可用于合成AgNPs,合成最适条件为CL法静置光照培养,反应液中AgNO3浓度为2.0 mmol/L,pH为7,反应温度为45 ℃。AgNPs的尺寸、形状、形态、组成和介电环境决定了AgNPs的颜色,因此可借助UV-vis识别AgNPs的形成[21]。木霉菌发酵液和无色的AgNO3溶液于静置光照下发生颜色变化,证实了AgNPs的合成[22]。随着反应时间的增加,反应颜色加深,表明AgNPs的浓度增加,说明AgNPs的形成与反应时间成正比[23]。所有合成的AgNPs都在400–500 nm的波长处被吸收,所形成的AgNPs电镜观察大多为球形或扭曲的球形 (另有论文发表),这与Dauthal和Mukhopadhyay的推测结果基本一致[24]。微生物发酵液合成AgNPs的条件,不同文献报道不甚相同,Elgorban等[13]利用绿色木霉T.viride在静置暗培养条件下合成AgNPs;张杰等[25]利用钩状木霉T.hamatun在150 r/min暗反应合成AgNPs;Omran等[17]利用长枝木霉T.longibrachiatum合成AgNPs时发现,在振荡的条件下搅拌速度的增加会引起反应混合液发生湍流,这可能会造成AgNPs产率的降低;而Gade等[26]利用侧耳属Pleurotusspp.合成AgNPs时发现,在有阳光的情况下,Ag+的还原迅速发生,而在黑暗时需24 h才能完全还原。本试验中,在设置的4个反应条件中 (静置暗反应、静置光照、振荡暗反应、振荡光照),静置光照合成效果较好,由此看出AgNPs合成条件与不同的微生物有关;采取两种合成方法 (CL法、CW法),发现CL法合成AgNPs的效果更好,可能是由于CL法的发酵液滤液中含有更多的木霉菌合成的各种有机物质,从而有利于纳米银的合成。据文献报道,金属硝酸盐可以通过暴露于阳光下产生的热量而分解,而真菌发酵液中的芳香族化合物通过光活化,芳香族化合物和蛋白质作为封端剂启动金属纳米粒子的合成,真菌发酵液的光敏芳香族化合物向Ag+提供电子还原以形成具有封端剂的金属纳米粒子[27]。此外,随着底物浓度从1.0 mmol/L增加到3.0 mmol/L,AgNPs的SPR峰略红移,这可能是在更高的底物浓度 (3.0 mmol/L)下形成了较大尺寸AgNPs。其中,使用2.0 mmol/L合成的AgNPs表现出更好的稳定性。在反应体系中,酸性pH条件下AgNPs的SPR峰发生红移,这表明AgNPs的粒径变大。在酸性pH条件下,生物代谢物主要以阳离子形式存在,如NH3+-R-COOH。质子化的胺基之间存在静电排斥,但是NH3+基团倾向于吸附到银纳米颗粒的表面,从而降低了NH3+基团之间的静电斥力,因此,它决定了-COOH基团之间氢键的优势,并导致纳米粒子的聚集,因此AgNPs发生聚集导致粒径变大。而在中性pH和碱性pH条件下,生物代谢物组分带负电,从而将电子转移到Ag+最终还原Ag+导致形成了小尺寸的AgNPs[28]。随温度升高AgNPs浓度显著升高,而在高温 (45 ℃、55 ℃)下,SPR峰略红移。随着样品温度的升高,纳米颗粒的体积由于热膨胀而增加,温度的升高会导致纳米粒子中自由电子的浓度降低,并导致SPR峰的红移[29]。

表1 AgNPs对尖孢镰刀菌的抑制率Table 1 Inhibitory rate of silver nanoparticles against F.oxysporum
木霉菌发酵液合成的AgNPs能够抑制尖孢镰刀菌的生长,两种木霉菌合成的AgNPs对尖孢镰刀菌的抑制没有显著性差异;不同浓度的AgNPs对尖孢镰刀菌的抑制性存在显著性差异,且随着浓度的不断增大,抑制效果越好。纳米银对金黄色葡萄球菌[30]、大肠杆菌[30]、植物病原真菌[31](灰霉病菌、尖孢镰刀菌、白皮腐霉) 等都有抑制作用,说明AgNPs具有广谱抑菌作用。后续研究还需明确AgNPs对甜瓜枯萎病的防治效果和是否对甜瓜生长有影响。
4 结论
两种木霉菌发酵液均可合成AgNPs,合成AgNPs的最适条件:CL法静置光照培养,底物AgNO3浓度为2.0 mmol/L,pH为7,反应温度为45 ℃。UV-Vis显示AgNPs表面等离子体共振发生在437 nm处,出现最大吸收峰。两种木霉菌生物合成AgNPs对尖孢镰刀菌都具有抑制效果,浓度越高,抑制效果越好。
