基于酸敏感的双响应抗癌药物载体的研究进展
2020-04-15禄秀娟郭鑫昊万冬潘杰
禄秀娟,郭鑫昊,万冬,潘杰
天津工业大学 化学与化工学院,天津 300387
目前,肿瘤治疗的主要方法是手术切除、放疗、化疗和免疫治疗[1]。其中化疗是当前应用最广泛的治疗方法,但是传统的化疗药物具有溶解度差、稳定性低、毒副作用大、易产生耐药性以及无法通过体内长循环到达肿瘤部位等一系列局限性[2],将化疗药物负载到具有响应的智能纳米载体中,可以显著提高化疗药物的疗效。近年来,刺激响应性聚合物已被广泛应用到抗癌纳米药物载体中。然而,关于刺激响应性聚合物的研究中仍然存在许多不足,如在肿瘤部位渗透性差、对肿瘤细胞的靶向性差以及在时间和空间上很难有效地控制药物释放[3],这进一步阻碍了抗癌药物载体的开发和应用。
与正常组织相比,肿瘤组织有着诸多显著的区别,例如:肿瘤细胞内外的pH值比正常细胞的要低;谷胱甘肽 (GSH)、温度甚至一些酶也比正常组织的要偏高[4]。结合肿瘤内部这些特有的微环境,设计出具有双重或多重刺激响应性的智能纳米药物载体,可以有效克服传统化疗药物的溶解度低、毒副作用大、稳定性差、体内半衰期短、耐药性等局限性,从而达到更好的治疗效果。并且这些双重刺激响应性纳米粒,可以在不同部位受到不同的刺激后顺序释放,因此与单响应纳米载体相比,可以更好地实现化疗药物的控制和释放。
本文主要概述了近几年内基于酸敏感双重刺激响应的不同类型聚合物,作为抗癌药物载体所具有的优势以及最新研究进展,进而分析了目前该类载体的优缺点,为抗癌药物载体的进一步开发和应用提供参考。
1 酸-温度双重刺激响应性聚合物
酸和温度是比较常见的用于肿瘤微环境刺激响应性信号,这主要是因为肿瘤细胞微环境的pH、温度和正常细胞存在一定的差异性。通常在正常组织pH保持在7.4左右,但是在肿瘤组织的pH在6.5–6.8之间,在肿瘤细胞内的溶酶体及内涵体中甚至更低,pH在4.5–6.0之间[5]。正常组织、细胞的生理温度在37 ℃ 左右,有研究表明肿瘤组织间的温度比正常组织间高出2–5 ℃ 左右[6]。研究人员利用这一特点合成了一系列具有pH和温度双重刺激响应的聚合物,这种pH/温度双响应聚合物能够有效地控制抗癌药物在特定环境中释放。因此对pH/温度双响应聚合物的研究是非常有必要的。
目前,主要将pH和温度敏感聚合物通过化学键偶联,合成双响应聚合物;或者分别对pH和温度敏感聚合物进行修饰,最后通过自组装形成双响应胶束;或者将具有pH和温度敏感的材料负载在无机材料或包埋在囊泡里;通过进一步改善显著提高了抗癌药物在复杂的肿瘤微环境中实现更好的药物控释作用。Lin等[7]根据L-谷氨酸 (GA) 是具有生物相容性的人体必需氨基酸,并且还具有两个或多个与金属中心配位的官能团,将没有毒性的金属阳离子Zn2+通过配位官能团构建出了多孔的MOF材料Zn-GA。选择了抗癌药物氨甲蝶呤 (MTX),通过原位合成被加载到Zn-GA中。实验结果表明,包封MTX后,Zn-GA的晶体结构不被破坏,并且载药量达到12.85%。在pH 5.0、温度42 ℃的条件下6 h内药物释放量达到68%,表明在特定环境刺激下有快速释放的效果。并通过MTT法对比了不载药和载药的Zn-GA对细胞的毒性,发现不载药时细胞存活率高达96%,可以基本忽略材料的毒副作用,但是载药后的结果可以发现,相同条件下细胞存活率只有12%,此结果进一步显示了该双响应载体能够有效提高癌症治疗效果。值得我们借鉴的是该双响应抗癌纳米药物是通过一锅法合成,直接将MTX (20 mg)、GA (15 mg) 和Zn(NO3)2·6H2O(24 mg)溶解在DMF/H2O (8 mL,V︰V=3︰1) 的混合溶液中,在80 ℃的条件下加热6 d,最后冷却至室温,进而获得载药的Zn-GA黄色结晶。可以看出该合成过程非常简单,并充分利用材料具有的独特性质,使得该药物载体具有很好的生物相容性、极低的毒性、良好的装载能力和双响应性,是一种高效控制药物缓慢释放的载体。表1中总结了一些现阶段合成的pH和温度双响应聚合物的优缺点。
2 酸-磁双重刺激响应性聚合物
磁性纳米粒由于具有独特的靶向性、成像性和热疗性[12],以及具有定向、定量、高效、安全等特点[13],因而被生物医学界广泛关注。Fe3O4是常见的磁性颗粒,但是缺乏载药能力,只有对其进行改性才能获得理想的具有载药能力的磁性纳米粒。近几年研究人员利用pH敏感聚合物对磁性纳米粒进行了修饰,并将抗癌药物负载到纳米粒中,从而形成既有pH响应又有磁响应的双重刺激响应载药纳米粒。表2中总结了一些常见的pH-磁双重刺激响应聚合物。
Hu等[14]通过接枝法用4-戊烯酸 (PA) 和N-羟乙基丙烯酰胺 (HEAA) 对一种新型生物多聚糖β-1,3葡聚糖进行修饰,制备了具有酸敏感的接枝共聚物Salecan-g-poly (PA-co-HEAA) (PPH)。再通过Fe3O4@SiO2纳米粒子中羟基与PPH链上的羰基或氨基之间的强氢键作用得到了一种新型的pH-磁双响应水凝胶Salecan-g-PPH/Fe3O4@SiO2。通过实验证明,pH 4.5时药物释放量高达76%±2.6%,在细胞毒实验中测得IC50为8 μg/mL,不载药的材料孵育细胞48 h存活率高达90%,这进一步表明材料的安全性。这种水凝胶具有很好的生物相容性,可以有效避免体内免疫系统的排异反应,为注剂的发展奠定了一定的基础。Pourjavadi等[15]以简便、通用的方法合成了一种载有阿霉素(DOX),同时具有pH-磁双响应的纳米抗癌药物载体Fe3O4@PGMA-Hy@DOX。该纳米材料的主要优点是以Fe3O4为基础的靶向给药,可以有效使载药纳米粒靶向于特定的肿瘤细胞,消除常规化疗的副作用。实验验证Fe3O4@PGMA-Hy@ DOX纳米颗粒在pH 5.4时24 h 内药物的释放量高达60%左右。细胞毒性实验表明,Fe3O4@PGMA-Hy孵育细胞24 h后存活率高达90%,并且具有良好生物相容性。既达到了载药又达到控制药物释放的目的,还具有良好生物相容性以及靶向性,唯一不足的一点是对于材料在体内的生物降解性还有待进一步证明。表2中总结了一些常见pH和磁双重刺激响应聚合物的优缺点。
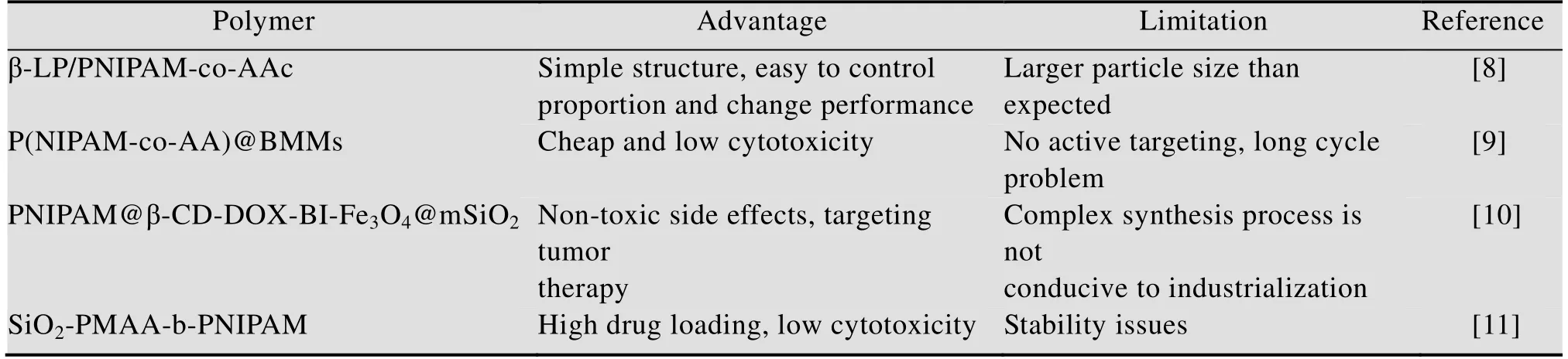
表1 一些常见的pH和温度双重刺激响应聚合物的优缺点Table 1 Advantages and disadvantages of some common pH and temperature dual stimulus-responsive polymers

表2 一些常见的pH和磁双重刺激响应聚合物优缺点Table 2 Advantages and disadvantages of some common pH and magnetic dual stimulus-responsive polymers
3 酸-氧化还原双重刺激响应性聚合物
目前,研究者们对pH和氧化还原双重刺激响应聚合物的研究也比较广泛,其中基于谷胱甘肽(GSH) 结合pH的研究是最为常见的。GSH是动物细胞中含量最多的生物硫醇,也是主要的氧化还原偶联物[17]。但是GSH在肿瘤细胞内的浓度为0.5–10 mmol/L,在细胞外的浓度为2–10 μmol/L,是正常细胞中含量的4–10倍[5]。因此,研究人员利用这一特点将具有还原响应的聚合物与pH响应的聚合物结合得到了pH-氧化还原双重刺激响应的抗癌药物载体。表3中总结出一些常见的pH和氧化还原双重刺激响应聚合物的优缺点。
Shang等[18]合成了一种同时具有pH/氧化还原双重反应和主动靶向功能的纳米药物载体BTES-PDEAEMA-S-S-PEG-Fas。该载体中间用二硫键链接聚[2-(二乙基氨基)-甲基丙烯酸乙酯](PDEAEMA)和聚乙二醇 (PEG) 及每个末端由4个叶酸 (FA) 封端的星形共聚物。通过实验测得临界胶束浓度为1.03–2.51 mg/L,这反映了胶束的稳定性,并且该胶束的载药量高达32.3%。体外释放表明,在pH 5.0+10 mmol/L GSH条件下,前24 h DOX的累积释放率68%,当时间延长到180 h时,DOX的释放率超过90%,证明了该材料在特定肿瘤微环境中具有高效的药物释放能力。通过共聚焦观察证实了末端叶酸功能化促进了细胞的内吞,细胞毒实验测得IC50为2.62 mg/L,这进一步证明该材料具有主动靶向性、高载药能力以及良好的生物相容性,是一种高效的抗肿瘤药物载体。Zhang等[19]也制备了一种新型的同时包埋DOX和塞来昔布 (CXB) 的核壳结构纳米颗粒 (HPPDC)。该核壳纳米粒最大的特点是用透明质酸 (HA) 进行表面修饰,不仅延长了在血液中的循环而且还可以介导特异性癌细胞的内吞作用,有效避免了P-糖蛋白 (P-gp) 的外排效应。在酸性及高GSH浓度下,二硫键断裂,使包裹的DOX和CXB释放,显著提高了对癌细胞的毒性。像这种同时装载了两种抗癌药物的聚合物,不仅提高了肿瘤的治疗效果,而且还具有很好地克服肿瘤细胞单一耐药性的特点。然而这种同时装载两种治疗效果的核壳纳米粒在临床方面的应用反而不常见,这为今后的研究指明方向。
4 酸-酶双重刺激响应性聚合物
众所周知,肿瘤微环境是一种非常丰富的环境,在肿瘤微环境中多种酶过度表达,肿瘤细胞外及肿瘤细胞内过度表达的酶如基质金属蛋白酶(MMP2和MMP9)、酯酶、α-淀粉酶、组织蛋白酶B(CaB) 等[23],pH值也低于正常细胞环境,并且肿瘤部位新生血管也多于正常部位,这些都是肿瘤组织的主要特征。表4中总结了肿瘤部位各种表达异常的酶及其药物递送系统中的应用。Ni等[24]开发出了一种多药耐药性 (MDR) 的多肽前药 (mPEG–peptide–DOX,MSNPs)。其中mPEG延长了体内循环时间,一旦纳米药物到达肿瘤部位,会在高MMP2酶的作用下脱去mPEG,暴露出特异性靶向多肽T10 (CGGHAIYPRH),通过受体介导的内吞作用将DOX传递到细胞中。最后,DOX与T10肽之间的腙键在酸性条件下被裂解,活性的DOX被释放出来摧毁肿瘤细胞。实验结果证明pH 7.4时DOX在48 h释放了30%,当pH 5.5时DOX在相同时间内释放90%,证实了胞内的快速响应。MSNPs在MCF-7/ADR细胞中表现出很好的细胞毒性,IC50值为34.33 mmol/L。共聚焦观测到MSNPs对癌细胞的DNA损伤程度是MISNP和DOX处理的1.5倍和1.7倍。动物实验中也进一步证实MSNPs的肿瘤抑制率 (TIR) 为72.09%,分别比游离DOX、T10-DOX和MISNP高2.38、1.35和1.19倍。Cun等[25]利用氯沙坦可以降低肿瘤部位的胶原蛋白,设计出了结合氯沙坦的双响应抗癌纳米颗粒DOX-AuNPs-GNPs。该纳米粒的最大特点是联合使用DOX-AuNPs-GNPs和氯沙坦来消耗肿瘤细胞外胶原蛋白,进一步提高了抗癌纳米药物在肿瘤部位的渗透性。并且在肿瘤部位高表达的MMP2及酸性条件触发下,纳米粒可从117.8 nm以上缩小到50.0 nm 以下,并释放DOX,尺寸的变小更有利于向肿瘤细胞内扩散,进而达到更好的抗肿瘤效果。Zhang等[26]设计了一种一体化的荧光成像引导化疗和光热疗法 (PTT) 结合近红外光 (NIR) 能有效杀死肿瘤细胞的共轭纳米粒子 (IR820-PTX),其载药量高达95.7%。该纳米粒经过肿瘤细胞内化后,在pH和酶的作用下酯键裂解,紫杉醇 (PTX) 和吲哚菁绿 (IR820) 同时释放。此外,可通过NIR刺激IR820产生的荧光成像来指导联合治疗。因此,IR820-PTX能为有效的PTT、化疗和成像组合提供一种“多合一”治疗平台。

表3 一些常见的pH和氧化还原双重刺激响应聚合物Table 3 Advantages and disadvantages of some common pH and redox dual stimuli-responsive polymers
5 酸-光双重刺激响应性聚合物
近年来,基于pH-光双重响应聚合物的研究步入了人们的视线,光刺激具有方便可控性,并且可以精确地控制药代动力学,可以无害地渗透到肿瘤组织中[33]。目前常见的光敏性化合物主要有卟啉、酞菁、二氢卟酚和卟啉4种类型[34],将可降解的光敏性化合物与pH刺激物相结合,可以实现光动力和化疗联合治疗的效果。表5中总结了一些常见的光敏化合物。
Zhao等[35]设计了含有邻硝基苄基 (NB) 光敏性基团的新型pH/光双敏感两亲共聚物PEG43-b-P(AA76-co-NBA35-co-tBA9)。实验证明,在酸介质中紫外照射20 min后6 d内,使得DOX累积释放量高达74.70%,相反没有紫外照射的对照组,6 d内的DOX累积释放仅为3.69%,表现出药物在光照条件下具有持续释放能力。该材料的亮点在于其中PEG增加了药物在体内的长循环,当到达肿瘤部位时在光照条件下邻硝基丙烯酸酯 (NBA)中的苄基基团被裂解,转化为水溶性基团有利于胶束解体,使负载的DOX通过静电相互作用在肿瘤微环境中被释放,可以有效地避免血液循环中药物的过早释放。Meng等[36]成功制备了具有pH/光响应性的双交联聚合物胶束 (CPM),将疏水性光敏邻硝基丁二酸苄酯 (NBS) 接到亲水性乙二醇壳聚糖 (GC) 的主链上,然后与戊二醛(GA) 交联来合成。通过体外释放分析表明在pH 5.0有紫外照射的情况下,12 h内喜树碱(CPT) 累积释放量高达81.68%,载CPT的IC50低至2.3 μg/mL,接近游离CPT (1.5 μg/mL)。流式细胞术和共聚焦激光扫描显微镜共同证实MCF-7癌胞能有效地将负载CPT的CPM胶束内化,并在肿瘤细胞内释放CPT,增强对细胞增殖的抑制作用。因此,这种具有良好生物相容性并具有双响应的抗癌药物载体,为构建肿瘤治疗的智能响应抗癌药物传递系统提供了良好的平台。目前,可生物降解的具有pH和光响应聚合物纳米粒,能够用于临床实验的也是非常少的,这对于生物医学应用仍然具有挑战性。

表4 肿瘤部位各种表达异常的酶及其药物递送系统中的应用Table 4 Various abnormally expressed enzymes at tumor sites and their application in drug delivery systems
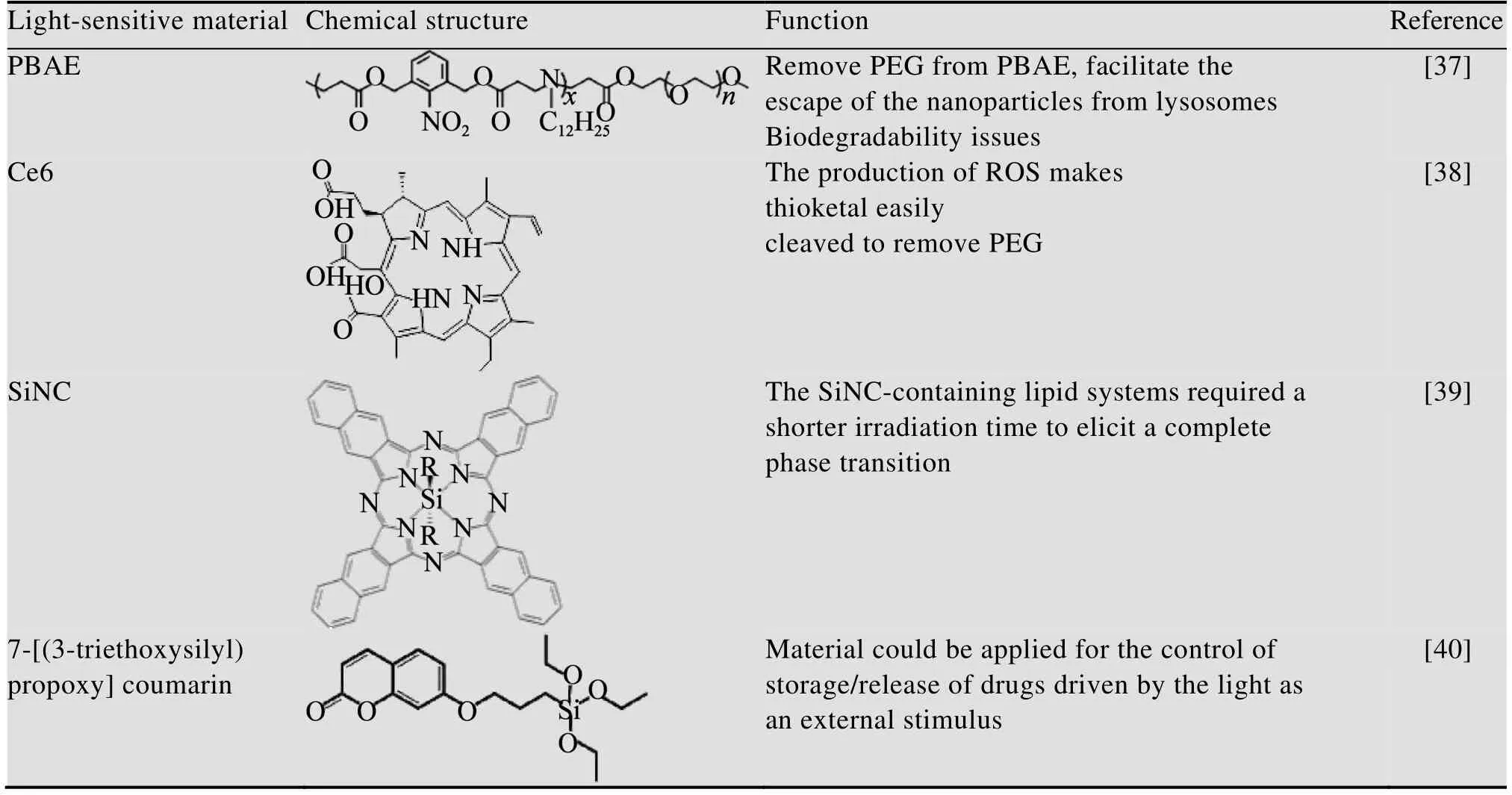
表5 一些常见的光敏化合物Table 5 Some common photoresponsive compounds
6 酸-超声双重刺激响应性聚合物
不同的刺激响应聚合物在抗肿瘤方面具有不同的优点。超声相比其他物理刺激响应具有几大突出优点,例如操作易控、成本低、侵犯性小、穿透深度大等,可应用于深部肿瘤的无创治疗[41]。因此将超声和pH结合使用,可有效提高抗癌药物的疗效。An等[42]设计了一种联合一氧化氮(NO)治疗的多功能仿生纳米载体GSNO/Ce6@ZIF-8@细胞膜 (GCZ@M)。该纳米载体由沸石咪唑骨架8与亚硝基谷胱甘肽 (GSNO) 和二氢卟酚e6 (Ce6) 包埋,再经同源肿瘤细胞膜包裹而成。采用4T1和231细胞评价SDT联合NO气体治疗,结果发现,Ce6浓度达到200 μg/mL,4T1细胞的存活率为80.33%±5.84%,231细胞的也高达83.01%±4.39%,表明材料对细胞的副作用可忽略。采用MTT法观测到,联合治疗组 (GCZ@M+US) 的细胞死亡率显著增加至67.96%±2.28% (2 μg/mL Ce6和7.5 μg/mL GSNO)。该材料的作用原理利用超声(US) 高穿透性引发GSNO释放NO和Ce6生成活性氧,进而产生让肿瘤更致命的过氧亚硝酸盐(ONOO–) 分子和其他活性氮。该仿生纳米载体具有良好的靶向性和生物相容性,为超声联合光动力治疗提供了新的思路。Wang等[43]设计出了一种新型的能够克服多药耐药性的多肽药物纳米复合物 (UPDNs)。该纳米粒具有以下几大优势:①结构明确简单,产率高,可放大生产;②延长体内循环,有效减少了非特异性细胞的吸收;③pH 和超声的联合增强了UPDNs在肿瘤部位的聚积和渗透;④具有主动靶向的能力,增强了肿瘤细胞的吸收;⑤药物的可控释放以及具有可生物降解性等。这使得UPDNs在治疗肿瘤耐药性方面的疗效有了显著提高。
7 结论及展望
基于酸敏感的双重刺激响应抗癌药物载体已是炙手可热的研究领域,并且保持着迅猛发展的趋势。在这些酸敏感双响应抗癌药物递送系统的例子里,药物载体研究已经初步克服了许多抗癌药物递送系统的屏障以及多药耐药性,表现出很好的疗效。但是这些也仅仅处于初步的实验阶段,只有少数被应用于临床治疗。这主要是因为目前开发的大部分抗癌药物载体结构复杂、可重复性差、在体内不可生物降解等,在一定程度上限制了其发展。为改变抗癌药物的现有格局,在未来研究中应该结合多重刺激响应设计纳米药物载体,如pH/光/氧化还原、pH/温度/光、pH/温度/还原/磁等,这种多重刺激响应载体能够结合肿瘤微环境作出相应的响应,进而克服多重生物屏障,达到临床效果。但是多重刺激响应载体的设计存在结构复杂、可生物降解等诸多问题,因此研究者们应尽可能选择一些壳聚糖、β-1,3葡聚糖等可生物降解的聚合物作为载体,然后用各种响应性分子对其修饰。也有研究表明,将各种靶向配体如多肽类、寡核酸配体、抗体片段等接枝在多重刺激响应纳米药物载体上,这样既能使载体具有多重响应,还具有主动靶向性。在当今这个快速发展的社会里,相信随着分子生物学以及高分子材料学等学科的不断发展,能够有效解决材料的诸多问题,使得多重刺激响应的纳米颗粒药物载体的研究在未来癌症治疗中发挥重要作用。
