产对香豆酸酿酒酵母工程菌株的构建与优化
2020-04-15张思琪周景文张国强陈坚
张思琪,周景文,张国强,陈坚
1 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122
2 江南大学 生物工程学院,江苏 无锡 214122
对香豆酸 (p-Coumaric acid,p-CA) 作为植物类苯丙素途径的上游代谢产物,是类苯丙素、木质酚素、黄酮类和芪类化合物的共同前体[1-2]。研究表明对香豆酸及其衍生物具有多种生物学活性,例如降低血脂、抗病毒抗氧化、预防癌症和心血管疾病等[3-4]。因此,对香豆酸及其衍生物在医药、营养保健品、化妆品中得到广泛应用[5-6]。与传统的植物提取和化学合成相比,微生物合成对香豆酸等天然化合物因其具有生产成本低、转化效率高等优势而得到广泛关注[7]。其中,酿酒酵母适合代谢工程的改造和工业规模的发酵,是生产高附加值植物特异性次生代谢产物的重要底盘细胞[5,8]。
目前,对香豆酸的生物合成可以通过苯丙氨酸脱氨羟化后合成或酪氨酸通过酪氨酸解氨酶(Tyrosine ammonia lyase,TAL) 催化生成。由于前者羟化过程所用的4-肉桂酸羟化酶 (Cinnamate 4-hydroxylase,C4H) 表达与活性不足,限制了对香豆酸的合成,酪氨酸裂解途径成为对香豆酸生物合成研究的重要方向。酪氨酸是对香豆酸的合成前体,主要来源于莽草酸途径,因此,酿酒酵母胞内莽草酸合成途径的有效调控会影响对香豆酸的积累 (图1)。有研究表明过表达转酮醇酶(TKL1) 和核糖-5-磷酸酮醇异构酶 (RKI1),可增加莽草酸途径的必要前体赤藓糖-4-磷酸 (E4P),最终芳香族氨基酸提高两倍以上[9-10]。丙酮酸激酶 (CDC19) 的T21E突变体可能可以减缓磷酸烯醇丙酮酸 (PEP) 向丙酮酸的转化,并积累PEP作为莽草酸途径的前体[8]。此外,通过过表达抗反馈基因3-脱氧-D-阿拉伯糖-庚糖酸-7-磷酸 (DAHP)合酶 (ARO3K222L、ARO4K229L) 和分支酸变位酶(ARO7G141S) 解除底物抑制作用[11],过表达多功能酶基因 (ARO1) 和莽草酸激酶 (EcaroL) 强化代谢途径和解除限速步骤[5],敲除分支途径上的邻氨基苯甲酸合酶 (TRP2) 和预苯酸脱水酶 (PHA2)基因,阻止色氨酸和苯丙氨酸竞争氮通量,敲除苯丙酮酸和4-羟苯丙酮酸 (PPY和HPP) 脱羧酶(ARO10、PDC5和PDC6),减少副产物苯乙醇的产生等策略[3],均可有效提高对香豆酸的产量。
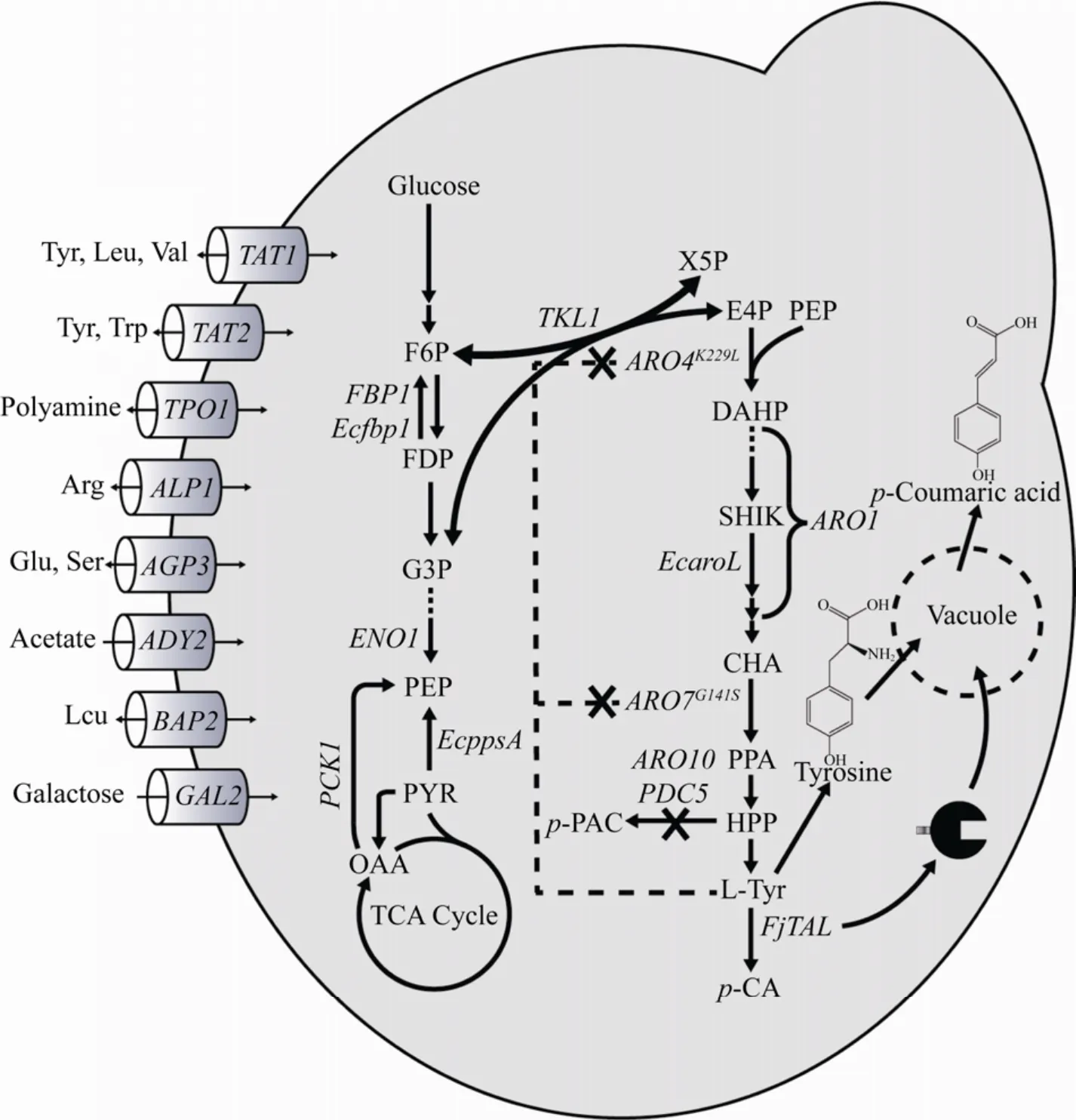
图1 酿酒酵母中对香豆酸的生物合成途径和相关转运蛋白Fig.1 Biosynthetic pathway for p-Coumaric acid and amino acids,carbohydrate transporters in S.cerevisiae.FBP1:fructose-bisphosphatase; Ecfbp1:fructose-bisphosphatase from E.coli;PCK1:phosphoenolpyruvate carboxykinase;EcppsA:phosphoenolpyruvate synthase from E.coli;ENO1:phosphopyruvate hydratase; EcaroL:shikimate kinase from E.coli;ARO3 and ARO4:3-deoxy-7-phosphoheptulonate synthase; ARO1:pentafunctional arom protein;ARO7:chorismate mutase;FjTAL:tyrosine ammonia-lyase TAL from Flavobacterium johnsoniaeu;TAT1:amino acid transporter for valine,leucine,isoleucine,and tyrosine; TAT2:high affinity tryptophan and tyrosine permease;TPO1:polyamine transporter of the major facilitator superfamily; ALP1:arginine transporter. AGP3:polyamine transporter of the major facilitator superfamily; ADY2:acetate transporter; BAP2:high-affinity leucine permease;GAL2:galactose permease.
为获得优良的产对香豆酸工程菌株,本研究以酿酒酵母CEN PK2-1D为底盘细胞,首先通过敲除酪氨酸合成竞争路径基因ARO10和PDC5,突变芳香族氨基酸合成调控基因ARO4K229L与ARO7G141S,解除芳香族氨基酸负反馈抑制并整合酪氨酸解氨酶FjTAL,构建了产对香豆酸酵母菌株C001。为进一步优化对香豆酸产量,研究了8个不同氨基酸、多胺和糖类相关转运基因敲除对对香豆酸合成的影响,并且过表达酵母和大肠糖异生途径上的关键基因,强化前体的供应,最后利用酪氨酸解氨酶亚细胞定位的方法,进一步提高对香豆酸的产量,最终获得工程菌株的对香豆酸产量可达593.04 mg/L。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
酿酒酵母CEN PK2-1D作为出发菌株。大肠杆菌Escherichia coli菌株JM109用于所有质粒的克隆。PCR引物及测序服务均由生工生物工程 (上海) 股份有限公司提供。所用菌株和引物详见表1和表2。
表1 本研究所用的菌株Table 1 Strains used in this study

表2 本研究所用的引物Table 2 Primers used in this study
1.1.2 主要酶及相关试剂盒
一步克隆酶试剂盒购自南京Vazyme生物科技有限公司;DNA聚合酶、DNA Marker及pMD19-T Simple Vector购自TaKaRa公司;其他化学试剂均购自国药 (分析纯)。
1.1.3 培养基
LB培养基:0.5%酵母提取物,1%蛋白胨,1%氯化钠,筛选培养基添加100 μg/mL苄青霉素。
YPD培养基:1%酵母提取物,2%蛋白胨,2%葡萄糖。
SC培养基:0.5%硫酸铵,0.174%酵母基础氮源培养基 (YNB),2%葡萄糖。根据酵母内载体携带的标签添加50 mg/L缺失的氨基酸组分,固体培养基中都额外添加2%的琼脂。
1.2 质粒与菌株构建
来源于黄杆菌的酪氨酸解氨酶基因 (FjTAL)为本实验室前期保存,酵母启动子、基因和终止子从CEN PK2-1D基因组上扩增,EcppsA、Ecfbp1、EcaroL基因从大肠杆菌基因组上扩增。使用Vazyme的一步克隆酶或Gibson多片段组装酶构建质粒,通过PCR及测序验证质粒是否构建成功。通过融合基因序列的上游和下游构建敲除框,利用CRISPR/Cas9技术敲入或者敲除目标基因,分别设计位于基因与同源臂序列上的引物,通过PCR验证基因是否被成功敲除或敲入并测序验证。
1.3 产对香豆酸酵母菌株的发酵培养
挑选酿酒酵母单菌落接种到YPD或SC培养液中在30 ℃、220 r/min活化培养18–20 h。然后按2%接种量转接到装液量为25 mL的250 mL摇瓶中,30 ℃、220 r/min发酵72 h,初始葡萄糖浓度为20 g/L。按一定时间间隔取样,每次取100 μL发酵液稀释至OD600在0.2–0.8之间,用分光光度计检测OD600处的吸光值。
1.4 亚细胞定位与分析
构建质粒pRS424-TEF1p-vtFjTAL,将酵母羧肽酶Y (PRC1) 锚定信号肽 (KAISLQRPLGLDKDVL)与FjTAL蛋白的N末端融合使其具有液泡定位功能[12]。在酿酒酵母菌株中分别表达FjTAL和vtFjTAL(vacuole-targetedFjTAL),HPLC检测对照菌株和表达vtFjTA1菌株发酵液中对香豆酸含量。
1.5 对香豆酸产量的测定
取500 μL发酵液于1.5 mL离心管中,加入等体积甲醇,振荡混匀,12 000 r/min离心2 min,用1.5 mL注射器取上清,上清过孔径0.2 μm的尼龙滤膜。使用HPLC (Thermo) 配备Hypersil ODS-2 (250 mm×4.6 mm,5 μm) 的C18柱与紫外检测器检测发酵液中对香豆酸的含量。对香豆酸检测波长为290 nm,柱温40 ℃,流动相流速1.0 mL/min,上样量10 μL。洗脱所用的两种流动相A相和B相分别为加入0.1% (V/V) 三氟乙酸(TFA) 的水和乙腈。流动相梯度洗脱程序为:B相组分从10% (0–0.1 min) 开始,之后B相组分从10%到40% (0.1–9.0 min) 线性增加,然后B相组分从40%增加到60% (9.0–15.0 min),之后B相组分再从60%降到10% (15–18 min),然后B相组分维持在10% (18.0–20.0 min)直至结束,对香豆酸滞留时间为9.8 min,通过与标准曲线拟合,对对香豆酸的浓度定量。
2 结果与分析
2.1 产对香豆酸重组酵母菌株的构建
莽草酸途径中,ARO4和ARO7受芳香族氨基酸的反馈抑制,这会阻碍芳香族氨基酸的合成[11]。此外,丙苯酮酸 (PPY) 和4-羟基苯丙酮酸(4-HPP) 是生物合成芳香族氨基酸的重要前体物质,而ARO10和PDC5催化PPY和4-HPP生成相应的苯乙醛和4-羟基乙酸,影响了对香豆酸前体供应[13]。为获得一株产对香豆酸的出发菌株,分别以GAL1、10p和GAL7p作为ARO4K229L、ARO7G141S和FjTAL的启动子,通过CRISPR/Cas9基因编辑方法,将ARO4K229L和ARO7G141S整合到ARO10的位置上,解除酪氨酸负反馈抑制和阻断旁路竞争途径,将酪氨酸解氨酶FjTAL整合至PDC5的位置上。进一步敲除GAL80解除其对GAL系列启动子的影响[14],获得产对香豆酸重组菌株C001 (图2)。通过摇瓶发酵评价其产香豆酸性能,测定发酵液中芳香族氨基酸和对香豆酸产量。发酵结果表明发酵液中含有296.73 mg/L的对香豆酸,此外分别有22.55 mg/L、55.20 mg/L和56.29 mg/L的色氨酸、苯丙氨酸和酪氨酸积累(图3)。
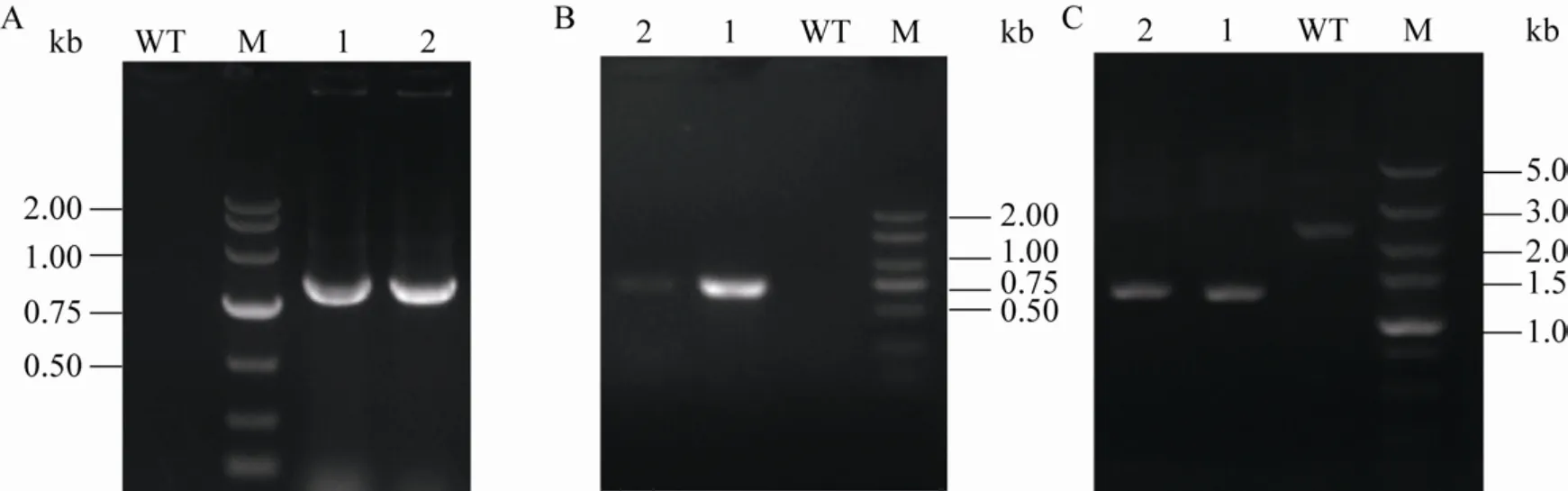
图2 产对香豆酸重组菌株PCR验证Fig.2 PCR validation of recombinant strain C001.(A) Integration of FjTAL at PDC5 site.(B) Integration of ARO4K229L and ARO7G141S at ARO10 site.(C) Knockout of GAL80.WT:wild type;M:DNA marker;1–2:strain C001.

图3 C001菌株发酵72 h后色氨酸、苯丙氨酸、酪氨酸和对香豆酸产量Fig.3 Yield of tryptophan(Trp),phenylalanine(Phe),tyrosine(Tyr) and p-CA for C001 strain at 72 h.
2.2 不同转运蛋白对对香豆酸积累的影响
有研究表明,敲除TAT1、TPO1、ALP1、AGP3、ADY2、GAL2和BAP2等转运相关基因,对香豆酸产量可提高20%–50%[15]。通过对蛋白功能比较发现,这些蛋白主要与氨基酸、多胺和糖类的转运相关 (表3),例如TAT1与TAT2均与芳香族氨基酸的转运密切相关[16]。为进一步研究不同转运蛋白对对香豆酸合成的影响,在C001的基础上分别敲除TAT1、TAT2、TPO1、ALP1、AGP3、ADY2、GAL2和BAP2共8个基因,并评价其对菌体生长的影响。
结果表明敲除TAT1、TAT2、ALP1、TPO1和ADY2对香豆酸产量没有明显提高且对菌体生长影响较小 (图4)。有研究报道缺失TAT1可以减少胞内酪氨酸外泄,增强底物的供应,从而提高对香豆酸产量[15]。本研究中缺失TAT1对香豆酸产量却没有提高,可能是因为C001对香豆酸产量较低,单敲除TAT1并没有影响胞内酪氨酸前体的供应,不会显著改变对香豆酸产量。进一步在TAT1缺失的基础上敲除同样具有酪氨酸转运功能的TAT2,结果表明双敲除菌株前24 h生长缓慢,推测双敲除菌株C010在生长早期芳香族氨基酸摄取受限,导致前期生长缓慢,进而影响对香豆酸产量。此外,敲除AGP3、BAP2和GAL2后对香豆酸产量分别提高了8.98%、16.82%和46.14%。然而,在单敲除GAL2的C009菌株基础上分别敲除AGP3(C011) 和BAP2(C012),对香豆酸产量并未进一步提高。其中C011菌株生长受到影响,对香豆酸产量反而降低了7.76%。初步研究结果表明部分转运蛋白的敲除可以有效提高对香豆酸产量,而不同转运蛋白的协同作用还需进一步研究。
2.3 强化糖异生途径积累PEP和E4P
莽草酸途径是芳香族氨基酸合成的主要途径,其中PEP和E4P是该途径的关键前体 (图1)。在酿酒酵母中,糖异生途径合成PEP由PYC1和PCK1催化[17],而在大肠杆菌中,EcppsA可将丙酮酸转化为PEP[18]。酿酒酵母和大肠杆菌中,果糖-1,6-二磷酸 (FDP) 在果糖二磷酸酶FBP催化作用下转化为果糖6磷酸 (F6P),进而合成E4P[19]。为进一步提高前体PEP和E4P的供应,分别过表达PCK1、EcppsA、ENO1、FBP1、Ecfbp1并分析其对香豆酸积累的影响 (图5)。结果表明单独过表达ENO1、PCK1对香豆酸产量都没有显著提高,而在C015中过表达EcppsA后,对香豆酸产量提高到475.11 mg/L。在过表达EcppsA基础上分别过表达ENO1、PCK1,改造后菌株C016和C017的对香豆酸产量并没有进一步提升。以往也有类似研究表明在酿酒酵母中过表达PCK1时并没有明显增加PEP积累,可能是由于酿酒酵母胞内草酰乙酸浓度过低导致[20]。最后,分别利用低拷贝和高拷贝质粒过表达酿酒酵母和大肠杆菌来源的果糖双磷酸酶基因,均对菌株生长有明显抑制作用,可能是过表达果糖双磷酸酶基因使胞内同时进行糖异生和糖酵解循环造成ATP浪费[21],从而阻碍酵母正常生长。以上结果表明对糖异生途径中不同基因的组合调控,有利于进一步强化对香豆酸前体供应。

表3 TAT1、TAT2、TPO1、ALP1、AGP3、ADY2、GAL2和BAP2基因的功能Table 3 Function of 8 genes including TAT1, TAT2,TPO1, ALP1, AGP3, ADY2, GAL2 and BAP2

图4 转运蛋白基因敲除对对香豆酸产量(A)及酵母生长(B)的影响Fig.4 Effect of transporter genes knockout on p-CA yield and yeast growth.(A) Effects of single and double knockouts of 8 genes on p-CA yield.(B) Effects of single and double knockout on strain growth at 24 h in fermentation.The OD600 of C001 was set as 1.
2.4 FjTAL蛋白亚细胞定位
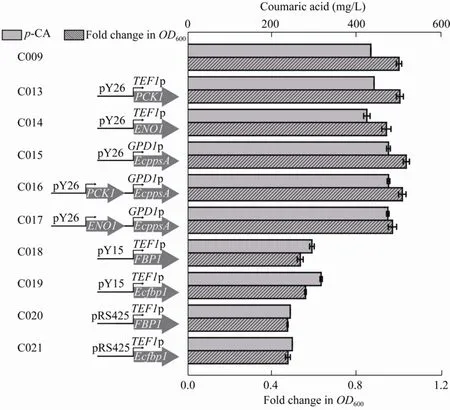
图5 糖异生和糖酵解途径相关基因对对香豆酸产量和重组菌生长的影响Fig.5 Effects of gluconeogenesis and glycolysis pathways related genes on p-CA yield and growth.The OD600 of C009 was set as 1.
前期研究表明,FjTAL不能将发酵过程中积累的酪氨酸完全转化为对香豆酸,导致部分前体芳香族氨基酸的积累。而FjTAL游离过表达可以提高酪氨酸的转化效率,对香豆酸产量提高了4.64%,因此FjTAL催化效率不足是影响对香豆酸积累的限制因素。已有研究报道,酵母液泡会在氮源丰富时储存50%的氨基酸,在氮源缺乏时,液泡中氨基酸排泄到细胞质中保证酵母生长[22]。为进一步促进酪氨酸有效转化,利用羧肽酶Y的锚定肽将FjTAL定位到液泡,改造后菌株C026对香豆酸产量为593.04 mg/L,提高了23.31%(图6A)。以上研究结果表明,相较于游离表达FjTAL,将FjTAL定位于液泡的策略是有效的,可能是由于液泡定位后的FjTAL能够快速利用液泡中的酪氨酸,增加局部氨基酸底物浓度,提高催化效率,使得对香豆酸产量提高。
3 讨论
对香豆酸及其衍生物在医药和保健品领域具有重要的应用前景,因此构建能够高效合成对香豆酸的工程菌株具有重要意义。本研究中,通过表达莽草酸途径上的抗反馈抑制基因ARO4K229L和ARO7G141S解除限速步骤,敲除ARO10和PDC5阻断旁路竞争途径和过表达FjTAL,获得产对香豆酸工程菌株C001。在C001的基础上,分别敲除TAT1、TAT2、TPO1、ALP1、AGP3、ADY2、GAL2和BAP2,筛选影响酵母合成对香豆酸的关键基因GAL2,GAL2敲除菌株C009对香豆酸产量提高了46.14%。有研究表明过表达莽草酸途径相关基因能有效提高对香豆酸产量[23-24],我们尝试过表达了莽草酸途径上的基因ARO1和EcaroL,但没有明显效果。为进一步强化PEP和E4P前体供应,过表达酵母和大肠杆菌糖异生途径上的PCK1、EcppsA、ENO1、FBP1、Ecfbp1基因,研究发现只有过表达EcppsA基因可将对香豆酸产量提高至475.11 mg/L。由于FjTAL酪氨酸解氨酶是对香豆酸合成的关键酶,其催化性能不足,限制对香豆酸的有效积累[25]。利用亚细胞定位策略,将FjTAL过表达并锚定到酵母液泡上,提高液泡中酪氨酸利用率,对香豆酸产量提高至593.04 mg/L。综上,通过代谢工程优化产对香豆酸酵母工程菌株,对香豆酸产量较出发菌株提高了近一倍 (图6B),为接下来对香豆酸衍生物的高效生物合成研究奠定基础。

图6 FjTAL锚定到液泡和系统代谢工程改造优化对对香豆酸产量的影响.(A: FjTAL游离表达和锚定到液泡对对香豆酸产量的影响;B:C001基础上敲除及过表达不同基因对对香豆酸产量的影响)Fig.6 Effect of vacuole-targeted FjTAL enzyme and metabolic engineering optimization on p-CA yield.(A) Effects of free expression and vacuole-targeting FjTAL on p-CA yield.(B) p-CA quantification of the different engineered strains.
