环境因素对层流下腐蚀静电场的影响
2020-04-15刘德红张建春王向军
刘德红,张建春,王向军
(1.武汉科技大学 城市学院,湖北 武汉 430083;2.31437部队,辽宁 沈阳 110020;3.海军工程大学 电气工程学院,湖北 武汉 430033)
0 引言
随着舰船水下静电场研究的不断深入,关于静电场的建模方法逐渐成为国内外的重要研究课题。当前对舰船在海水中产生静电场的建模方法主要有等效源法、边界元法及有限元法[1-4]。不同金属间发生电偶腐蚀产生的腐蚀电流密度是腐蚀静电场的主要来源之一,其大小极易受环境变化的影响,例如温度、海水含盐度及海水与船壳的相对流速,同时海水中的含盐度以及温度会对海水中的电导率产生直接影响[5]。因此,虽然利用上述3种建模方法可得到海水中较准确的舰船静电场分布特性,但并没有考虑金属在流动海水中的实际腐蚀情况,最终导致与实际测量的结果存在较大误差[6-7]。
为了进一步了解实际流动海水条件下的静电场分布特性,缩小理论模型与实际测量结果的误差,本文结合电化学及流体力学相关理论对层流介质中的静电场特性进行研究,分析腐蚀静电场在不同环境因素下的变化规律。基于得到的腐蚀电流密度建立点电荷模型,对海水任意位置处产生的腐蚀静电场进行求解,使其结果与实际测量结果更贴切。本文成果可以为今后研究实际海水情况下的电场特性分布奠定基础。
1 扩散控制下的电流密度
1.1 静止介质中的电流密度
船体在海水中的腐蚀原理与电化学中的原电池原理相同,电位较负的铁作为阳极与电位较正的铜发生电化学腐蚀。由腐蚀电化学原理可知,金属的腐蚀极化形式主要有电化学极化、浓差极化及电阻极化3种,在海水中因离子的存在,电阻极化可以忽略[8]。
由于船体与螺旋桨两种金属材料的电化学性质存在差异,当舰船在海水中发生腐蚀时,氧化、还原反应分别在船壳及螺旋桨表面进行。氧化反应与船壳表面金属的失电子速度有关,其反应速度大小由电化学极化控制,同时螺旋桨表面主要以氧的还原反应为主。由文献[9]可知,氧在螺旋桨表面的还原反应又与介质中氧的传质过程有关,即浓差极化控制。因此,舰船在海水中产生的腐蚀电流密度受电化学极化及浓差极化共同控制。
由以上分析可知,所有影响氧的扩散速度及电化学极化的环境因素均会对腐蚀电流密度的大小产生影响。腐蚀电化学反应中阳极及阴极产生的电流密度[8]可分别表示为
(1)
(2)

氧在溶液中的溶解度与介质的温度及含盐度有关,并且盐度的变化会对电解质的电导率产生影响。在大气压强一定情况下,电解质中氧的浓度表达式[10]为
c0=2.63×10ΔH(1/T-1/298)/2.303R-4(1-10-S),
(3)
式中:ΔH为氧在电解质中的溶解热,ΔH=1 013.3 J/g;S为电解质中的含盐度(‰)。
氧的扩散系数D及溶液的运动黏度系数η也会随温度的变化而改变,二者与温度的关系表达式如下:
(4)
η=100.25+0.002/T-0.012 5T-1.67×10-4T2,
(5)
式中:VO2、VH2O分别为氧和水分子在标准条件下的摩尔体积,VO2=22.4 L/mol,VH2O=1.8×10-5m3/mol;nw表示水的缔合参数,nw=1.67;μ为水的黏度系数。
根据电偶腐蚀原理可知,构成电偶腐蚀的两种不同属性的金属电极电位会随着反应时间的进行,阴极与阳极金属最终得到一个共同电位,该电位称为腐蚀电位(或混合电位),对应的电流称为腐蚀电流密度,该过程由Butler-Volmer方程控制。在实际反应过程中,环境因素变化会对金属的平衡电位及交换电流密度产生影响,二者与环境因素的关系式[7]可表示为
(6)
(7)
式中:A为金属铁与氧发生电偶腐蚀时的阿伦尼乌斯常数,A=3.2×10-4;Ea、Ec分别为阳极和阴极的实验活化能(J/mol);λ为-1~1之间的修正系数;T0为标准条件下的温度值,T0=298 K.阴极平衡电位及交换电流密可按(6)式、(7)式求得,这里不再赘述。
将(3)式~(7)式代入(1)式、(2)式中,便可得到静止电解质中的净电流密度i=ia-ic.
1.2 动水条件下的电流密度
当腐蚀反应速度由氧的扩散速度控制时,电解质的流动会改变氧在介质中的扩散能力[11]。介质的流动状态根据雷诺数的不同可分为层流和湍流两种状态。在不考虑涡流及回流的情况下,由于流动介质在金属表面边界层内的流动状态可近似为层流,此处只对层流状态下的电化学腐蚀进行分析。
金属处于动水条件下,流速的大小会直接影响金属表面氧的扩散层厚度,其厚度会随着流速的增大而减小,增强氧向金属表面的传质过程,从而使反应过程中的极限电流密度增加[12]。氧在金属表面产生的扩散层厚度分布如图1所示。图1中,x为金属任意处与金属平板端点O点的距离,v为介质的流动速度。
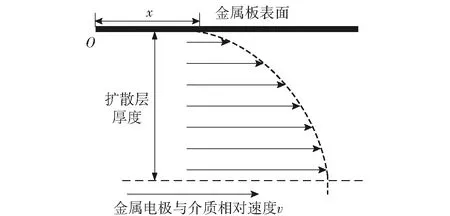
图1 金属表面扩散层示意图Fig.1 Schematic diagram of diffusion layer on metal surface
在层流(无湍流)条件下,氧的扩散层厚度与介质流速的关系[12-13]为
δ=D1/3(η/S)1/6x1/2v-1/2;
(8)
根据文献[7]可知,流动介质下的极限扩散电流密度为
id=ncFc0D2/3v1/2(η/S)-1/6x-1/2.
(9)
综上所述可得,层流介质中在电化学极化和浓差极化混合控制下的腐蚀电流密度为
(10)
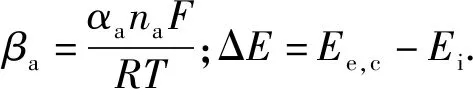
2 基于Sommerfeld积分法对点电荷电位的求解
层流介质中金属表面发生的腐蚀反应属于均匀腐蚀[14-15],当介质中的测量点与腐蚀反应电极距离较近时,金属之间的距离不能被忽视。为了提高理论模型的准确性,将其分别等效为正、负电荷模型。当金属发生腐蚀的面积较大时,其面积也应考虑在模型中。本文主要研究环境因素对电场的影响,忽略腐蚀面积对电位的影响。假设两种金属的腐蚀面积均为ΔAFe,Cu,电解质的层流流动速度为v,电荷坐标、测量点坐标以及介质参数如图2所示。图2中,εa、σa、μa分别为空气介质中的相对介电常数、电导率和磁导率,εs、σs、μs分别为海水介质中的相对介电常数、电导率和磁导率,εf、σf、μf分别为海床介质中的相对介电常数、电导率和磁导率,h为金属板与海水介质表面的垂直距离,L+、L-分别为正、负电荷模型到测量点的距离,H为海水深度,(x+,y+,0)、(x-,y-,0)、(x,y,z)分别为正电荷、负电荷和测量点在模型坐标系中的坐标参数。

图2 3层介质中的点电荷模型Fig.2 Point charge model in threel-layer media
根据点电荷求解电位的表达式φ=q/(4πσaR+)(R+为点电荷到求解位置的距离),首先利用汉克尔变换对1/R+进行Sommerfeld积分公式展开,得
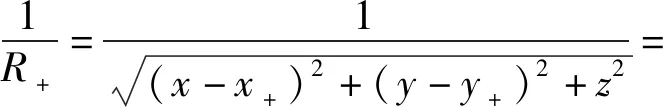
(11)

根据物理学中对电流i的定义可知,iΔAFe,Cu=q/t(t≠0),q为电化学反应过程中产生的电荷强度,t为反应时间。当金属表面在稳态传质过程下发生均匀腐蚀时,单位时间内产生的腐蚀电流强度可与通过金属表面的电荷总量近似相等,即iΔAFe,Cu=q[6].在此基础上,对正电荷产生的电位进行计算,在3层介质中产生的电位可分别表示为
(12)

(13)
式中:
(14)
γa,s=(σa-σs)/(σa+σs),γs,f=(σs-σf)/(σs+σf),γ′=2σf/(σs+σf)。
由于空气中的电导率σa=0 S/m,则γa,s=-1.(13)式中的系数可简化为
(15)
由|γs,fe-2k(H+h)|<1,可对(15)式中的分母进行展开:
(16)
式中:m为常数变量。
(16)式代入(12)式,可求得海水中的腐蚀电位:
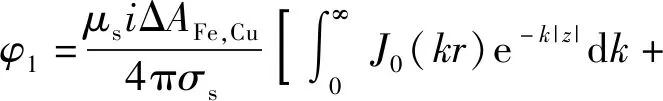
(17)
(17)式的第1项为点电荷电位。第2、3项包括无穷项和,根据(11)式的逆运算,可得第m项的积分为

(18)

(19)
式中:
(18)式~(19)式代入(17)式,可得正电荷在场点处产生的电位为
(20)
同理可得,负电荷在海水中测量点处产生的电位为
(21)
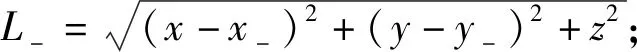

将1.2节(10)式求解得到的腐蚀电流密度i代替(21)式,即可求得流动介质中在电化学极化和浓差极化两种混合控制下产生的电位分布,并进一步求得静电场各分量及模值。
3 算例仿真
由电化学相关理论知,电导率σs的大小与介质中的含盐量以及温度有关[17],表达式如下:
lgσs=0.576 27+0.892 1lg(S/1.806 5)-
10-4(298-T)[88.3+55(298-T)+
0.010 7(298-T)2-S/1.806 5(0.145-
0.002(298-T)+0.000 2(298-T)5)].
(22)
3.1 温度对电场幅值的影响
仿真条件设定:介质溶液深度H=150 m,正、负电荷分别位于(1 m,5 m,5 m)和(10 m,5 m,5 m)的位置处,在(0 m,0 m,50 m)处测量温度变化对电场分布的影响,假设介质流速v=1 m/s,介质含盐度S=30‰.在我国近海处由于海域不同及四季变化,海水温度一般为273~313 K[18].电场强度三分量Ex、Ey、Ez随温度变化如图3所示。
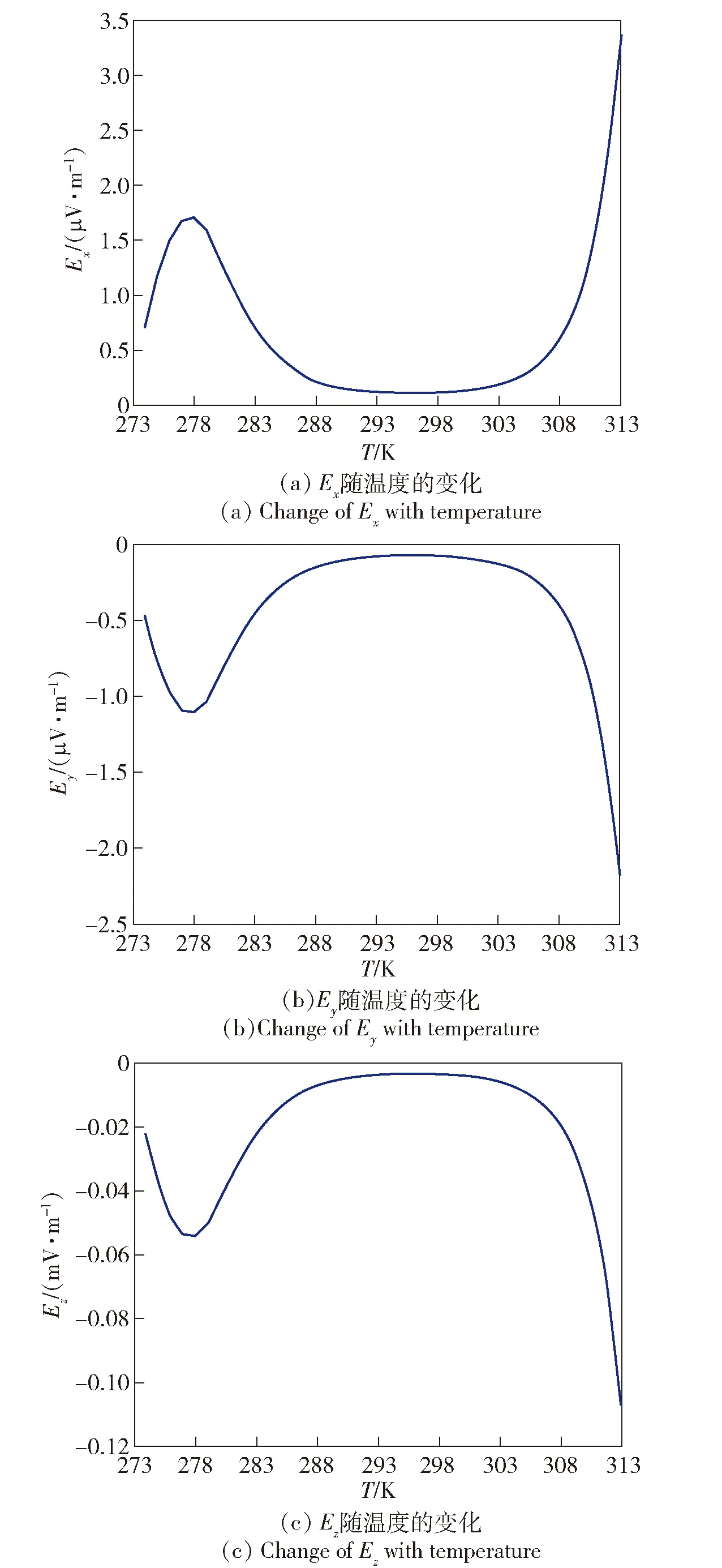
图3 电场随温度的变化Fig.3 Change of electric field with temperature
由(10)式知,在电化学极化和浓差极化的混合控制下,腐蚀电流密度中多个参数受温度影响。在介质中氧浓度充足情况下,温度的升高会加速金属的腐蚀使极限电流密度增大,从而影响腐蚀相关的静电场分布。由图3可以看出,电场三分量随着温度变化并非一直增加或减小,首先会在273~283 K之间出现极值,然后在303 K时会随着温度升高而继续增加,三分量变化规律基本一致。产生这种变化情况主要是因为虽然温度升高会降低氧在溶液中的溶解度,但温度增加会加速氧的扩散,使氧分子更容易到达金属表面发生反应。
虽然温度增加会使氧的活化能增加使其更利于在阴极发生还原反应,同时会使其在溶液中的扩散速度增加,使极限电流密度id增加,但介质电导率的变化对介质中静电场产生的影响也应考虑在内[19],故电场强度随温度变化是由腐蚀电流和电导率随温度变化共同决定的。
3.2 盐度对电场幅值的影响
在不同海水中,由于其含盐量不同,海水电导率及氧含量也会产生差异,从而影响不同金属间的腐蚀情况。为了得到不同盐度下的电场变化,对303 K温度下电场强度随盐度的变化进行仿真研究,其他条件与3.1节相同,不同盐度下电场强度的变化如图4所示。

图4 电场随盐度的变化Fig.4 Change of electric field with salinity
由图4可知,电场强度会随着盐度的增加而减小,主要原因在于盐度增加会导致海水中氧含量的减小,进而导致阴极还原产生的腐蚀电流密度减小。同时盐度变化也会使溶液中的导电离子浓度增加,使溶液的电导率增加,电导率随盐度的变化如图5所示,故总体结果使电场强度减小,电场三分量的变化情况基本一致。由(3)式可知,造成这种情况的主要原因是盐度增加使海水中氧的含量减小程度变弱造成的。

图5 溶液电导率随盐度的变化Fig.5 Change of solution conductivity with salinity
3.3 流速对电场幅值的影响
当介质处于流动状态时,流速的增加会使扩散层的厚度减小,溶液中的氧更易在金属表面发生还原反应,使极限扩散电流密度增加。流动状态下的腐蚀主要是由氧的扩散步骤进行控制,因此,在实际情况下应考虑流速变化对电场的影响[20]。
假定溶液的含盐度为40‰,温度为293 K,保持其他条件不变,对腐蚀静电场幅值随介质与金属相对流速的变化进行研究,其电场三分量的变化曲线如图6所示。

图6 电场随介质相对流速的变化Fig.6 Change of electric field with relative flow rate
在不同流速下,电解质对氧在阴极表面产生的还原反应有较大影响。由(9)式可知,流速变化会直接影响到极限扩散电流密度的大小,而阴极电流密度ic又与其有关,进而影响电场强度。当相对流速较小时,阳极与阴极产生的腐蚀电流密度由电化学极化及浓差极化的共同控制,当相对流速较大时,通过对比(1)式、(2)式可知,阴极电流密度近似于极限扩散电流密度,此时金属在电解质中的腐蚀速度主要由阴极的极限扩散电流密度控制。
4 实验验证
在实验过程中,需要对温度、盐度以及介质流速3种因素进行测量。为了满足测量温度变化下电场测量的要求,实验在可加热的1.0 m×1.0 m×1.5 m的塑料水池中进行,水深1 m,该水池加热装置可进行保温操作。实验装置选用旋转圆盘模型,旋转时其表面的介质流动状态近似为层流状态[13]。腐蚀金属选用由武汉钢铁公司生产的型号为AH32、2 cm×2 cm规格的钢板及型号为GB1176、半径5 cm的铜圆盘,厚度均为5 mm,两金属中间以绝缘塑料隔离并用导线连接,导线及焊接处防水效果良好,圆盘模型的结构分布图及实验铜盘模型如图7所示。将该模型置于水面下约0.4 m处,电场测量传感器的电极材料选用Ag/AgCl,传感器位于水池底部中心位置,对不同工况下的腐蚀静电场大小进行定点测量。

图7 实验原理图及金属模型Fig.7 Experimental schematic diagram and metal model
铁板的几何等效中心位于距离圆心8 cm处,当旋转圆盘的转速为n(r/s)时,金属铁的运行速度可表示为0.16πn(m/s)。为了避免人为因素带来的实验误差,选取每一工况下的电场模平均值进行对比分析。对盐度、温度及流速3种因素变化时产生的电场模进行定性分析时,保持其他两种因素不变,对所研究的环境因素不同值时产生的电场模值进行测量,将相同时间内测量得到的电场模值平均值与仿真结果进行对比,结果如图8所示。不同工况下的实验测量均在实验条件稳定后对电场信号进行采集,采集时间均为1 min.

图8 实验与仿真结果对比Fig.8 Comparison of experimental and simulated results
由图8(a)看出,当速度给定时,静电场模值与温度的变化曲线拟合程度较好,符合实际情况,平均误差约为9.8%.当温度大于303 K时实验测得的电场强度相对仿真结果有较大的误差,最大误差约为63%,此时铁表面有红褐色固体。在实际情况中电场测量选用的传感器材料为Ag/AgCl,温度变化会对电场测量传感器的准确度产生影响,同时最主要的原因在于温度变化会使一部分氧在铁表面发生还原反应,形成腐蚀产物Fe(OH)3阻止铁的进一步腐蚀,使阳极在溶液中产生的阳极净电流密度减小,从而使电场强度降低产生误差。
保持溶液温度在283 K进行盐度变化实验。由图8(b)可以看出,在含盐度50‰时电场随盐度的变化与实验结果也存在不可忽视的误差,平均误差约为4.6%,实验采用工业盐的溶解进行海水含盐度的模拟。随着盐度增加,Cl-离子浓度随之增加,进而会使腐蚀情况加剧,不可溶解的腐蚀产物吸附在金属铁表面,形成保护膜阻断腐蚀反应的进一步发生,使腐蚀反应达到动态平衡[21]。
图8(c)显示了金属在不同流速下的电场拟合结果。由图8(c)可见,在速度较小时金属在不同流速下具有较好的拟合性,平均误差约为6.08%.当相对流速在3 m/s时实验测量突然增大,与理论结果有较大误差,最大误差约为96.2%.这主要是因为水池的局限性,在相对速度达到3 m/s时,在溶液中产生湍流增加腐蚀,进而使腐蚀电场增加。此外,由于实验设备的限制,当电机转速较高时,圆盘模型因转速过高而发生抖动,破坏圆盘表面介质的层流状态,其实验结果超出了模型的研究范围,因此会使结果出现较大误差。
为了进一步说明介质的流动会加剧金属腐蚀的情况,并验证静止介质中腐蚀电流推导的正确性,给出静止介质中静电场幅值随温度和盐度的变化曲线如图9所示。
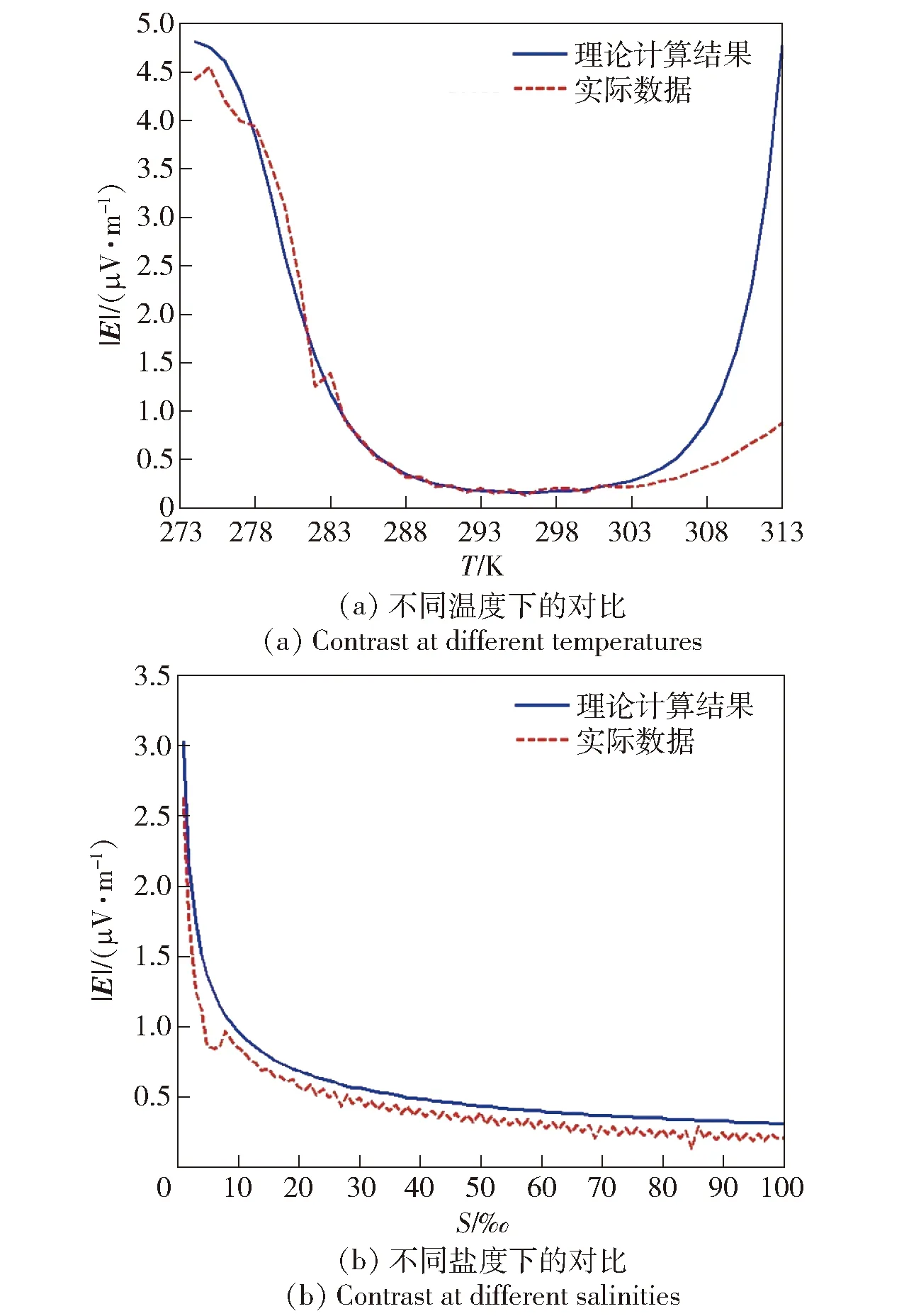
图9 静止介质中结果对比Fig.9 Result comparison in static media
由图9可以看出,当介质静止时电场模在温度较低时实验与仿真结果拟合度较好,平均误差约为5.4%.303 K后实验与理论值出现较大误差,产生误差的原因与图8(a)相同。此外,通过对比图8和图9可以看出,静止溶液中的电场幅值明显减小,主要原因是由于在静止溶液中氧的扩散速度主要以扩散传质及自然对流为主,此时在金属表面产生的扩散层厚度相对层流条件下较大,最终造成腐蚀电流密度减小。因盐度增加并不会使氧的扩散系数和扩散层厚度发生变化,这也是造成图9(b)与图8(b)电场模幅值变化规律近似的原因。
5 结论
本文结合电化学及流体力学原理对层流溶液中因腐蚀产生的静电场进行仿真研究,得出静电场强度随温度、盐度及相对流速等环境因素的变化规律。实验与理论结果表明,在实际情况下的腐蚀情况较理论模型更复杂,理论模型具有局限性,但对环境因素进行定性分析时,环境因素对静电场的影响规律在一定变化范围内与实验结果基本一致,验证了理论模型的正确性,为进一步研究静电场的特性奠定了理论基础。
在研究介质流动腐蚀过程中,铁表面的氧化物会在金属表面形成一层氧化膜,阻止反应的进行,本文中并未考虑,一些文献中涉及到速度的变化不会对电场造成太大变化的原因就在于此。研究速度影响时,溶液对金属表面的冲刷及金属表面光滑情况也是影响动水条件下极限电流密度的重要因素[11,20],这些因素在理论解析中尚未进行研究。
