miR-204-5p靶向溴结构域蛋白4对舌鳞状细胞癌细胞SCC25增殖和迁移侵袭的影响研究
2020-04-14郑晶张雨温李天客包阳张素欣
郑晶 张雨温 李天客 包阳 张素欣
河北医科大学第四医院口腔科,石家庄 050011
舌鳞状细胞癌的患病率约占口腔癌的43%,是一种常见的具有强浸润性、高淋巴结转移率的口腔癌[1-2]。研究[3-4]指出,舌鳞状细胞癌近些年来的患病率在全球范围内呈上升趋势且年龄呈年轻化趋势,其患病率不仅与年龄、性别和种族有关系,还与个人口腔卫生、吸烟、酗酒等生活习惯息息相关。目前,舌鳞状细胞癌临床治疗采用的仍是以手术治疗为主,放化疗为辅的治疗方法。尽管近几十年来治疗水平有所提高,但是患者5年存活率却没有大幅度提升[5]。舌是人体行使语言、进食等生理功能必不可缺少的器官,舌鳞状细胞癌严重影响着患者的生理和心理健康,改进治疗手段、尽可能地保留舌体健康结构、提高生存率是目前面临最大的技术挑战。
微小RNA(microRNA,miRNA)是一种广泛存在于真核生物的长度为22 nt左右的小分子非编码RNA,它们能特异性识别下游靶基因mRNA的3’端非翻译区(3’-untranslated region,3’UTR),并通过与之结合促进mRNA发生降解进而抑制靶基因的翻译过程[6]。大量的研究[7-8]表明,miRNA与肿瘤密切相关,可作为肿瘤抑癌或致癌因子参与肿瘤细胞生长、增殖、分化和凋亡等生物功能。据报道[9],有多种miRNA参与了口腔鳞状细胞癌的发生进程,其中miR-146a、miR-155、miR-21等发挥促癌作用,而miR-218、miR-29a等则具有抑癌作用。此外,miR-204-5p被证实对癌细胞具有抑制作用,在多种癌症均下调表达[10-11],然后关于其在舌鳞状细胞癌中的作用机制却鲜有报道。因此,本研究将通过实验探讨miR-204-5p在舌鳞状细胞癌中的表达模式和可能的作用机制,为舌鳞状细胞癌发病机制以及治疗研究提供一定的理论依据。
1 材料和方法
1.1 实验材料
舌鳞状细胞癌组织和癌旁组织标本来自2016年10月至2018年5月在河北医科大学第四医院行根治性手术切除的42例舌鳞状细胞癌患者,人口腔上皮HOEC细胞系和舌鳞状细胞癌细胞SCC9、SCC25购于北京北纳创联生物技术研究院。
溴结构域蛋白4(bromodomain-containing protein 4,BRD4)、甘油醛3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)小鼠一抗(Sigma公司,美国),HRP兔抗鼠二抗(Abcam公司,英国),DMEM/F12培养基和胰蛋白酶(Gibco公司,美国),实时荧光定量PCR(real-time quantitative polymerase chain reaction,RT-qPCR)分子试剂(大连宝生物工程有限公司),Lipofectamine®2000(Invitrogen公司,美国),细胞计数试剂盒(cell counting kit,CCK)8和二喹啉甲酸(bicinchoninic acid,BCA)试剂盒(上海碧云天生物技术有限公司),Transwell小室(Corning公司,美国)。
miR-204-5p模拟物和pcDNA-BRD4质粒由上海吉玛制药技术有限公司合成,引物由北京华大基因研究中心合成,主要仪器为Applied Biosystems ABI 7500 qPCR仪(ABI公司,美国)和SpectraMax i3x多功能酶标仪(上海美谷分子仪器有限公司)。
1.2 细胞培养
本研究中RT-qPCR分析采用正常口腔上皮细胞HOEC细胞系、舌鳞状细胞癌SCC9细胞系和SCC25细胞系为研究对象。细胞增殖、迁移、侵袭及双荧光素酶报告实验采用SCC25细胞为实验细胞。培养基选择DMEM/F12于37 ℃、5% CO2条件下进行贴壁培养,待细胞生长至65%~75%融合度时,使用0.25%胰蛋白酶消化后传代。
1.3 细胞转染与分组
取对数生长期的SCC25细胞,使用胰酶消化处理后,参照Lipofectamine®2000说明书,将miR-204-5p阳性对照质粒、miR-204-5p模拟物、miR-204-5p阴性对照质粒、miR-204-5p抑制表达载体质粒转染至SCC25细胞中,分别记为miR-NC组、miR-204-5p组、anti-miR-NC组、anti-miR-204-5p组;将miR-204-5p模拟物分别与BRD4对照质粒、BRD4过表达质粒转染至SCC25细胞中,分别记为miR-204-5p+pcDNA组、miR-204-5p+BRD4组。
1.4 RT-qPCR分析miR-204-5p和BRD4 mRNA表达 水平
所用器皿使用0.1%焦碳酸二乙酯(diethy pyrocarbonate,DEPC)水灭菌处理,收集癌组织、癌旁组织和培养48 h的正常口腔上皮细胞HOEC、舌鳞状细胞癌SCC9、SCC25、miR-NC组、miR-204-5p组细胞,分别加入相应体积的RNAiso的氯仿,室温静置后离心收集上清液,异丙醇沉淀,去除上清液,加入DEPC水溶液后检测质量备用,具体细节参考说明书。cDNA合成使用一步法cDNA合成试剂盒,操作参考说明书。定量PCR反应体系为20 µL,包含STBR Taq 10 µL、50×ROX 0.4 µL、上下游引物(浓度单位为µmol·L-1)各0.4 µL、cDNA 2 µL、双蒸水补足至20 µL。反应程序为:95 ℃ 30 s,95 ℃ 3 s,60 ℃ 30 s,40个循环。BRD4上游引物为5’-GCACAAT- C AAGTCTAAACTGGAG-3’,下游引物为5’-TCAT- GGTCAGGAGGGTTGTAC-3’;GAPDH上游引物为5’-GGCTGAGAACGGGAAGCTTGTCAT-3’,下游引物为5’-CAGCCTTCTCCATGGTGGTGAAGA-3’。以GAPDH为内参,2-ΔΔCt法计算BRD4相对表达水平。
1.5 CCK8实验检测细胞增殖能力
取对数生长期的miR-NC组、miR-204-5p组、miR-204-5p+pcDNA组、miR-204-5p+BRD4组细胞,去上清培养液后加入胰酶消化处理并计数,按照每孔6×104个密度吸取100 µL接种于96孔板中,37 ℃培养箱中培养48 h,加入10 µL CCK8溶液至反应孔中,37 ℃孵育2 h后使用酶标仪检测OD490处的吸光度值,根据吸光度值绘制细胞增殖曲线。
1.6 Transwell实验检测细胞迁移和侵袭能力
前期将基质胶于4 ℃条件下低温融化,与无血清培养基按照1∶9的比例混匀,取50 µL注入Transwell小室,在37 ℃培养箱中凝固备用。分别在miR-NC组、miR-204-5p组、miR-204-5p+pcDNA组、miR-204-5p+BRD4组细胞中,取200 µL SCC25细胞悬液至上室中至终密度为每孔6×104个,下室中添加600 µL含有20%血清的培养基,之后将小室置于37 ℃条件下孵育24 h。结束后,使用预冷磷酸缓冲盐(phosphate buffer saline,PBS)溶液洗涤,加入1 mL甲醇溶液固定10 min;弃甲醇溶液,预冷PBS溶液洗涤,加入1 mL结晶紫染色5 min;使用棉签去掉小室内侧滤膜细胞,干燥后制片显微镜下观察计数,即为细胞侵袭数。细胞迁移实验除Transwell小室未经基质胶包被,其余与侵袭实验步骤相同。
1.7 蛋白质印迹法检测BRD4蛋白表达
收集miR-NC组、miR-204-5p组、anti-miR-NC组、anti-miR-204-5p组6孔板中细胞,预冷PBS洗涤2次后离心去除上清液,加入50 µL RIPA裂解液与细胞充分混匀,冰上裂解60 min后离心收集细胞上清液,BCA法对上清蛋白进行定量。配置12%浓度的分离胶,每孔加入50 µg的蛋白样品,80 V电泳30 min后调整电压为120 V至结束。将剪裁好的聚偏氟乙烯(polyvinylidene difluoride,PVDF)膜平铺于转膜仪阳极,蛋白胶放于阴极,两侧平铺滤纸和海绵,恒流转膜30 min。取下PVDF膜于5%封闭液中浸泡 2 h,加入1∶1 000稀释浓度的BRD4一抗溶液,4 ℃震荡孵育过夜,1×TBST洗膜3次,每次5 min;加入1∶2 000稀释比的二抗溶液,室温震荡孵育2 h,1×TBST洗膜3次,每次5 min。化学发光法进行显色,并对条带进行灰度分析。
1.8 双荧光素酶报告实验
TargetScan软件在线分析发现BRD4和miR-204-5p存在结合位点,构建包含miR-204-5p结合位点的BRD4 3’UTR野生型和突变型序列片段,并构建至荧光素酶表达载体中,获得BRD4野生型载体(BRD4-WT)和BRD4突变型载体(BRD4-MUT),将BRD4-WT、BRD4-MUT分别与miR-NC组、miR-204-5p组质粒共转染至SCC25细胞中,转染48 h后用试剂盒检测荧光素酶的相对活性。
1.9 统计学分析
本研究所有数据使用SPSS 22.0分析处理,数据结果使用平均数±方差的形式来表示,两组数据间比较使用t检验,多组间数据比较使用单因素方差分析,组间多重比较使用SNK-q检验,当P<0.05时认为差异具有统计学意义。
2 结果
2.1 舌鳞状细胞癌组织、癌旁组织、舌鳞状细胞系及HOEC细胞系中miR-204-5p和BRD4 mRNA的表达水平
与癌旁组织(0.998±0.205)相比,舌鳞状细胞癌组织中的miR-204-5p(0.545±0.208)显著下调表达(t=6.205,P=0.000),BRD4 mRNA(2.259±0.468)显著上调表达(t=7.218,P=0.000),见图1A、B。此外,结果显示,与正常口腔上皮细胞HOEC细胞相比,舌鳞状细胞癌细胞SCC9和SCC25细胞的miR-204-5p表达显著下调(F=84.933,P= 0.000),BRD4 mRNA表达显著上调(F=44.370,P=0.000),见图1C、D。并且SCC25细胞中的miR-204-5p和BRD4 mRNA表达水平与HOEC细胞中的差异更显著,所有差异具有统计学意义。
2.2 miR-204-5p对细胞增殖的影响
与miR-NC组(1.00±0.05)相比,miR-204-5p组miR-204-5p的相对表达水平为(3.04±0.31),显著上调表达(t=11.253,P<0.05),细胞增殖活性显著降低,见图2。
2.3 转染miR-204-5p模拟物对细胞迁移侵袭的影响
与miR-NC组(109.56±10.25)相比,miR-204-5p组细胞迁移数(87.42±8.44)显著降低(t=4.640,P=0.010);与miR-NC组(75.68±7.41)相比,miR-204-5p组细胞侵袭数(51.47±5.99)显著降低(t= 6.016,P=0.004),见图3。
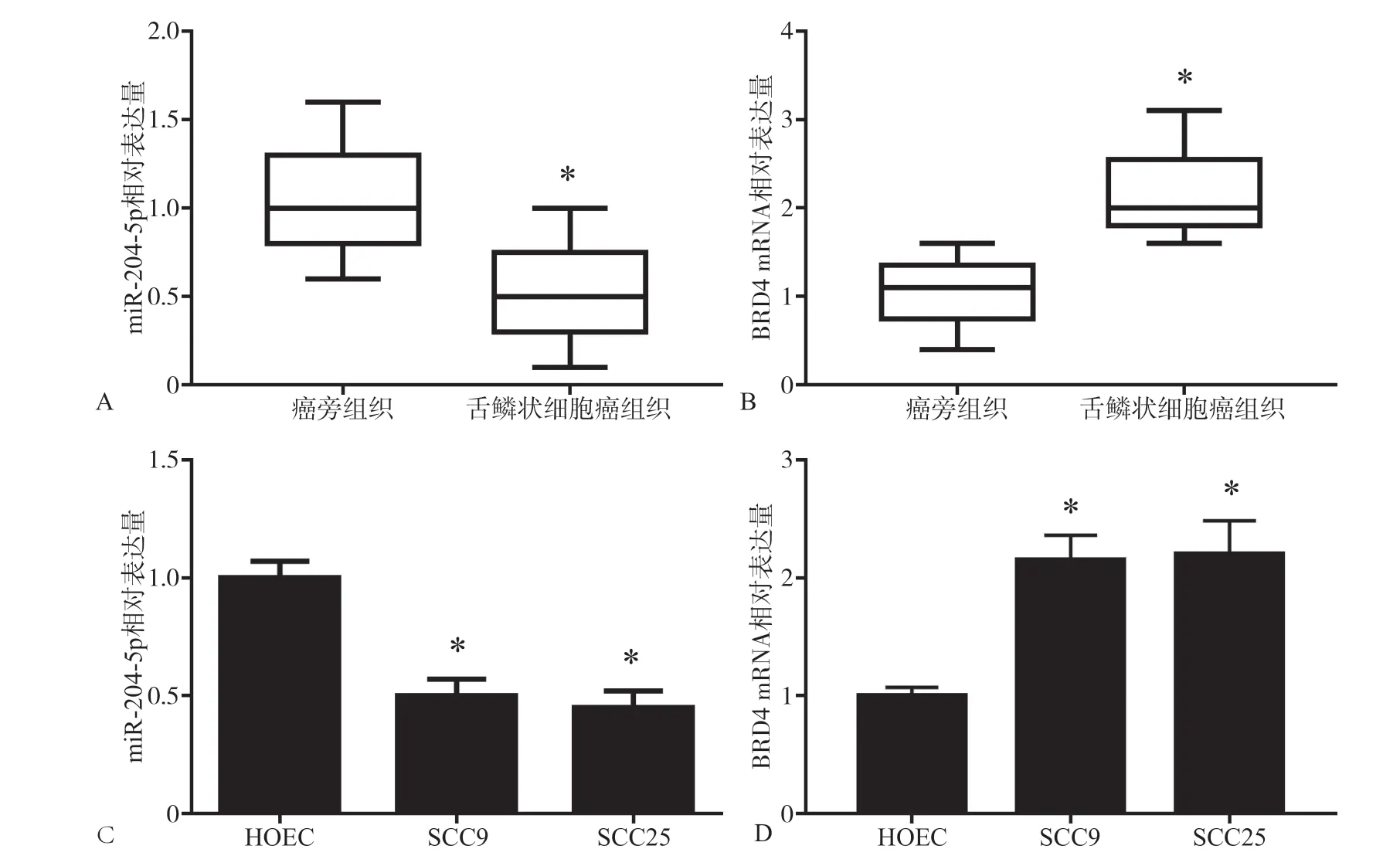
图 1 RT-qPCR检测miR-204-5p和BRD4表达水平的变化Fig 1 The expression levels of miR-204-5p and BRD4 were detected by RT-qPCR
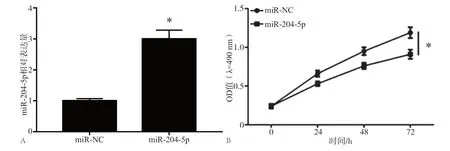
图 2 miR-204-5p过表达后miR-204-5p表达水平和细胞增殖活性Fig 2 miR-204-5p expression and cell proliferation activity after miR-204-5p overexpression
2.4 荧光素酶实验检测结果
TargetScan软件在线分析发现BRD4和miR-204-5p存在结合位点,见图4A。与共转染miR-NC和BRD4-WT组(0.85±0.06)相比,共转染miR-204-5p和BRD4-WT组的细胞相对荧光活性(0.39±0.08)显著降低(t=7.967,P=0.001),见图4B。miR-NC、miR-204-5p、anti-miR-NC、anti-miR-204-5p组的BRD4 mRNA相对表达水平(图4C)分别为1.00±0.05、0.34±0.04、0.94±0.07、1.66±0.11;蛋白相对表达水平(图4D、E)分别为1.00±0.09、0.46±0.07、0.91±0.03、1.87±0.16。miR-204-5p模拟物促使BRD4的mRNA和蛋白均显著下调表达,miR-204-5p抑制剂促使BRD4的mRNA和蛋白表达水平显著上调,差异有统计学意义(FmRNA=165.668,PmRNA=0.000;F蛋白=105.539,P蛋白=0.000)。
2.5 BRD4过表达和miR-204-5p对SCC25增殖、迁移 和侵袭的影响
miR-204-5p、miR-204-5p+pcDNA、miR-204-5p+BRD4组发生迁移的SCC25细胞数量分别为70.24±7.18、68.25±6.81、99.36±11.04(F=12.418,P= 0.007);发生侵袭的细胞数量分别为50.17±5.14、48.95±4.92、81.39±8.56(F=24.559,P=0.001)。与miR-204-5p和miR-204-5p+pcDNA组相比,miR-204-5p+BRD4组的SCC25细胞增殖能力显著提升(P< 0.05),见图5。
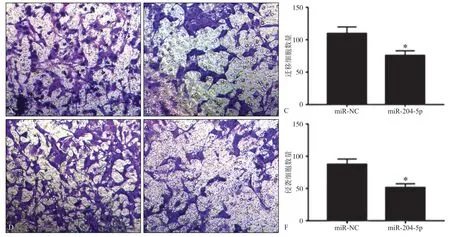
图 3 过表达miR-204-5p后SCC25细胞迁移及侵袭数Fig 3 Number of migration and invasion of SCC25 cells after miR-204-5p overexpression
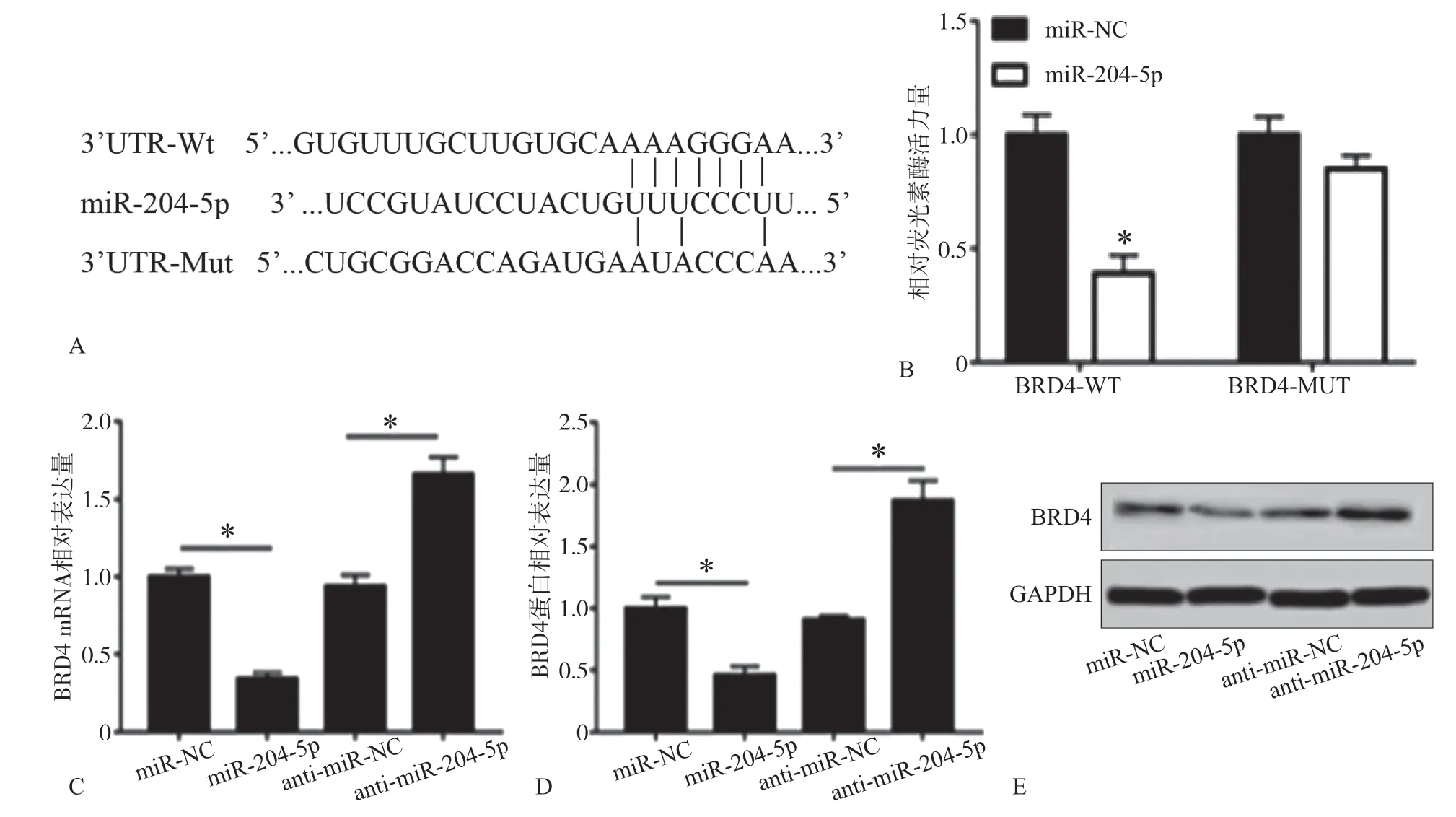
图 4 荧光素酶报告实验Fig 4 Luciferase reporting experiment
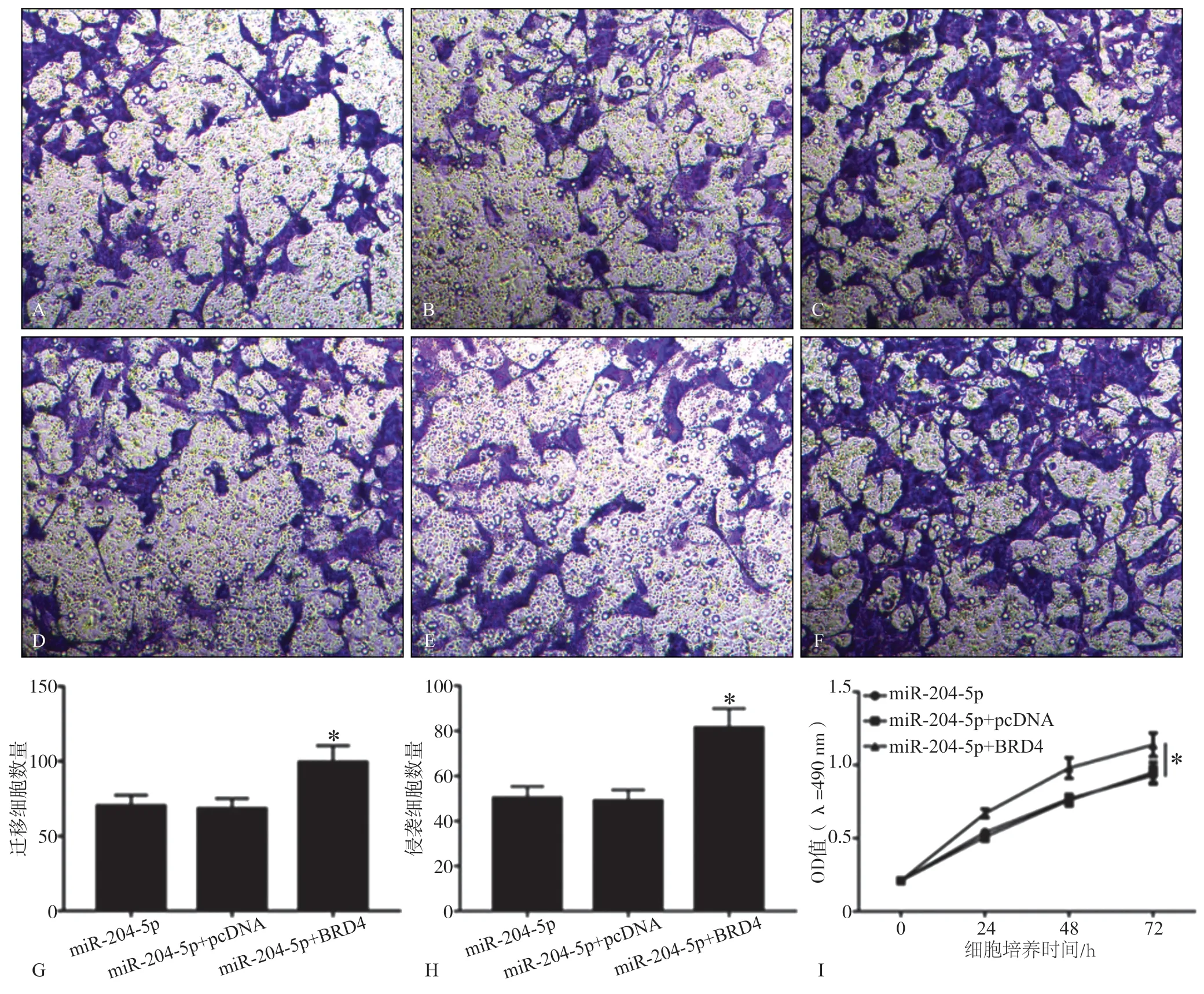
图 5 过表达BRD4后SCC25增殖活性和迁移、侵袭数Fig 5 Proliferation activity, migration and invasion number of SCC25 after overexpression of BRD4
3 讨论
转移是肿瘤的一个基本属性,也是造成患者复发和死亡的最主要原因[12-13]。其中,肿瘤细胞转移的发生伴随着促癌基因和抑癌基因功能的紊乱失调表达,包括能够通过与基因3’UTR结合参与靶基因表达调控的小分子物质miRNA[6-8,14]。本研究通过RTqPCR分析发现,miR-204-5p在舌鳞状细胞癌中显著下调表达,这种趋势与其他结肠癌、肝癌、胃癌等多种癌症中的表现是一致的[15-17]。除此之外,Yin等[18]提出miR-204-5p可通过下调表达RAB22A抑制大肠癌细胞增殖和侵袭能力,并增加其化疗敏感性;Wang等[19]发现miR-204-5p可通过靶向RGFG抑制胃癌细胞的增殖和迁移能力;Liu等[20]指出miR-204-5p可下调IGFBP5抑制甲状腺乳头状癌的增殖能力;Dhalluin等[21]研究发现miR-204-5p通过靶向调控CXCR4的表达进而调控口腔鳞状细胞癌细胞的增殖和转移。为进一步探究miR-204-5p在舌鳞状细胞癌细胞中的功能机制,本研究以SCC25为研究对象,RT-qPCR检测了细胞内miR-204-5p的表达水平,结果显示其在舌鳞状细胞癌细胞中同样显著下调表达。当在SCC25过表达miR-204-5p时,细胞增殖、迁移和侵袭能力显著受到抑制,表明miR-204-5p对SCC25细胞具有显著的抑制作用,由此可见miR-204-5p在舌鳞状细胞癌中同样扮演着重要角色。
BRD4含有在BET家族高度保守的4个左手α螺旋构成的溴结构功能域,是一种哺乳动物广泛存在的核调节因子,可在细胞有丝分裂过程中通过与染色体结合来募集相关的染色体修饰蛋白调控基因的表达,进而参与细胞周期进程的调控、炎症代谢等生物活动[22-23]。近些年的研究[24]表明,BRD4表达紊乱失调与多种疾病的发生相关,尤其是与肿瘤的发生更是密切相关。有报道指出,BRD4可通过对c-MYC转录和表观遗传的调控促进胃癌的发展进程[25],靶向抑制表观遗传信号分子BRD4可以有效地抑制癌症恶病质并且延长生存期[26];同时,体外实验[27]中,加入BRD4抑制剂对结肠癌的生长和转移具有显著的抑制作用。另外,BRD4在皮肤鳞状细胞癌中表达上调,能够促进皮肤鳞状细胞癌细胞生长增殖[28];当降低BRD4表达量时,口腔癌细胞生长和转移受到抑制[29]。本研究通过RT-qPCR检测发现BRD4在舌鳞状细胞癌中同样上调表达,并且使用TargetScan软件分析发现BRD4的3’UTR与miR-204-5p种子序列互补,是miR-204-5p的潜在靶标。为探究BRD4和miR-204-5p在舌鳞状细胞癌中的作用关系及其机制,使用荧光素酶实验验证了两者的靶向关系。当在SCC25细胞中过表达miR-204-5p时,BRD4表达显著下调;当敲低miR-204-5p表达量时,BRD4表达水平显著上调。此外,与单独转染miR-204-5p模拟物组相比,miR-204-5p模拟物和BRD4表达质粒共转染SCC25后,细胞的增殖、迁移和侵袭能力明显得到提高,说明BRD4基因能够回补miR-204-5p对SCC25的抑制作用。
综上所述,本研究证实了miR-204-5p可通过靶向负调控BRD4抑制舌鳞状细胞癌SCC25细胞增殖、迁移和侵袭,为肿瘤新型疗法提供了途径。然而关于BRD4作为细胞内一种重要的表观遗传分子,参与了多种基因特异性表达的调控过程,然而关于其与miR-204-5p调控机制之外的其他靶向网络以及潜在的脱靶效应尚未完全阐明,有待进一步研究。
利益冲突声明:作者声明本文无利益冲突。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
