小分子锌指蛋白1在4-硝基喹啉-N-氧化物诱导SD大鼠颊黏膜癌变中的表达研究
2020-04-14余丽刘旭倩陈雨荷陈潇聂敏海
余丽 刘旭倩 陈雨荷 陈潇 聂敏海
1.西南医科大学口颌面修复重建与再生实验室,泸州 646000;
2.西南医科大学附属口腔医院牙周黏膜科,泸州 646000;
3.北海道大学齿学院口腔病态学分野口腔诊断内科学教室,日本北海道 060-0808;
4.绵阳市口腔医院正畸科,绵阳 621000
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔颌面部常见的高侵袭性肿瘤[1],也是人类的第6大恶性肿瘤,严重威胁着患者的生命健康和生存质量。OSCC约占头颈部肿瘤的95%[2],占全身肿瘤的2%~4%以上[3];OSCC患者的5年生存率仅为50%[4-5]。小分子锌指蛋白(LIM domain only proteins,LMO)[6]是核转录家族的共同调节子,在胚胎发育过程中调控细胞的增殖分化、组织形成和器官发育,LMO通过介导蛋白质之间及蛋白质与各种转录因子间的相互作用,促进或抑制基因转录;LMO可通过调控细胞周期促进肿瘤形成。LMO家族有4个成员[7],LMO1、LMO2、LMO3、LMO4。LMO1主要由2个呈直线排列富含半胱氨酸的LIM结构域组成,可作为蛋白质相互作用的适配器,结合其他蛋白质形成复合体,破坏其原有结构,通过调控基因转录活性、细胞增殖分化促进肿瘤的侵袭转移[8-9]。李晓燕[10]在LMO1上调食管鳞癌的上皮间充质转化(epithelial mesenchymal transformation,EMT)的研究中发现,138例食管鳞状细胞癌组织和癌旁组织中LMO1的阳性表达率分别为86.9%和50.7%,LMO1在食管鳞状细胞癌中的表达明显高于癌旁组织(P< 0.001)。OSCC与食管鳞状细胞癌同属于上皮源性肿瘤,LMO1是否会促进口腔黏膜癌变,目前尚无相关研究,蛋白标志物作为肿瘤早期筛查的重要指标,筛选高灵敏度的标志物对肿瘤的研究和治疗具有重要意义。因此,本实验拟对4-硝基喹啉-N-氧化物(4-nitroquinoline N-oxide,4NQO)饮水法构建的SD大鼠口腔颊黏膜组织的mRNA和蛋白进行检测,以探究LMO1在OSCC发展进程中的作用。
1 材料和方法
1.1 主要材料和试剂
PageRulerPrestained Protein Ladder、Veriti 96- Well聚合酶链式反应(polymerase chain reaction,PCR)仪、高速冷冻离心机、iBright CL1000蛋白印迹智能成像系统(Thermofisher公司,美国),LMO1单克隆抗体(湖北省三鹰生物技术有限公司),磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)单克隆抗体(北京Abway抗体技术有限公司),LMO1引物、GAPDH引物(上海生工生物工程股份有限公司),SYBR®Greenrealtime PCR master mix(TOYOBO公司,日本),DAB试剂盒、PV9000型免疫组化染色试剂盒(北京中杉金桥生物技术有限公司),石蜡包埋机(湖北省亚光医用电子技术有限公司)。
1.2 实验样本
本实验动物组织均源于本课题组前期4NQO饮水法鳞状细胞癌动物模型构建(已获得西南医科大学伦理委员会的同意和认可),建模方法如下。选取SPF级6周龄雄性SD大鼠84只,按照随机数字表法将SD大鼠均分装到21个饲养笼中,每3笼为一个小组,共7组。采用自动缓控系统控制灯光,设计昼夜光线明暗度循环,饲养温度为20~25 ℃,空气湿度为40%~60%,保证大鼠有充足的饲料(SPF动物专用饲料由西南医科大学实验动物中心提供)和饮水,少量多次饲养大鼠,保证食物供给充足的同时而不至于喂养过度。7组大鼠中,设置1组大鼠为对照组,6组为实验组,实验组饮用含质量分数为0.004% 4NQO的SPF级纯净无菌水;对照组饮用SPF级纯净无菌水,其余饲养条件相同。
在饲养的12、14、16、18、20、22周,随机取1组实验组大鼠乙醚麻醉后,观察记录各处病变组织的肉眼观,颈椎脱臼处死大鼠,立即将组织冻存在-80 ℃冰箱,用于后续的实时荧光定量PCR(real-time fluorescent quantitative of nucleotide PCR,RT-qPCR)和Western blot实验,在实验的第12、14、16、18、20、22周,采用同样的方法,每次处死对照组大鼠2只,并获取各病变区域的颊黏膜组织,-80 ℃冰箱冻存。
本实验随机选取上述7组SD大鼠的颊黏膜组织各7例共计49例用于本实验研究。
1.3 苏木精-伊红(hematoxylin-eosin,HE)染色
随机选取49例课题组前期建模所得组织切片按说明书进行染色,封片,然后分别由2位高年资病理科医师读片确定病理分级,参考2005年WHO分类标准,分为对照组和实验组,实验组包括轻度上皮异常增生组(轻度组)、中度上皮异常增生组(中度组)、重度上皮异常增生组(重度组)和OSCC组。
1.4 免疫组织化学染色实验
将实验用一抗兔抗鼠LMO1多克隆抗体稀释为 1∶100、1∶150、1∶200、1∶300、1∶400、1∶500、1∶700共7个浓度梯度进行试验性染色,结果示1∶400稀释度下染色鉴别力最佳,因此,本实验采用1∶400的稀释度按照SP法进行LMO1染色。采用标记指数半定量分析结果:标记指数=阳性染色强度计分+阳性细胞染色率计分。阳性染色强度计分标准:在光学显微镜下,排除边缘效应和非特异性染色,其中细胞质和细胞核出现棕褐色、棕黄色、黄色记为阳性,无:0分;黄色:1分;棕黄色:2分;棕褐色:3分。阳性细胞率:高倍镜(× 400)下随机选取5个视野,利用医学图像分析软件(Image Pro plus)计算着色细胞所占百分比,0分:阳性细胞率<10%;1分:11%~25%;2分:26%~49%;3分:≥50%。标记指数即为两者相加总分:0~1分为阴性(-),2分为弱阳性(+),3~4分为中阳性(++);5~6分为强阳性(+++);其中≥2分均为阳性表达。
1.5 RT-qPCR实验
依试剂盒说明提取各样本的总RNA,逆转录为cDNA,LMO1引物序列:F:5’-CTTTCGAGATGGTGATGCG-3’;R:5’-ATCTCTGATTGCAGAGTTGG-3’。GAPDH的引物序列:F:5’-ACAGCAACAGGGTGGTGGAC3’;R:5’-TTTGAGGGTGCAGCGAACTT-3’。每组4个复孔,20 μL体系进行扩增,记录LMO1和GAPDH的CT值,采用ΔΔCT相对定量法进行计算分析:ΔCT=CT(LMO1基因)-CT(GAPDH基因);ΔΔCT=ΔCT实验组-ΔCT对照组;平均相对含量=2-平均ΔΔCT,即实验组mRNA相比对照组mRNA的变化倍数。
1.6 Western blot实验
按蛋白试剂盒说明提取各样本的蛋白质,测蛋白浓度;以每孔50 mg蛋白作为上样标准,配胶,上样,电泳,转膜,脱脂奶粉封闭,一抗、二抗孵育,显影,分析数据。
2 结果
2.1 HE染色结果及病理分级的确定
49例SD大鼠口腔颊黏膜组织通过HE染色,依据组织异常增生的严重程度,经2位高年资病理科医师读片确定:对照组7例,轻度组6例,中度组11例,重度组9例,OSCC组16例。
对照组上皮细胞结构完整,排列规则,层次清晰;轻度组的病变组织主要累及上皮层的l/3,上皮轻度增生,过角化,棘细胞层增厚;中度组的病变组织主要累及上皮层的l/3~2/3,上皮增厚较明显,基底细胞层数增加,上皮钉突伸长、变宽,部分钉突呈水滴状,细胞核浓染;重度组的病变组织超过上皮层的2/3,但尚未突破基底膜,上皮显著增生变厚,细胞核异型性、浓染,上皮钉突呈水滴状且相互融合;OSCC组主要表现为上皮层次紊乱,棘细胞层成团角化,上皮钉突增大呈滴状,基底细胞极性消失,核仁增大,核分裂象,细胞异形性明显,细胞可以突破基底膜到达固有层,固有层出现癌巢(图1)。
2.2 免疫组织化学染色实验定性确定LMO1的表达
免疫组织化学染色将LMO1表达的部位染为黄色或棕褐色,LMO1主要表达于细胞质,少量表达于细胞核和细胞膜。LMO1在正常口腔颊黏膜组织中几乎不表达,因此对照组上皮层无着色。随着口腔颊黏膜上皮异常增生程度的增加,上皮细胞细胞质逐渐被染色,且随着上皮异常增生程度的增加,上皮细胞的胞质染色越来越深,说明LMO1的表达量是逐渐增加的。此外,中度组中个别上皮细胞的细胞核核膜染为淡黄色;重度组中细胞质和细胞核核膜被染成棕褐色,细胞核染成淡黄色。而在OSCC组中,上皮细胞的细胞质、细胞核和细胞核核膜均出现棕褐色的强阳性染色反应,特别在肿瘤细胞浸润区染色更深(表1,图2)。
2.3 大鼠颊黏膜中LMO1 mRNA的表达情况
随着异常增生程度的加重,LMO1 mRNA的表达逐渐增加,在OSCC组中LMO1 mRNA相对表达量最高,采用One-Way ANOVA的统计方法分析发现,对照组与轻度组间差异无统计学意义(P>0.05),其余各组组间两两比较,差异具有统计学意义(P< 0.05)。与对照组相比,轻度组的mRNA相对表达量上调1.12倍,中度组上调1.38倍,重度组上调1.53倍,OSCC组上调1.76倍(图3)。
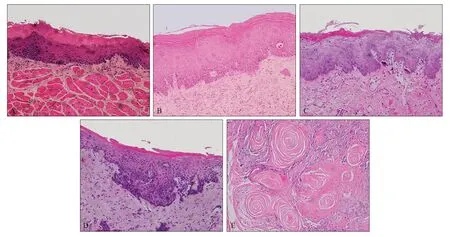
图 1 SD大鼠口腔颊黏膜HE染色结果 HE × 200Fig 1 HE staining of the oral buccal mucosa of SD rats HE × 200
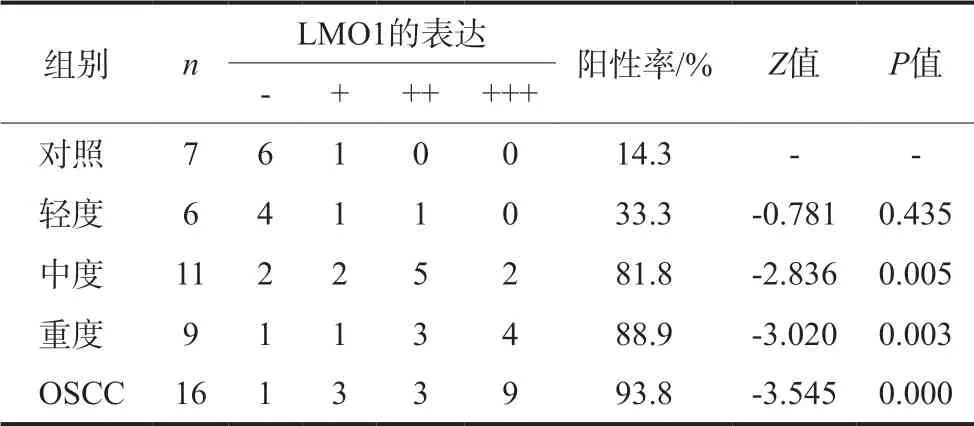
表 1 各组LMO1蛋白的阳性表达率Tab 1 The positive expression of LMO1 in the each group
2.4 大鼠颊黏膜中LMO1蛋白的表达情况
对照组和实验组中均表达LMO1蛋白,随着上皮异常增生程度的加重,LMO1蛋白的表达量逐渐增加,对照组LMO1表达量最少,OSCC组LMO1蛋白表达量最高。采用One-Way ANOVA的统计方法分析显示:与对照组相比,实验组的LMO1表达量均高于对照组,差异具有统计学意义(P<0.05)。与轻度组相比,中度组、重度组和OSCC组表达均高于轻度组,差异有统计学意义(P<0.05)。而在中度组、重度组和OSCC组之间LMO1表达无明显差异(P>0.05)(图4)。
3 讨论
口腔黏膜癌变过程中常出现组织细胞的侵袭转移,细胞异形性,上皮细胞可突破基底膜到达固有层并形成癌巢,随着病程的发展,癌细胞可能向周围组织发生早期转移[11-13]。本实验研究口腔颊黏膜从正常发展为OSCC这一过程中LMO1的表达变化,结果显示随着口腔黏膜异常增生程度的增加,LMO1的表达逐渐增加,提示LMO1的表达增加可能促进了肿瘤细胞的侵袭和转移,使肿瘤的发展进程加快。同样,有研究[14]表明,LMO1可能参与了EMT的调控,LMO1可与碱基序列结合蛋白GATA3结合,通过下调上皮标志物E-钙黏蛋白、角蛋白等的表达,诱导EMT的发生,使上皮细胞失去分化特征,细胞极性消失,而波形蛋白等间充质标记物的表达增加;同样在许多原发肿瘤局部浸润的早期,可以检测到EMT相关基因的表达,LMO1作为蛋白质相互作用的适配器,可能与EMT通道中的特定蛋白质形成复合体,调控相应癌变基因的转录过程,诱导细胞的异常增生和异常分化,破坏病变部位的组织结构,加快口腔黏膜癌变的进程,从而在肿瘤的发生和转移中发挥作用。增殖、分化和凋亡是细胞的基本生命活动,在机体内环境的稳定中发挥着重要作用,细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,包括分裂间期与分裂期,所有的生命活动过程都伴随着细胞的更新与凋亡,而在口腔黏膜癌变过程中,细胞凋亡发挥着重要的作用,凋亡细胞的增加可以抑制肿瘤细胞的生长,而凋亡细胞的减少则可以促进肿瘤的生长,因此,LMO1可能通过调控病变部位细胞的细胞周期活动促进口腔黏膜癌变,诱导OSCC的发生。
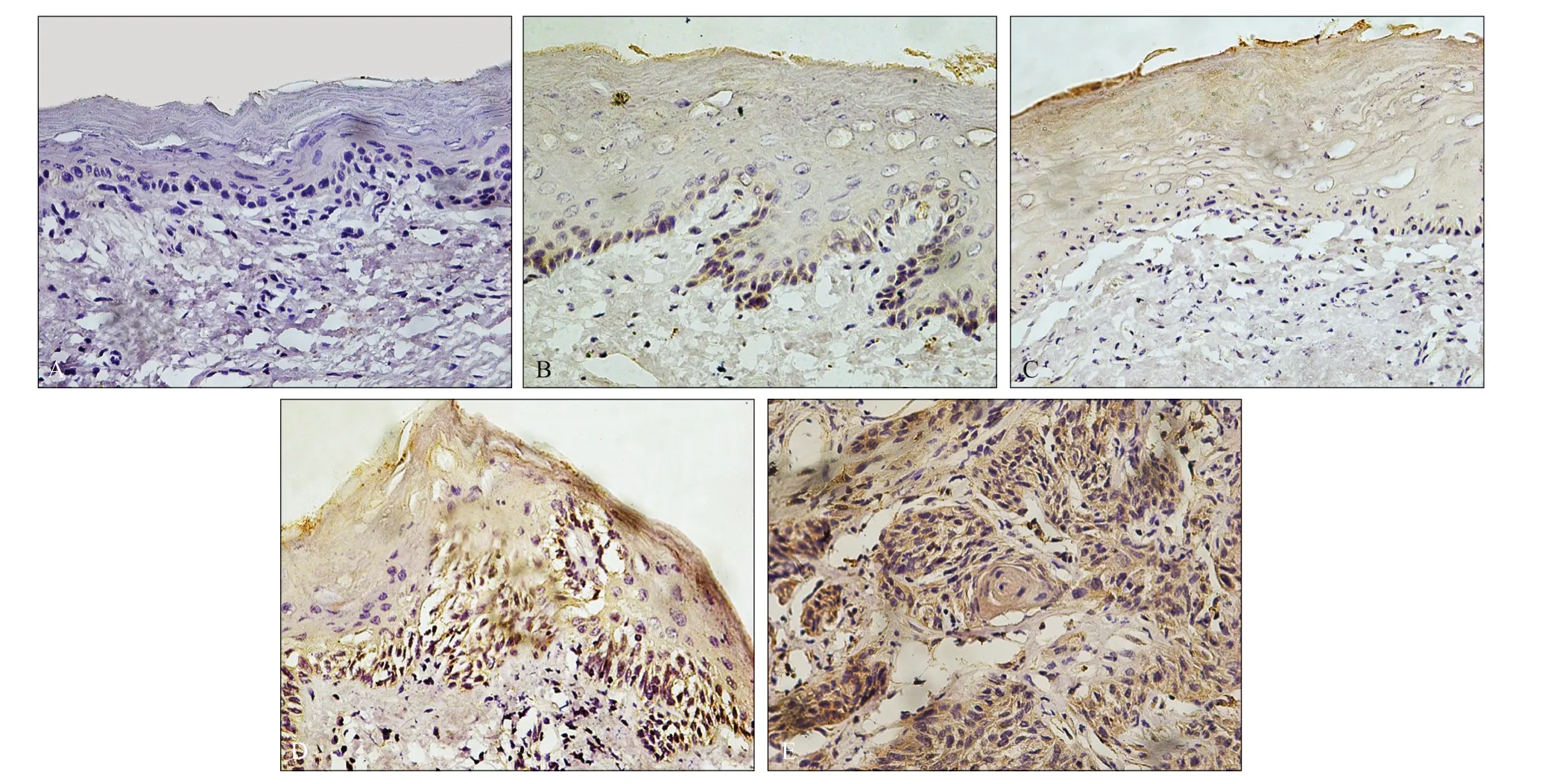
图 2 SD大鼠口腔颊黏膜免疫组织化学染色 SP × 400Fig 2 Immunohistochemical staining of the oral buccal mucosa of SD rats SP × 400
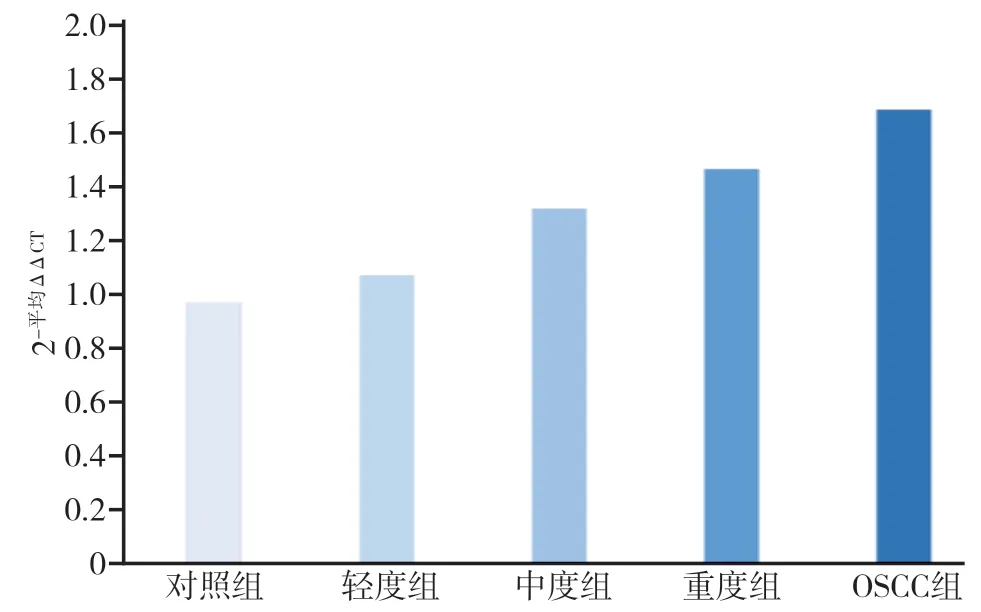
图 3 SD大鼠颊黏膜LMO1 mRNA的相对表达量Fig 3 LMO1 mRNA expression level of buccal mucosa of SD rats
RT-qPCR结果表明,与对照组相比,轻度组、中度组、重度组和OSCC组的mRNA相对表达量分别上调了1.12倍、1.38倍、1.53倍和1.76倍;Western blot实验中,从对照组到OSCC组,LMO1蛋白的表达量逐渐增加,而在对实验数据进行两两分析时发现轻度组与对照组间mRNA表达差异无统计学意义(P>0.05),其余各组组间两两比较,差异有统计学意义(P<0.05)。同样,Western blot检测结果表明,组间两两比较发现,中度组、重度组和OSCC组间LMO1表达差异无统计学意义(P>0.05),其余各组两两比较差异有统计学意义(P<0.05)。原因可能是组织从正常发展到OSCC需要先经历异常增生阶段,此过程中机体会出现免疫防御反应,不同大鼠免疫反应强度的不同也有可能导致某些阶段LMO1蛋白表达相对减少;同时,4NQO饮水法诱导组织癌变是一连续的过程,各阶段之间过渡的时间较短,病程进展较快,导致在取材时机上把握不够准确;大鼠之间的个体差异,大鼠间饮水量的差异均有可能对实验结果造成一定的影响。各实验结果提示,从正常组织诱导为OSCC这一过程中,LMO1在上皮组织中的表达量是有变化的,且变化是有规律的。
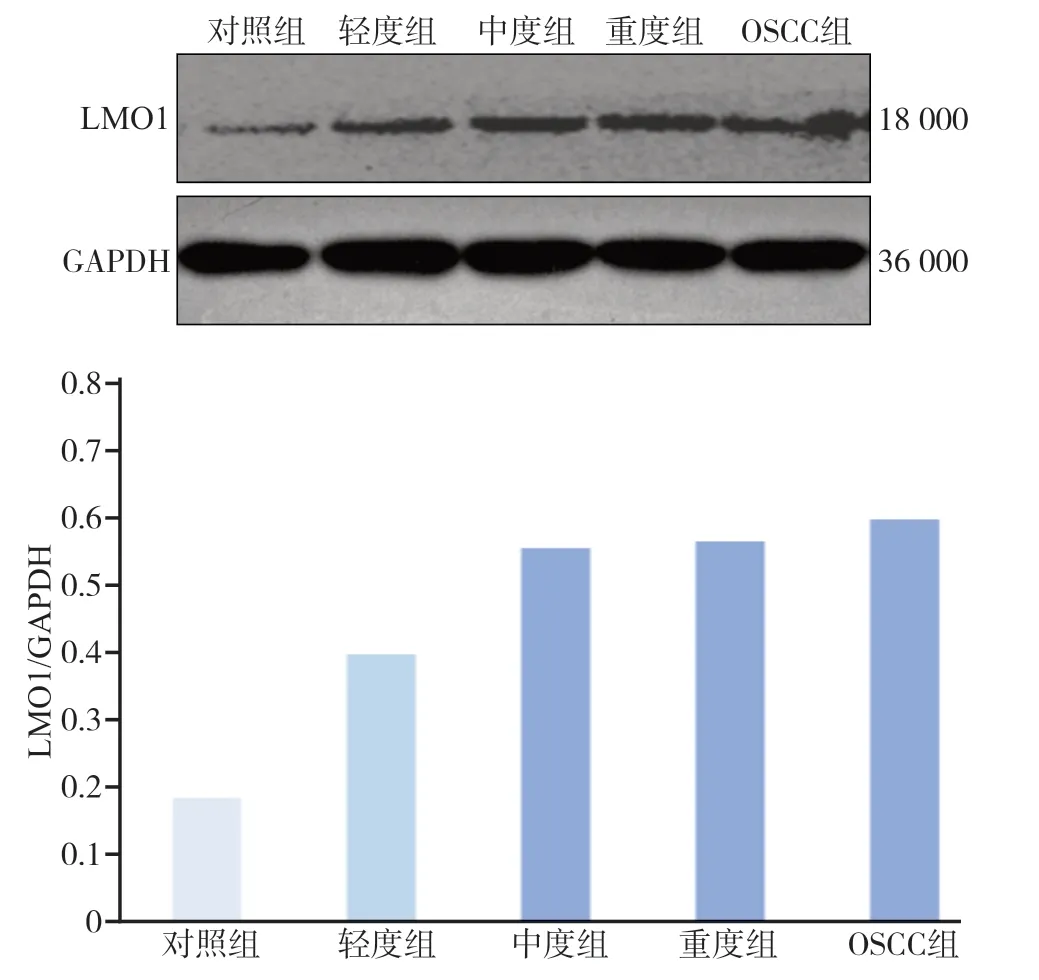
图 4 Western blot检测各组LMO1蛋白的表达Fig 4 Western blot analysis of LMO1 protein expression in the each group
蛋白标志物作为肿瘤早期筛查的重要指标,积极寻找合适的蛋白标志物对OSCC的早期诊断和判断预后具有重要的指导意义。本实验在保证了病变模型连续性的同时保证了实验的样本量,结果具有可靠性和指导意义。理论上,为探索口腔黏膜癌变的分子机制提供了新思路,丰富了OSCC蛋白标志物的实验研究,为阻断OSCC侵袭转移的途径提供了新的理论依据,成果具有应用前景。但是LMO1的表达变化在OSCC发展进程中的具体作用机制,是否调控EMT进程还尚不明确,这将是后续进一步研究的方向。
综上所述,在口腔黏膜癌变模型中,LMO1 mRNA和蛋白异常表达,且mRNA和蛋白表达量与上皮异常增生程度正相关,均随着异常增生程度的增加而表达增加。
利益冲突声明:作者声明本文无利益冲突。
