TRIM38基因非CpG岛DNA甲基化与胶质母细胞瘤临床预后的关系
2020-04-14殷安安贺亚龙刘玉河
殷安安 陆 南 贺亚龙 章 翔 刘玉河
胶质母细胞瘤(glioblastoma multiforme,GBM)是临床上最常见且恶性程度最高的中枢神经系统肿瘤,约占所有脑胶质瘤的50%[1]。基于替莫唑胺的标准治疗方案对GBM治疗效果存在巨大差异,原因主要是肿瘤内部分子特征的异质性。GBM的发生、发展伴随着显著的DNA 甲基化改变,其中以启动子CpG岛超甲基化介导的抑癌基因表达沉默的研究最多[2,3]。然而,人类基因组中大约有40%的基因的转录调控区域并不包含CpG序列局部富集的CpG岛结构,只有散在分布的CpG 位点。这些基因的非CpG岛DNA甲基化改变在肿瘤中作用尚不清楚,特别是GBM[4]。本研究基于课题组前期研究结果[2],选取免疫基因TRIM38及其相关非CpG岛DNA甲基化位点作为研究对象,利用公共数据库信息,探讨基因非CpG岛DNA甲基化与GBM临床预后的关系。
1 资料与方法
1.1 GBM 及非肿瘤脑组织(non-tumor brain,NTB)对照组 本研究纳入GBM 样本主要来自于:美国癌症基因组图谱计划(TCGA;https://tcga-data.nci.nih.gov/tcga/)[5][共354例,其中男212例,女141例;中位年龄61 岁;O6-甲基鸟嘌呤-DNA 甲基转移酶(O6-meth⁃ylguanine DNA methyltransferase,MGMT)启动子甲基化161例,未甲基化174例];美国国立图书馆基因表达数据库(GEO;http://www.ncbi.nlm.nih.gov/geo/)中GSE22891 系列[6](共50 例,其中男25 例,女24 例;中位年龄58 岁;MGMT 启动子甲基化29 例,未甲基化21 例);中国胶质瘤基因组图谱计划(CGGA;http://www.cgga.org.cn/)[7](共105例,其中男62例,女43例;中位年龄46岁;MGMT启动子甲基化状态未知)。纳入对照组样本来自 GSE63347 系列(25 例)[8]、GSE22891系列(4例)及CGGA(8例)数据库。
1.2 TRIM38 基因非CpG 岛DNA 甲基化及基因表达数据 基于前期研究[2],选取距离TRIM38转录调控区1 500 bp 范围内的独立CpG 位点(探针cg22502502)为主要研究对象,CpG 甲基化数据来自Illumina 公司全基因组DNA 甲基化芯片,其水平由探针β值决定。部分纳入样本亦具有全基因组表达谱数据,均经过芯片数据标准化处理,具体步骤详见各参考文献[5~7]。
1.3 统计学及生物信息学分析 应用GraphPad Prism及R 软件进行数据分析;连续变量采用Mann-Whit⁃ney 检验或t检验;关联性分析采用Spearman 检验;生存分析采用生存曲线、log-rank 检验及多因素Cox风险回归模型;分组界值由R 软件maxstat 包计算;生物信息学分析由基因簇富集分析(GSEA)比较;P<0.05为差异具有统计学意义。
2 结果
2.1 TRIM38 基因非CpG 岛DNA 甲基化及基因表达在GBM 中的改变模式 对比TRIM38 基因非CpG 岛DNA 甲基化探针(cg22502502)在GBM 与对照样本的数据,该探针在GBM 中β值显著下降(P<0.05;图1a),提示该位点在GBM中呈低甲基化改变。同时,比较GBM 与对照样本中TRIM38 基因的表达水平,其基因mRNA表达值显著上升(P<0.05;图1b),提示该基因在肿瘤中呈现高表达状态。
2.2 TRIM38 基因非CpG 岛DNA 甲基化与基因表达的关系 TRIM38 基因在GBM 中呈现的低甲基化状态和高表达状况,提示该基因可能存在非CpG 岛DNA甲基化依赖的基因表达调控机制。为进一步验证上述可能,利用Spearman 检验分析甲基化与表达谱数据之间的关系,发现在不同数据库中,TRIM38基因非CpG 岛DNA 甲基化数据均与其基因表达数据呈显著负向相关性(Spearman系数均小于-0.3,图1c),进一步提示非CpG 岛DNA 甲基化可能参与TRIM38的表达调控。
2.3 TRIM38 基因非CpG 岛DNA 甲基化与病人生存时间(overall survival,OS)的关系 为了减少单因素分析中其他因素对GBM 病人OS 数据的干扰,选取TCGA及GSE22891数据库中接受替莫唑胺联合放化疗的原发GBM进行生存分析,并利用maxstat计算最佳分组界值,将TCGA及GSE22891数据库的GBM样本分为两组:TRIM38高甲基化组和低甲基化组。生存分析表明:两组病例库中,拥有高甲基化组OS 显著优于低甲基化组(P<0.05;图1d)。多因素Cox 回归分析进一步表明TRIM38甲基化水平GBM病人预后的独立影响因素。
2.4 基于TRIM38甲基化分组的生物信息学分析 分别将TCGA 数据库中TRIM38 高甲基化及低甲基化组GBM 样本的全基因组表达谱数据带入GSEA 分析,结果显示低甲基化样本(预后较差组)显著富集免疫功能调控及Toll样受体通路相关基因簇(表1)。
3 讨论
GBM 内部的分子异质性是导致其临床治疗效果欠佳的主要原因之一[5]。表观遗传学,特别是DNA 甲基化,作为重要的分子调控机制广泛参与肿瘤异质性的形成。早在20世纪80年代,就有学者研究DNA 甲基化异常改变在肿瘤疾病中的意义。肿瘤特异的启动子区域CpG 岛超甲基化,通过表观遗传机制沉默抑癌基因的表达,促进肿瘤发生发展[4]。然而,人类基因组中大约一半的基因,其转录调控区域并不包含CpG 序列局部富集的CpG 岛结构,只有散在分布的CpG位点,被称为非CpG岛区域DNA甲基化位点[4]。目前,关于这些区域的DNA 甲基化改变在疾病特别是肿瘤中的作用及意义尚不清楚。我们的前期研究中,通过全基因组多组学数据分析,发现非CpG 岛区域DNA 甲基化改变可能与免疫基因的表达及GBM病人预后广泛相关[2]。
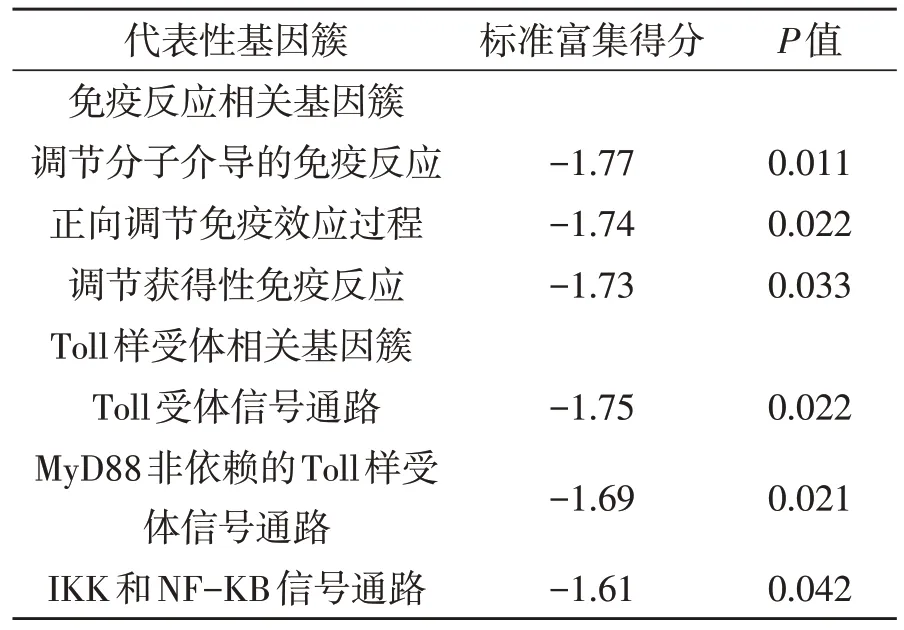
表1 TCGA 数据库中富集于TRIM38 低甲基化样本的代表性基因簇
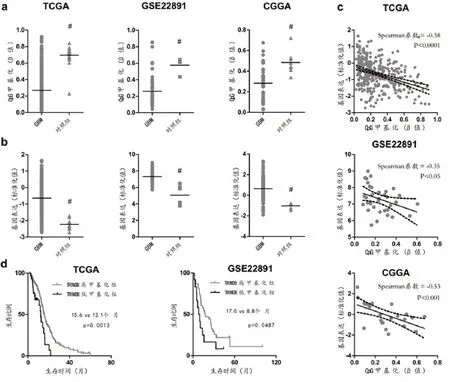
图1 TCGA 的肿瘤甲基化数据与GSE63347 的对照样本进行比较分析TRIM38非CpG岛DNA甲基化在胶质母细胞瘤中的改变模式以及与基因表达、临床预后的关系
TRIM38 来自TRIM 蛋白家族中最大的C-IV 亚组 ,包 括 RING 区 、BBox 区 及 PRY/SPRY 区[9]。TRIM38 能够通过E3 泛素化连接酶、类泛素化酶以及其他作用方式广泛参与固有免疫及炎症反应调控[9]。基于之前全基因组DNA甲基化数据分析结果[2],本文结果显示TRIM38非CpG岛甲基化位点在GBM中发生低甲基化改变,而基因水平发生高表达改变;关联分析证实TRIM38非CpG岛DNA甲基化水平与其基因表达呈强负向相关关系。这提示非CpG 岛DNA 甲基化可能直接参与TRIM38的表达调控。因此,基因非CpG岛甲基化,很可能和启动子CpG岛相似,通过调控功能基因的表达,参与肿瘤的发生、发展过程。本文生存分析结果显示,TRIM38甲基化程度与GBM病人OS显著相关,多因素Cox比例回归风险模型分析进一步证实其为独立预后影响因子。这些述结果提示基因非CpG岛甲基化亦可能是用于预测肿瘤预后或治疗反应的独立生物标记物。为了寻找TRIM38甲基化预后分组背后的生物学背景,我们对GBM 样本的全基因组表达谱数据进行GSEA 分析,结果发现甲基化分组所带来的预后差异很可能与其亚组之间重要功能基因簇表达程度的差异有关,其中具有代表性的基因簇包括免疫功能调节及Toll 样受体通路相关的基因簇。Toll 样受体通路是机体重要的免疫调控通路,能够通过识别外源性或内源性相关分子模式激活下游效应因子,参与机体炎症反应和固有免疫反应[10]。对于肿瘤,特别是GBM,Toll 样受体通路被认为是联系肿瘤细胞增殖侵袭和免疫抑制活动的重要信号枢纽[10]。既往研究表明,TRIM38 能够通过多种方式(酶依赖或非酶依赖)调控Toll 受体通路下游信号蛋白及效应因子激活状态,从而影响Toll 样受体通路依赖的病理生理过程[9]。因此,TRIM38 甲基化导致的预后差异很可能与TRIM38 基因异常表达和对Toll 样受体通路的调控所带来的肿瘤免疫活动的影响有关。
总之,TRIM38可能通过非CpG岛低甲基化介导的基因异常表达上调,参与GBM 发生、发展;TRIM38非CpG岛甲基化可作为指导GBM预后评价的潜在生物标记物;TRIM38甲基化导致的预后差异很可能与Toll样受体通路及免疫调节的差异有关。
