人乳头瘤病毒感染与阴道微生态、炎症反应的关系分析
2020-04-14王希
王 希
人乳头瘤病毒(HPV)是功能基因E1-E7及结构基因L1、L2共同组成的嗜上皮性双链脱氧核糖核酸(dsDNA),多为一过性感染现象,但仍有10%女性可持续感染,且HPV持续感染不仅是宫颈病变的重要危险因素,也是导致宫颈癌的主要病因之一[1-2]。阴道微生态系统则在生殖道感染、尿道感染的预防中扮演重要角色,其具有动态变化特征,并受年龄、经期时长、性交频率等多因素影响。阴道微生物不仅可执行生理功能,亦可抵御明显病原菌或抑制潜在病原菌上,一旦菌群结构失衡,则可增加生物个体感染各种疾病的风险[3-4]。同时,有研究[5-6]报道,当局部微环境中炎症因子发生异常改变,Th1/Th2平衡被打破,并向Th2漂移,则可引起机体免疫应答紊乱,增加患病风险。当前研究HPV感染、阴道微生态、炎症反应的临床报道虽并不少见,但多基于宫颈病变基础,且诊断方式、所选取指标内容繁杂不一、研究对象各异,仍有待持续补充及完善。鉴于此,本研究采集病例,并着重分析HPV感染与阴道微生态、炎症反应的关系,旨在进一步补充及完善其与阴道微生态、炎症反应的关系,为HPV的临床防治提供参考意见,现作报道。
1 资料与方法
1.1 纳入与排除标准 纳入标准:(1)性生活规律;(2)月经规律,经期持续时间为5~7 d;(3)入组前1周内无抗生素使用史;(4)样本采集前3 d内无性生活史;(5)无阴道灌洗史;(6)无阴道用药史;(7)入院后均行HPV、宫颈液基细胞学及阴道微生态检测;(8)知晓研究内容并自愿签署研究知情同意书。排除标准:(1)合并糖尿病或高血压疾病;(2)系统性红斑狼疮病人;(3)风湿性免疫疾病病人;(4)正在行宫颈病变治疗病人;(5)全子宫切除病人;(6)妊娠期、哺乳期女性;(7)合并宫颈癌前病变或宫颈癌病人。
1.2 一般资料 按上述纳入与排除标准将2014年1月至2018年2月于我院确诊为HPV感染且宫颈液基细胞学阴性病人182例设为HPV感染组,年龄20~48岁,首次性生活年龄18~25岁;另将同期于我院行健康体检或孕前检查,HPV及宫颈液基细胞学阴性的160名女性设为对照组,年龄19~49岁,首次性生活年龄18~24岁;2组年龄、首次性生活年龄具有可比性。
1.3 检测方法 (1)HPV检验:应用样本刷在子宫颈、外口顺时针旋转5圈收集子宫颈脱落细胞,并置入保存液,13 000 r/min离心10 min后弃上清液,再加入50 μL裂解液后100 ℃下加热15 min,13 000 r/min离心10 min后留取上清液;依次PCR扩增、杂交、洗膜、显色,依据对照膜条在PC位置上的显色判定结果,蓝色提示杂交显色正常,斑点显现位置即为HPV亚型。(2)阴道微生态检测:应用无菌棉拭子留取阴道侧壁上1/3分泌物,第一根棉拭子用pH精密试纸检测(奥克,pH>4.5即诊断为pH值升高),0.9%氯化钠溶液分泌物置于玻片上,400倍镜下观察阴道假丝酵母菌病(VVC)、需氧菌性阴道炎(AV;参照Donders诊断表,评分≥3分即诊断为AV阳性)、白细胞(WBC;>10个/HPF即可诊断为阴道炎症)及乳杆菌(Ⅱb、Ⅲ即定义为乳杆菌减少);第二根棉拭子涂片,1 000倍镜下观察VVC(结合10%KOH湿片,发生芽生孢子或假菌丝即诊断为VVC阳性)、细菌性阴道病(BV;Nugent≥7分为BV阳性)。(3)炎症反应:暴露宫颈口后应用5 mL灭菌0.9%氯化钠溶液冲洗宫颈口及宫颈表面,后穹隆吸出4 mL灌洗液,混匀后装入1.5 mL无菌EP管,3 000 r/min 4 ℃条件下离心5 min;取上清液分装后-80 ℃保存,ELISA双抗体夹心法检测上清液中细胞因子白细胞介素-2(IL-2)、IL-4、γ-干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、IL-6、IL-10水平,并计算IFN-γ/IL-4、IL-2/IL-4比值;其中ELISA试剂盒购自欣博盛(深圳),酶标检测仪检测各孔相对应OD450值;将每个标准品及标本的OD值-空白孔OD值,按不同浓度标准品所对应的OD450为纵坐标,标准品浓度为横坐标,绘制标准曲线并求出相应位置样本中细胞因子含量。
1.4 统计学方法 采用t(或t′)检验、χ2检验和logistic回归分析。
2 结果
2.1 2组阴道微生态异常情况比较 2组WBC>10个/HPF比例差异无统计学意义(P>0.05);但HPV感染组中BV、VVC及AV阳性、pH>4.5、乳杆菌减少率均高于对照组(P<0.05~P<0.01)(见表1)。
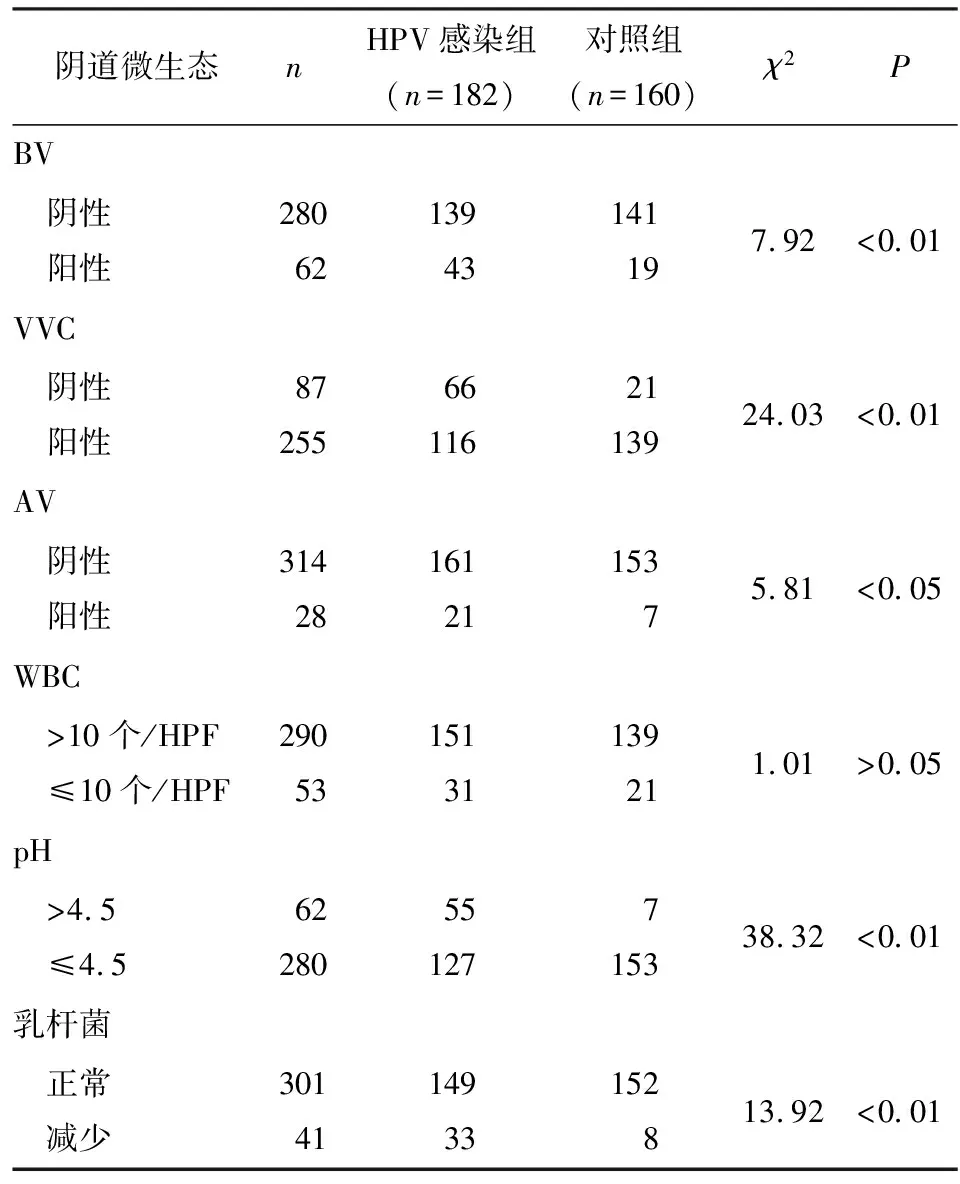
表1 阴道微生态异常情况在2组中比较(n)
2.2 2组炎症反应指标比较 2组TNF-α、IL-6、IL-10比较差异无统计学意义(P>0.05);但HPV感染组IL-2、IFN-γ、IFN-γ/IL-4、IL-2/IL-4均低于对照组,IL-4高于对照组(P<0.01)(见表2)。
2.3 HPV感染与阴道微生态、炎症反应的相关性分析 将HPV感染、阴道微生态及炎症反应指标分别赋值,HPV感染为因变量(阳性=0、阴性=1),BV(阳性=0、阴性=1)、VVC(阳性=0、阴性=1)、AV(阳性=0、阴性=1)、pH值(>4.5=0、≤4.5=1)、乳杆菌(减少=0、正常=1)、IL-2(与对照组均值95%CI范围内特定值为参考,低于参考值=0,高于参考值=1)、IL-4(低于参考值=0,高于参考值=1)、IFN-γ(低于参考值=0,高于参考值=1)、IFN-γ/IL-4(低于参考值=0,高于参考值=1)、IL-2/IL-4(低于参考值=0,高于参考值=1),经logistic回归分析,BV、VVC、AV、pH值、乳杆菌、IL-2、IFN-γ、IFN-γ/IL-4、IL-2/IL-4均与HPV感染密切相关(P<0.05~P<0.01)(见表3)。
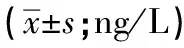
表2 2组炎症反应指标比较
*p示t′值
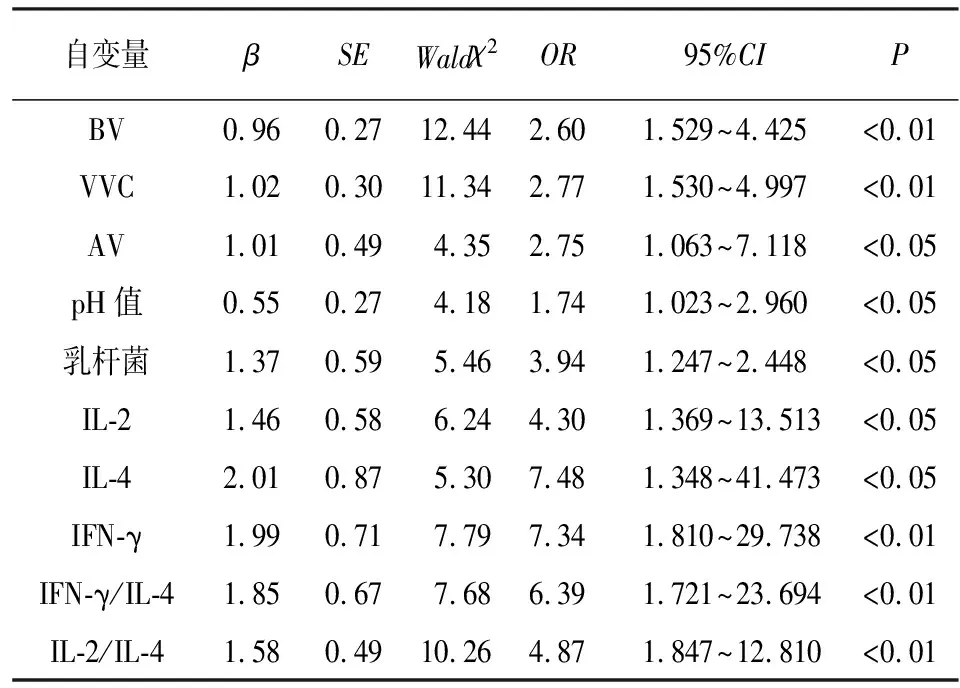
表3 HPV感染与阴道微生态、炎症反应的logistic回归分析
3 讨论
本研究显示,2组阴道微生态指标中WBC>10个/HPF比例差异无统计学意义;但HPV组中BV、VVC及AV阳性、pH值>4.5、乳杆菌减少比例均显著低于对照组;且进一步logistic回归分析,BV、VVC、AV、pH值、乳杆菌均是HPV感染的独立影响因素。其中BV、VVC与HPV感染的临床报道较多,如孟龄婷等[7-8]报道,BV、VVC与HPV感染密切相关,本研究结论均与之一致;分析或与BV、VVC病人乳杆菌下降,普雷沃菌、人形支原体等增加后导致HPV感染风险更高有关。也有部分研究结论认为,VVC系过敏反应的一种,其虽可引起局部血管扩张,增加血管通透性并引发炎症反应,但对阴道菌群无明显破坏作用,因此,VVC与HPV感染的关系仍有待持续补充及完善[9-10]。
同时,夏玉洁等[11]报道HPV组中AV阳性比例高达75.0%,提示AV亦是HPV感染的重要影响因素,本研究结论与之相一致,分析或因AV感染引起中重度炎症反应后,受慢性炎症刺激影响,机体自然免疫反应机制被抑制,故具更高的感染风险;潘颖等[12]则报道,HPV病人阴道菌群中乳杆菌明显减少,亦与本研究结论相一致;究其原因,正常情况下,阴道微生物中,乳杆菌占优势地位,其系维持阴道生态平衡、抑制病原微生物生长、增强阴道局部抗感染能力及抗肿瘤能力的重要菌落,一旦乳杆菌减少,其便难以发挥对应生理功能。而pH作为评价阴道微生态的综合评价指标,一般正常女性阴道pH值维持在3.8~4.5之间,一旦宿主机体状态发生变化,阴道内乳杆菌减少便可直接影响乳酸分泌,导致pH值异常上升,而pH值上升又进一步加重阴道微生态紊乱,并增加HPV感染风险,这与韩一栩等[13]的报道结论相一致,均提示阴道pH值与HPV感染密切相关;温先勇等[14]采集617例HPV感染者进行研究后亦指出,阴道酸碱度是影响HPV感染率的重要因素。
本研究还显示,2组TNF-α、IL-6、IL-10比较差异无统计学意义;但HPV感染组IL-2、IFN-γ、IFN-γ/IL-4、IL-2/IL-4显著低于对照组,IL-4高于对照组,进一步logistic回归分析显示,HPV感染与IL-2、IFN-γ、IL-4、IFN-γ/IL-4、IL-2/IL-4密切相关。其中IL-2作为免疫应答及免疫调节的核心因子,直接影响免疫细胞功能及宫颈局部免疫状态,并可增强巨噬细胞杀伤肿瘤的活性;IFN-γ则由活化的TH、NK细胞产生,主要发挥免疫调节作用,是促进Th1细胞发育、抑制Th2细胞活性及增殖的重要细胞因子;IL-4则主要由激活的Th2细胞分泌,可促进Th细胞向Th2细胞分化,并抑制其向Th1细胞分化;正常情况下,Th1、Th2细胞相互拮抗维持平衡,一旦其向Th2偏移,即可引起机体免疫应答紊乱,增加HPV感染风险[15-16]。
综上所述,HPV感染与阴道微环境、炎症反应具一定关联性,积极纠正阴道微环境紊乱,改善局部炎症反应,或可降低HPV感染风险。
