结缔组织生长因子基因启动子甲基化状态与糖尿病视网膜病变关系的研究
2020-04-14杨晓辉邓春颖
侯 雨,于 扬,杨晓辉,于 勤,邓春颖
糖尿病是以慢性高血糖为特征的一组代谢性疾病。其流行趋势异常严峻,全球糖尿病发病呈整体上升趋势。据统计[1],截至2013年全球共有3.82亿人患有糖尿病,预计25年后糖尿病患病人数将达到5.92亿,发展中国家面临的形势更为严峻,全球总患病人数的80.0%在发展中国家。而糖尿病视网膜病变(DR)是其严重慢性并发症,也是成年人最主要的致盲眼病,有资料[2]显示中国大陆糖尿病病人OR患病率为23%。DR发病机制未明,其病因可能与炎症、组织缺血缺氧、氧化应激、多元醇途径亢进、细胞增殖异常以及纤维化有关[3]。结缔组织生长因子(connective tissue growth factor,CTGF)是近年来新发现的一种细胞因子,被认为是TGF-β1的直接下游效应介质,可诱导下游的Ⅰ型胶原及Ⅲ型胶原的合成,可导致细胞外基质合成增加,进而导致组织纤维化。血清中CTGF水平异常与DR相关性已经得到证实。本实验通过分析DR病人CTGF基因启动子区甲基化状态,探讨CTGF基因启动子区甲基化与DR的联系。现作报道。
1 资料与方法
1.1 一般资料 参照1999年WHO对糖尿病的诊断与分型,选取2014年6月至2015年5月大连大学附属中山医院内分泌科住院的糖尿病病人120例,行眼底检查,糖尿病病人行眼底荧光造影,根据2002年DR国际临床分型统一标准,确诊其中DR组(DR组)57例,男30例,女27例,年龄(57.26±7.97)岁,病程(8.11±3.79)年;糖尿病不合并视网膜病变组(NDR组)63例,男31例,女32例,年龄(59.25±8.17)岁,病程(7.74±3.27)年;健康对照组(NC组)为来院健康体检者,共计58名,其中男27名,女31名,年龄(58.74±7.77)岁。排除标准:所有研究对象均排除糖尿病急性并发症、1型糖尿病、继发性糖尿病及妊娠糖尿病;排除急慢性感染、严重肝脏疾病、肾病综合征、高血压肾病、肾小球肾炎等肾脏疾病(糖尿病肾病可入组)、肿瘤以及自身免疫性疾病、其他可引起组织纤维化的疾病;排除其他疾病引起的视网膜病变;NC组排除糖耐量异常与空腹血糖受损。3组一般资料均具有可比性。本研究通过伦理委员会批准。
1.2 方法 采取调查问卷、查阅病例、体格检查的方式获取一般临床资料。研究对象禁食禁饮8 h后采集标本。
1.2.1 目的基因获取以及甲基化 采集研究对象静脉血2 mL,严格按照试剂盒(Ezup柱式血液基因组DNA抽提试剂盒,上海生物工程技术服务有限公司生产)要求提取DNA 50 μL,取目的基因20 μL,严格按照甲基化试剂盒(EZ DNA Methylation-GoldTM Kit,美国ZOMY RESEARCH)说明书进行DNA甲基化,获取甲基化产物10 μL,于-20 ℃冰箱保存。
1.2.2 MSPCR检测目的基因甲基化水平 经查Gene Bank数据库以及检索相关文献[4],确定CTGF甲基化引物(M)以及非甲基化引物(U),由上海生物工程技术服务有限公司合成CTGF(M)上游引物5′-TCG TTT CGG TCG ATA GTT TC-3′;下游引物5′-CGA AAC CCA TAC TAA CGA CG-3′;CTGF(U)上游引物5′TTG TTT TGG TTG ATA GTT TT-3′下游引物5′-CAA AAC CCA TAC TAA CAA CA-3′ ;其产物长度均为159 bp,严格按照Taq聚合酶扩增试剂盒(上海生物工程技术服务有限公司生产)说明书操作,扩增体系为50 μL,其中亚硫酸氢钠修饰DNA 1 μL,上下游M或者U引物各1 μL,RCR master 22 μL,dH2O 25 μL,甲基化与非甲基化反应条件为95 ℃预变性5 min,94 ℃变性45 s,50 ℃退火30 s,72 ℃延伸30 s,共38个循环,最后72 ℃延伸7 min。反应结束后,取产物10 μL用2.0%琼脂糖凝胶进行电泳,溴化乙锭染色,电泳结束后用凝胶成像系统拍照并分析。如果甲基化条带与非甲基化条带同时出现,判定为半甲基化;出现甲基化条带,无非甲基化条带出现,判定为甲基化;出现非甲基化条带而无甲基化条带出现,判定为去甲基化。
1.2.3 血清中CTGF蛋白检测 采集标本2 mL,EDTA抗凝,2 500 r/min离心5 min,吸取血清,置于1.5 mL离心管中,浓度测定采取ELISA法测定,严格按照试剂盒(上海生物工程技术服务有限公司生产)说明书操作,应用酶标仪450 nm 测定吸光度值及读出对应浓度数,根据标准品吸光度值计算出标本浓度。
1.3 统计学方法 采用t检验、方差分析和q检验、χ2检验。
2 结果
2.1 甲基化阳性率的判定 MSP凝胶电泳结果见图1。
2.2 CTGF基因启动子甲基化MSPCR结果 DR组CTGF基因启动子甲基化阳性率为24.45%低于NDR组的42.86%和NC组的78.95%(P<0.05和P<0.01);NDR组甲基化阳性率低于NC组的阳性率(P<0.01)(见表1)。
表1 各组CTGF基因启动子区甲基化状态的比较[n;百分率(%)]
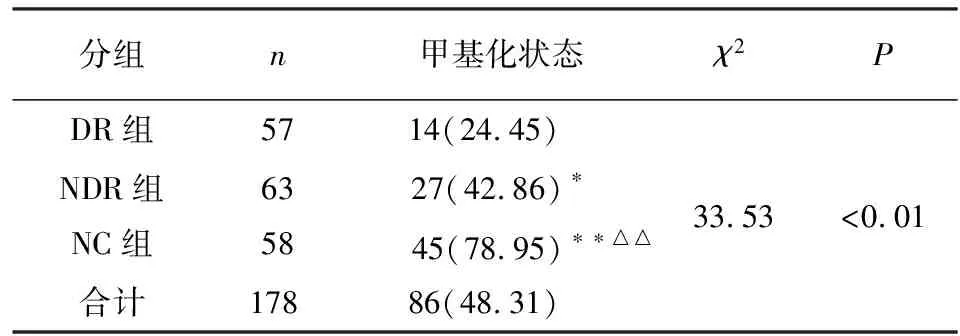
分组n甲基化状态χ2PDR组5714(24.45) NDR组NC组635827(42.86)∗ 45(78.95)∗∗△△33.53<0.01合计17886(48.31)
χ2分割:与DR组比较*P<0.05,**P<0.01;与NDR组比较△△P<0.01
2.3 各组血清中CTGF含量的比较 DR组血清CTGF水平高于NDR组和NC组(P<0.01);NDR组血清CTGF水平高于NC组(P<0.01)(见表2)。

表2 各组CTGF测定值的比较
q检验:与DR组比较**P<0.01;与NDR组比较△△P<0.01
3 讨论
DR是糖尿病严重并发症,目前其发病机制尚未完全阐明,已经有资料[5]显示CTGF与DR有关。CTGF是由BRADHAM等[6]于1991年在人类脐静脉内皮细胞的培养基中发现的一种分泌性蛋白,广泛分布于心、脑、肝、肾、肺、玻璃体、动脉等多种组织器官中。CTGF作用较为广泛,可以刺激并且诱导成纤维细胞向肌成纤维细胞转化进而导致器官或者组织纤维化,同时也可以刺激毛细血管形成并且可以促使细胞外基质沉淀的同时重塑细胞外基质[7-8];另外还可以介导细胞黏附,刺激细胞转移等[9]。作为纤维化介质,CTGF的存在有着重大意义,在正常条件下,CTGF表达很低,但是在应激、创伤、急性炎症等条件下,CTGF表达可上调,在损伤修复以及瘢痕形成中发挥重大作用,利于创面愈合,利于机体修复。而机体损伤修复后,CTGF含量可下调至正常。糖尿病病人因为微循环障碍导致组织缺血缺氧,导致血液中血小板及巨噬细胞活化从而导致TGF-β1大量的释放,TGF-β1是CTGF的上游因子,其上调导致了CTGF含量的上调,CTGF不但可以促使视网膜中毛细血管的生成[10],同时可以导致视网膜细胞外基质产生增多以及纤维化[11],由于CTGF含量上调,早期可导致毛细血管内皮细胞基底膜增厚,微血管瘤形成,进而导致毛细血管闭塞,视网膜细胞缺血缺氧加重,由于视网膜细胞缺血缺氧,进一步导致新生毛细血管以及纤维组织的生成,随着纤维组织的大量生成,逐渐牵拉视网膜,导致视网膜被撕脱,最终致使病人失明。本实验结果显示血清中CTGF水平,DR组高于NDR组与NC组,提示血清中水平与DR相关,CTGF在DR形成中起一定作用:CTGF可促进纤维化和毛细血管生成,CTGF的过表达与分泌可能是DR发生与发展的重要机制。
已经有实验[12]证实了高血糖与DR发生具有密切相关性,但是英国前瞻性糖尿病研究以及后续研究发现,糖尿病病人血糖控制良好之后,其视网膜病变的发病率仍高于对照组。其机制可能与代谢记忆现象有关。目前对代谢记忆现象的机制尚未明确,代谢记忆效应可能与表观遗传学有关。长期慢性高糖血症可引起血管病变包括大血管病变以及微血管病变,其共同机制为高血糖以及终末糖基化产物(AGEs)的增加使活性氧簇(ROS)的水平增加,从而使包括酪氨酸激酶(TK)、蛋白激酶C、丝裂原激活的蛋白激酶(MAPKs)等多条细胞转导通路被激活。这些通路的激活可以使NF-κB等转录因子活化,同时也使DNA甲基转移酶(DNMTs)与DNA去甲基化酶(DeMet)的水平紊乱,这些都可以导致异常的甲基化,而 DNA 甲基化可通过影响染色体结构和功能在基因表达的调节上起重要作用[13-14]。本实验发现DR组甲基化阳性率明显低于NDR组与NC组,CTGF甲基化水平与血清CTGF水平呈负相关;CTGF基因启动子去甲基化导致DR与糖尿病肾病相一致,提示二者可能在分子机制上有相似性。
综上,高血糖导致组织缺血缺氧,进而导致血液中血小板及巨噬细胞活化从而导致TGF-β1大量的释放,TGF-β1是CTGF的上游因子,其上调导致了CTGF含量的上调;而长期高血糖以及AGEs堆积可以导致氧化应激,从而激活细胞内转导通路,这些通路的活化不但导致了核转录因子的激活,也导致甲基化酶水平的紊乱。这些都可以导致CTGF基因启动子甲基化水平减低,高甲基化水平抑制目的基因表达,这种抑制解除之后致使基因表达增强,最终导致血清CTGF含量增多,而CTGF具有刺激毛细血管增殖、刺激成纤维细胞向肌成纤维细胞转化以及促使细胞外基质增生的作用,这些都可以引起组织纤维化,随着病情的进展而导致DR的发生。从表观遗传学角度,CTGF基因启动子低甲基化导致血清CTGF水平升高,可能是DR发生发展的机制之一。本实验一定程度上阐述了CTGF基因启动子甲基化与DR的关系,但因为CTGF功能众多,高血糖导致CTGF基因启动子区甲基化的具体机制有待更进一步阐明;由于本实验由于时间限制收集标本量少,且未将DR组标本具体分为背景期组与增殖期组,NC组因志愿者配合问题和医学伦理等原因均未能行眼底荧光造影检查,仅行眼底镜检查。在下一步实验中我们会尽可能多地招募志愿者,并将DR组分为非增殖期DR组(NPDR组)与增殖期DR组(PDR组),并结合检测房水CTGF水平,重点探讨CTGF基因启动子甲基化状态与增殖期DR的关系;检测TGF-β1、TSP1等相关因子的水平,探讨DR病人CTGF基因启动子低甲基化机制。
