NK细胞联合红花多糖对结肠癌细胞的杀伤作用及机制研究
2020-04-13韦喜生刘英香郑晓君
韦喜生 刘英香 郑晓君
(中国人民解放军第七十四集团军医院肿瘤科,广州 510318)
结肠癌是我国的十大恶性肿瘤之一,对人类健康威胁极大,合理饮食与中药治疗对其发生具有一定的预防作用[1]。目前结肠癌的主要疗法是放疗和化疗,存在毒副作用较大、易产生耐受性等问题[2]。因此,通过促进机体免疫而对抗肿瘤发生的疗法越来越引起临床医生关注[3,4]。
NK细胞是机体天然免疫的第一道防线,在抗肿瘤以及抑制自身免疫性疾病中发挥重要作用[5]。NK细胞通过直接杀伤作用和释放TFN-α、IFN-γ等细胞因子抑制肿瘤的发生发展[6]。近年来,中药多糖和中药提取物提高NK细胞杀伤活力来发挥免疫调节功能抗肿瘤的研究取得一定进展[7]。红花多糖(safflower polysaccharide,SPS)是中药红花的有效成分之一[8]。有研究表明,SPS可显著促进人结肠癌LoVo细胞的凋亡,还可促进人外周血单个核细胞增殖,增强NK细胞、淋巴因子激活的杀伤细胞(lymphokine activated killer cells,LAK)的杀伤活性,增强免疫功能[9]。本研究在此基础上研究NK细胞联合SPS对结肠癌细胞的协同杀伤效应,并初步探讨可能的作用机制。
1 材料与方法
1.1材料 结肠癌SW480细胞、NK细胞购自中国科学院上海细胞库。胎牛血清、DMEM培养(美国Gibco);细胞板、酶标仪(美国Bio-Rad);酶联免疫吸附试验(ELISA)检测试剂盒(上海联科生物技术有限公司);LipofectamineTM2000转染试剂盒(美国Invitrogen);四甲基偶氮唑盐比色法(MTT)(上海碧云天);倒置显微镜(美国Olympus)。
1.2方法
1.2.1SPS的制备 参考文献[10]的方法,红花1 000 g,充分浸渍,90℃提取4 h,中间不断搅拌,过滤,残渣重复提取一次,合并两次提取液浓缩至一定体积,加乙醇终浓度至85%,沉淀物加适量水溶解,置于分液漏斗中,加氯仿充分振荡,静置后去除氯仿层,反复操作6次。水层加95%乙醇沉淀后用无水乙醇、乙醚洗涤3次,干燥后即得SPS。
1.2.2细胞培养 结肠癌SW480细胞常规培养于含10%FBS的DMEM培养基,置于37℃,含5 % CO2恒温箱培养,每2~3 d传代一次。NK细胞取培养至14 d的细胞用于实验。
1.2.3MTT法检测细胞增殖 设置各浓度实验组(终浓度分为0、0.315、0.625、1.25、2.5 mg/ml);取对数生长的SW480细胞分别消化接种于96孔板(1×104个/孔),待细胞贴壁后加入相应浓度梯度的SPS,分别培养24 h、48 h、72 h后加入20 μl MMT,继续培养4 h后,加入150 μl DMSO,振荡混匀,测A570 nm,根据下列公式计算细胞增殖抑制率:细胞增殖抑制率=(空白组A值-实验组A值)/空白对照组A值×100%。NK细胞取培养至14 d加入相应浓度梯度的SPS,分别培养0 h、24 h、48 h后加入20 μl MMT继续培养4 h后,加入150 μl DMSO,振荡混匀,测A570 nm。
1.2.4钙黄绿素-AM释放法检测杀伤效率 参考文献[6]的方法,设置自然释放组(空白对照)、最大释放组(加Triton×100)、SPS组(终浓度0.625 mg/ml)、10∶1 NK组和联合实验组(10∶1 NK细胞+SPS),效靶比为10∶1。SW480细胞经钙黄绿素-AM染色液染色后,接种于96孔板,据上述分组加入SPS和NK细胞,共培养4 h后,取100 μl在酶标仪下测A570 nm 并计算杀伤效率。计算公式:细胞杀伤率=[(实验组A值-自然释放组A值)/(最大释放组A值-自然释放组A值)]×100%。以上实验重复3次。
1.2.5ELISA法检测蛋白表达 设置NK细胞组、NK细胞+SW480组、NK细胞+SPS组,NK细胞+SPS+SW480组,其中效靶比为1∶1,SPS终浓度0.625 mg/ml。取对数生长的SW480细胞分别消化接种于96孔板,加入相应的SPS和NK细胞,共培养 24 h 后,离心取上清,按ELISA试剂盒说明书进行检测。
1.2.6流式分析法检测活化性受体表达水平和NKG2DLs表达 实验分为NK细胞组、NK细胞+SW480组、NK细胞+SPS组,NK细胞+SPS+SW480组,效靶比为1∶1,SPS终浓度为0.625 mg/ml,将细胞接种于6孔板,加入相应的SPS和NK细胞,共培养24 h后,收集细胞进行流式抗体染色。每组均设6个复孔,重复3次。结果用Flowjo 7.6.1软件处理后进行统计分析。
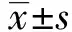
2 结果
2.1不同浓度的SPS对结肠癌细胞的抑制率 MTT法检测结果(表1)显示,用不同浓度SPS处理结肠癌SW480细胞后,分别于24 h、48 h、72 h时检测细胞增殖,结肠癌SW480细胞的存活率随SPS的浓度升高而逐渐显著下降(P<0.05)。
2.2不同浓度的SPS对NK细胞增殖的影响 MTT法检测结果(表2)显示,用不同浓度SPS处理NK细胞后,分别于0 h、24 h、48 h时检测细胞增殖,在24 h和48 h,相较于0 mg/ml 组,不同浓度SPS组中NK细胞数量显著增加,但SPS的浓度超过0.625 mg/ml后增加数量降低(P<0.05)。
2.3NK细胞联合SPS对结肠癌细胞的杀伤率 实验选择终浓度为0.625 mg/ml的SPS。钙黄绿素-AM释放法检测结果(表3)显示,相较于SPS组,10∶1 NK细胞组对结肠癌细胞的杀伤率显著升高,相较于SPS组和10∶1 NK细胞组,10∶1 NK细胞+SPS组对结肠癌细胞的杀伤率也显著升高(P<0.05)。
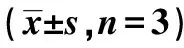
Tab.1 Inhibition rate of different concentrations of safflower polysaccharide on colon cancer cells
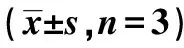
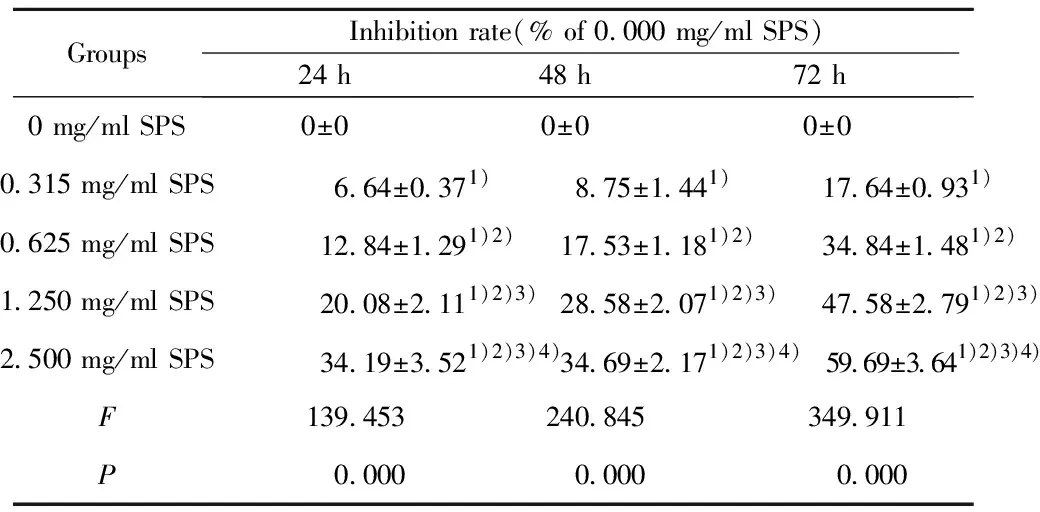
GroupsInhibition rate(% of 0.000 mg/ml SPS)24 h48 h72 h0 mg/ml SPS0±00±00±00.315 mg/ml SPS6.64±0.371)8.75±1.441)17.64±0.931)0.625 mg/ml SPS12.84±1.291)2)17.53±1.181)2)34.84±1.481)2)1.250 mg/ml SPS20.08±2.111)2)3)28.58±2.071)2)3)47.58±2.791)2)3)2.500 mg/ml SPS34.19±3.521)2)3)4)34.69±2.171)2)3)4)59.69±3.641)2)3)4)F139.453240.845349.911P0.0000.0000.000
Note:1)P<0.05 vs 0 mg/ml SPS;2)P<0.05 vs 0.315 mg/ml SPS;3)P<0.05 vs 0.625 mg/ml SPS;4)P<0.05 vs 1.250 mg/ml SPS.
2.4检测各组NK细胞中TNF-α和IFN-γ的表达 用ELISA法检测各组NK细胞TNF-α、IFN-γ 蛋白的表达情况,结果显示(表4),相较于NK细胞组,NK细胞+SW480组和NK细胞+SPS组中TNF-α、IFN-γ 蛋白表达显著升高,相较于NK细胞+SW480组和NK细胞+SPS组,NK细胞+SPS+SW480组中TNF-α、IFN-γ 蛋白表达显著升高(P<0.05)。
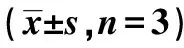
GroupsSurvival cell number(×103)0 h24 h48 h0 mg/ml SPS10.05±1.057.11±0.076.25±0.050.315 mg/ml SPS10.18±1.0410.48±1.071)10.98±1.041)0.625 mg/ml SPS10.60±1.1311.60±1.221)12.76±1.281)1.250 mg/ml SPS10.28±1.249.25±0.961)9.58±0.981)2.500 mg/ml SPS10.07±1.119.17±0.891)8.29±0.851)F0.0319.69521.132P0.9980.0020.000
Note:1)P<0.05 vs 0 mg/ml SPS.
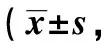
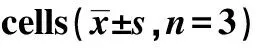

GroupsKilling rate(%)SPS10.19±1.2510∶1 NK cell27.58±2.491)10∶1 NK cell+SPS39.37±4.161)2)F77.362P0.000
Note:1)P<0.05 vs SPS group;2)P<0.05 vs 10∶1 NK cell group.
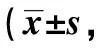
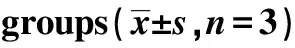
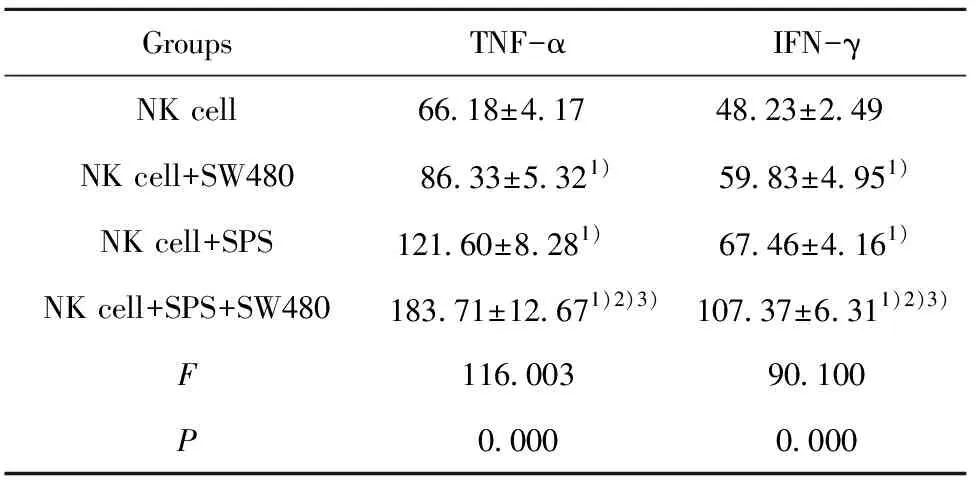
GroupsTNF-αIFN-γNK cell66.18±4.17 48.23±2.49 NK cell+SW48086.33±5.321)59.83±4.951)NK cell+SPS121.60±8.281) 67.46±4.161)NK cell+SPS+SW480183.71±12.671)2)3)107.37±6.311)2)3)F116.00390.100P0.0000.000
Note:1)P<0.05 vs NK cell group;2)P<0.05 vs NK cell+SW480 group;3)P<0.05 vs NK cell+SPS group.
2.5检测各组NK细胞中NKG2DLs的表达 用流式分析法检测各组NK细胞中NKG2DLs的表达率,结果显示(表5),相较于NK细胞组,NK细胞+SW480组和NK细胞+SPS组中MICA、MICB、ULBP1蛋白表达显著升高,相较于NK细胞+SW480组和NK细胞+SPS组,NK细胞+SPS+SW480组中MICA、MICB、ULBP1蛋白表达显著升高(P<0.05)。可见,无论有无结肠癌细胞的存在,NK细胞中MICA、MICB、ULBP1蛋白的表达水平均显著提高,与SPS联合后NK细胞MICA、MICB、ULBP1蛋白的表达也显著提高。
2.6检测各组NK细胞中活化性受体表达水平 流式分析法检测结果显示(图1,表6),相较于NK细胞组,NK细胞+SW480组和NK细胞+SPS组中NKp46表达水平显著升高,相较于NK细胞组、NK细胞+SW480组和NK细胞+SPS组,NK细胞+SPS+SW480组中NKp46表达水平显著升高(P<0.05)。
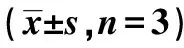
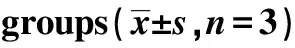

Groups MICA(%)MICB(%)ULBP1(%)NK cell43.41±2.0952.96±2.117.68±0.86NK cell+SW48057.08±3.661)70.59±3.351)12.39±1.371)NK cell+SPS63.22±4.421)78.21±3.841)17.58±1.531)NK cell+SPS+SW48072.51±5.671)2)3)86.30±4.231)2)3)23.26±1.881)2)3)F25.74850.30263.624P0.0000.0000.000
Note:1)P<0.05 vs NK cell group;2)P<0.05 vs NK cell+SW480 group;3)P<0.05 vs NK cell+SPS group.

图1 各组NK细胞中活化性受体NKp46表达流式细胞图Fig.1 Flow cytometry of expression of activating receptor NKp46 in NK cells in various groups
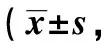
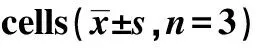

GroupsNKp46(%)NK cell55.37±2.61NK cell+SW48067.15±3.541)NK cell+SPS65.45±3.691)NK cell+SPS+SW48075.77±4.071)2)3)F169 66P0.001
Note:1)P<0.05 vs NK cell group;2)P<0.05 vs NK cell+SW480 group;3)P<0.05 vs NK cell+SPS group.
3 讨论
结直肠癌是人类高发恶性肿瘤,其发病率一直呈上升趋势,死亡率居恶性肿瘤的第二位[11]。现有研究证明中药复方与化疗联用或可提高大肠癌的放化疗敏感性,减轻不良反应并预防肿瘤复发等,对结肠癌亦有一定疗效[12,13]。
红花是菊科植物红花(Carthamustinctorius L.)的干燥花,SPS是红花的主要有效成分之一,具有抗肿瘤、提高免疫力等作用[14]。SPS可抑制结肠癌细胞增殖、侵袭,调节细胞周期,其抗肿瘤效应可能与Bax、Bcl-2、Caspase-3等信号通路有关[9]。SPS对肝癌、宫颈癌的增殖也有一定的抑制作用,并有一定的剂量依赖性[15,16]。SPS可通过促进荷瘤鼠血清IL-12、TNF-α及降低IL-10表达而发挥免疫调节及抑瘤作用[17]。此外,SPS对人非小细胞肺癌A549细胞的增殖有抑制作用,相关机制可能与提高机体的自身免疫力有关[18]。本研究结果显示,SPS可抑制结肠癌细胞的增殖并有明显的时间、浓度依赖性,与前人关于SPS对其他肿瘤的作用相符,且本研究中SPS对NK细胞增殖有明显促进作用。
NK细胞具有分泌细胞因子、调节适应性免疫反应、防御感染及溶解破坏肿瘤细胞等多种重要功能,对肝癌细胞、非小细胞肺癌、乳腺癌、宫颈癌、卵巢癌、肾癌均有显著杀伤和抑制作用[19-22]。结直肠癌患者NK细胞活力显著降低,治疗后NK细胞活力能迅速激发的患者预后较好[23],本实验结果显示NK对结直肠癌细胞具有杀伤作用,与前人结论相符。激活NK细胞活性可增强其抗结直肠癌能力[24]。NK活性主要受其表面的活化性和抑制性受体调控[25]。上调NK细胞活化性受体NKp80,可增强NK细胞抗肿瘤功能[26]。NKp46是NK细胞表面活化受体的一种,与配体结合后可活化NK细胞分泌TNF-α、IFN-γ[27],本实验中NKp46与TNF-α和IFN-γ的表达水平呈正相关,与该结论相符,且NK细胞杀伤力强时NKp46、TNF-α和IFN-γ的表达水平均显著升高。NKp46过表达增加小鼠中NK细胞的免疫能力,下调NKp46促进免疫逃逸[28,29]。
近年研究发现,NK细胞与多糖类药物联用具有显著的抗肿瘤作用。如人参多糖通过上调活化受体(NKp30、NKp44、NKp46)的表达促进NK92-MI细胞的活化,提高其杀伤活性[30]。唐古特白刺果多糖可增加IFN-γ的含量能力和NK细胞的数量发挥抗肿瘤免疫功能[31]。其他某些药物如舒尼替尼等则可选择性诱导肿瘤细胞高表达NKG2DLs(MICA、MICB和ULBP2等),增强肿瘤细胞对NK细胞的杀伤敏感性[32,33]。本研究结果显示,SPS可促进NK细胞的TNF-α、IFN-γ分泌及NKp46和NKG2DLs(MICA、MICB、ULBP1)表达且增强其对结肠癌细胞的杀伤和清除作用。以上研究可说明中药多糖可能增加NK细胞对肿瘤的杀伤力。
综上所述,NK细胞与SPS联合体外杀伤结肠癌细胞具有协同作用,其作用机制可能与SPS调控NK细胞TNF-α、IFN-γ的分泌及活化性受体和活化性配体表达水平有关。我们的研究可为SPS在基于NK细胞的结肠癌的临床免疫治疗提供新的思路,对结肠癌的免疫治疗具有重要意义。