Hippo信号通路与炎症的研究进展①
2020-04-13麻明彪杜廷义陶律延屈柯暄李小娟计震华简苗苗陈泰桂罗丽莎宝福凯柳爱华
麻明彪 杜廷义 陶律延 屈柯暄 李小娟 计震华 简苗苗 陈泰桂 罗丽莎 丁 喆 宝福凯 柳爱华
(昆明医科大学基础医学院,昆明 650500)
Hippo信号通路,也称之为Salvador/Warts/Hippo(SWH)通路,因该信号通路的关键蛋白激酶Hippo突变可使果蝇组织增生,表型像河马而以此命名。1995年Justice等[1]对果蝇进行基因嵌合体筛查,首次在果蝇体内发现该信号通路中的Wts(Warts)基因,并且该基因参与调节细胞增殖及肿瘤抑制。1999年,Tao等[2]研究证实果蝇Wts的哺乳动物同源物大肿瘤抑制子(Large tumor suppressor,Lats)同样具有抑制肿瘤的作用,其配体为细胞周期调节因子CDC2。随后,研究其上游调控因子和下游其他作用受体引起了科学界的广泛关注,2002年,2个研究团队发现Salvador(Sav)为Wts的直接作用蛋白,该蛋白包含两个WW结构域。Sav与Wts相互作用,通过调控Cyclin E和Diap的转录来抑制细胞增殖,促进细胞凋亡[3,4]。2003年,研究者鉴定出肿瘤抑制基因Hippo(Hpo),该基因编码Ste-20家族蛋白激酶,并与哺乳动物体内MST1和MST2同源。此外,一系列研究发现,Hpo可以与Sav和Wts相互作用,通过相同信号通路抑制细胞增殖[5-9]。2005年,经鉴定,Mats被认为是Hippo通路的关键调节器,抑制Mats活性可导致大量组织生长,表型与由Hpo、Sav或Wts缺失所致者相似。同年,研究证实Yorkie为Hippo信号通路的核效应因子[10]。Hippo信号通路的相关重要发现按时间顺序总结如图1所示。之后,其他物种体内的Hippo信号通路相关分子组成元件也陆续被发现,并确定了该信号通路在调节细胞增殖和凋亡方面发挥着至关重要的作用。
1 Hippo信号通路
在果蝇(Drosophila)体内,经典的Hippo信号通路主要由一系列串联激酶Hpo(Hippo)、Sav(Salvador)、Wts(Warts)、Mats(Mob as tumor suppressor),转录共激活因子Yki(Yorkie)及其结合的转录因子Sd(Scalloped)组成,Hippo信号通路的激活和失活依赖于通路相关激酶级联反应的激活与失活。在上游调控信号作用下,核心激酶发生激酶级联反应,最初Hpo自磷酸化,与支架蛋白Sav形成复合物,Hpo-Sav复合物进而活化Mats和Wts,形成Wts-Mats复合物,随即磷酸化下游的效应因子Yki,使其与细胞质内细胞骨架蛋白14-3-3蛋白相结合而滞留于胞浆中,由此不能进入细胞核与转录因子Sd相互作用,从而发挥抑制细胞增殖,促进细胞凋亡的作用[14](图2)。

图1 Hippo信号通路相关重要发现的时间顺序[11-13]Fig.1 Time of important discoveries related to Hippo signaling pathway[11-13]
Hippo信号通路在进化上高度保守,其核心成员在哺乳动物体内有对应果蝇的同源蛋白分子,MST1/2(mammalian sterile 20-like kinase 1/2)、SAV1(human Salvador 1)、LATS1/2(Large tumor suppressor 1/2)、MOB1(Mps One Binder kinase activator-like 1)、YAP(Yes-associated protein)/TAZ(Tafazzin)及TEAD(TEA domain family member)分别为果蝇中Hpo、Sav、Wts、Mats、Yki及Sd的同源蛋白,且可发生与果蝇类似的逐级磷酸化过程。其中MST1/2和LATS1/2是哺乳动物经典Hippo 信号通路的核心激酶,MST1/2磷酸化可激活通路蛋白SAV1、LATS1/2及MOB1。此外,活化的MST1/2可通过结构域SARAH(Sav/Rassf/Hpo)与构架蛋白SAV1(WW45)相互作用,形成MST1/2-SAV1复合体,该复合体可增强MST1/2对下游LAST1/2蛋白的磷酸化作用。经MST1/2活化的调节蛋白MOB1也可促进LATS1/2的磷酸化。活化的LAST1/2随即磷酸化下游主要效应分子YAP及其旁系同源分子TAZ的第五位丝氨酸残基,发生磷酸化的YAP/TAZ滞留在细胞质中而无法进入胞核,经泛素化后被蛋白酶降解[15-17]。而当Hippo信号通路被抑制或处于静息状态时,YAP发生核转位聚集到细胞核中,与核内转录因子TEAD结合形成复合物,激活下游促进细胞增殖生长,抑制细胞凋亡的基因转录,如CTGF、AREG等,进而促进蛋白合成和组织器官生长[18](图2)。
2 Hippo通路与炎症
自发现以来,Hippo信号通路已成为哺乳动物调节细胞增殖和凋亡的信号传导中枢。由Hippo通路核心元件MST1/2、LATS1/2、YAP/TAZ介导的经典信号传导对于机体发育和组织内稳态的维持起着重要的调控作用。研究表明,异常的Hippo信号通路与机体免疫调节、肿瘤、心血管系统等疾病相关[19-21]。此外,随着对Hippo信号通路的研究不断深入,近年来研究发现Hippo信号通路还参与调节机体炎症的发生、发展过程[22]。
炎症是机体为消除各种外源性或内源性损伤因子,清除和吸收坏死组织细胞以及修复损伤的一种复杂的免疫防御性过程。炎症的发生一方面可保护机体免遭损伤,另一方面,由于炎症刺激的持续存在,炎症微环境可导致细胞增殖、突变、坏死,甚至诱发肿瘤。多种免疫细胞及信号传导通路(Jak/Stat信号通路、NF-κB信号通路和Toll样受体信号通路等)介导了炎症的发生,研究已证实炎症的发生不仅仅依靠单一的炎症通路进行信号的传递,Hippo信号通路相关分子也参与免疫细胞分化发育以及功能的调控,并且该信号通路与某些炎症信号通路存在交互作用而共同参与调控炎症的发生。
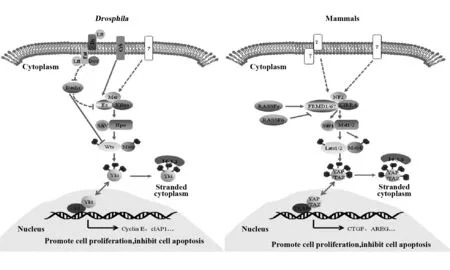
图2 果蝇与哺乳动物的Hippo信号通路图Fig.2 Hippo signaling pathway in Drosophila and mammals
2.1Hippo信号通路与免疫细胞分化发育 辅助性T细胞(helper T cell,Th)17和调节性T细胞(regulatory T cells,Treg)是两种在炎症反应中起重要作用的CD4+T淋巴细胞亚型。两种细胞在分化上相互联系,在转化生长因子β1(TGF-β1)单独刺激下,初始CD4+T细胞可分化为Treg细胞,而在IL-10存在的条件下,TGF-β1和IL-6的共同刺激可促使初始CD4+T细胞分化为Th17细胞,同时抑制Treg细胞的产生[23]。同时,两种细胞在功能上相互抑制,Th17细胞属于“促炎细胞”,介导炎症反应,该细胞表面表达多种炎性细胞因子受体,如趋化因子受体4(CCR4)、趋化因子受体6(CCR6)和IL-23受体(IL-23R)等,并且可分泌IL-17A、IL-17F、IL-21和IL-22等多种细胞因子,其中IL-17A和IL-17F可进一步诱导单核/巨噬细胞、上皮细胞和成纤维细胞等合成分泌肿瘤坏死因子α(TNF-α)、IL-1β、IL-6、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、基质金属蛋白酶1(MMP-1)、MMP-3和前列素E2(PGE2),最终促进炎症的发生[24]。而Treg细胞属于“抑炎细胞”,介导免疫耐受,该细胞可表达高亲和性的IL-2受体CD25和转录因子叉头蛋白3(Foxp3),可通过细胞与细胞间的接触依赖性抑制或释放抗炎细胞因子(如IL-10、IL-35和TGF-β等)发挥抗炎作用[25]。Th17细胞与Treg细胞在机体微环境中处于一种动态平衡的状态,其失衡是导致机体多种炎性疾病和自身免疫性疾病的重要原因[26]。研究发现,MST1/2对Treg细胞和Th17细胞的发育和功能也起着重要的调控作用。MST1激酶可通过直接磷酸化转录因子Foxo1/3而增强其稳定性,或通过磷酸化Akt,抑制Akt磷酸化Foxo1/3的活性,间接增强Foxo1/3的稳定性,从而促进Foxp3表达和Treg细胞发育[27]。而敲除MST2对小鼠Treg细胞的发育无明显影响,但在MST1/2双敲除小鼠的胸腺中Treg的比例较MST1单敲小鼠明显下降,由此表明MST1在Treg的发育与功能上起主导作用,而MST2在一定程度上可以代偿性MST1的功能[27]。而对Th17细胞发育的调控,研究发现MST1缺失可促进Th17细胞的分化发育[28]。小鼠动物实验也发现,敲除MST1/2的小鼠,Th17细胞的比例显著增加,而Treg细胞的比例明显下降,其机制为转录共激活因子TAZ可促进RORγt的转录活性,同时通过降低Foxp3蛋白的稳定性而抑制Foxp3的功能,从而促进Th17细胞的分化和减弱Treg细胞的产生。同时,研究也发现在初始CD4+T细胞分化为Treg细胞时,TEAD1的表达量明显上升,但由于TAZ与TEAD1具有更高的结合亲和力,从而阻断了TAZ与RORγt,或Foxp3的相互作用,因此TEAD1的表达可增强初始CD4+T细胞分化为Treg细胞的能力[29]。虽然炎症是多种免疫细胞介导的复杂反应,但Hippo信号通路对其他免疫细胞(如中性粒细胞、NK细胞和单核-吞噬细胞等)分化发育的调控研究少有报道,其中对MST1在B细胞的发育和功能中的研究,目前也只发现在MST1敲除小鼠中,外周血B细胞数目减少、脾边缘区B细胞的缺失等。
2.2Hippo信号通路与Toll样受体信号通路 Toll样受体(Toll-like receptors,TLRs)活化和由此引起的下游促炎/抗炎细胞因子的分泌,导致机体免疫系统失衡是引起感染性炎症的重要原因。TLRs是一组存在于宿主免疫细胞表面的Ⅰ型跨膜蛋白,在机体非特异性免疫中发挥重要作用,同时也是连接特异性免疫和非特异性免疫的中间桥梁,该受体属于模式识别受体(pattern recognition receptor,PRR),可识别微生物表面上结构恒定、进化保守的病原体相关分子模式(pathogen-associated molecular patterns,PAMP),目前在人体内发现的TLRs 达11种。除TLR3外,Toll样受体家族成员介导的炎症反应都要通过一条经典的信号通路,即TLRs识别PAMP后,通过胞内TIR(Toll/IL-1R)区募集含有TIR结构域的接头蛋白髓样分化因子88(myeloid differentiation factor 88,MyD88),通过其结合募集IL-1受体相关激酶(IL-1 receptor-associated kinase,IRAK)家族蛋白,形成MyD88-IRAKs复合体,随之依次活化IRAKs、肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF-6)、转化生长因子激酶1(transforming growth factor activated kinase-1,TAK1)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和IκB激酶 (inhibitor of NF-κB,IκB),进而激活核因子κB(nuclear factor κB,NF-κB),最终诱导促炎细胞因子的表达和释放[30-33]。而TLR3 信号是通过TRIF(TIR-domain-containing adaptor-inducing interferon β)或MyD88活化IRF-3,最终介导机体Ⅰ型干扰素的产生。
Toll样受体信号通路在果蝇中也是调节体液免疫应答的主要信号通路之一,革兰氏阳性菌感染后可启动蛋白水解级联反应,通过激活Toll受体的配体Spatzle (Spz)从而激活Toll信号通路,活化的Toll信号通过MyD88和蛋白激酶Pelle 促进Cactus (Cact) 蛋白磷酸化而降解,使NF-κB家族转录因子Dorsal (Dl)和Dorsal 相关免疫因子(Dif)转位进入细胞核,最终诱导抗菌肽的表达而抵抗病原微生物的感染。Cact蛋白是一种含有细胞质锚蛋白重复序列的蛋白质,可通过将NF-κB家族转录因子Dl和Dif保留在细胞质中而降低抗菌肽的转录。Bo等[34]研究发现在果蝇中TLRs介导的Hippo信号通路在抗菌过程中具有重要调节作用。革兰阳性菌与Toll样受体作用后,可通过Toll-MyD88-Pelle级联反应促进Hippo通路抑制性复合物STRIPAK-PP2A的必需亚基Cka发生磷酸化并降解,从而激活Hippo通路发生激酶级联反应,当果蝇脂肪体中Hippo信号通路的抑制因子缺失或Yorkie激活时,会导致Cact的表达上升,使得抗菌肽的表达下降而容易被革兰氏阳性菌所感染。这一研究结果阐明了在果蝇先天免疫中Toll受体通过Hippo信号通路调控Cact表达的分子机制,证明了Hippo信号通路在免疫应答中的调控作用,为Hippo信号通路的研究提供了新的思路。Geng等[35]研究发现,TLR1/2/4可诱导激酶Mst1和Mst2活化,活化的Mst1和Mst2激活蛋白激酶Cα(PKCα),进而使LyGDI-Rac复合体部分磷酸化,Rac从复合物中解离出来,而TLR信号通路中的TRAF6与Rac结合,并催化Rac赖氨酸16的k63链发生多聚泛素化而活化,活化的Rac可促进TRAF6-ECSIT复合物的组装,从而促进细胞内线粒体向吞噬小泡募集并使mROS生成增多,最终释放大量的活性氧(ROS)以杀伤和清除吞噬小泡中的病原体。Wang等[36]研究发现,YAP能够负调控机体的抗病毒免疫反应,YAP可与转录因子IRF3相互作用并抑制其二聚化,从而阻断IRF3在病毒感染后进入细胞核的过程。YAP缺失可增强IRF3的功能,并促进β干扰素(IFN-β)的表达,在体内和体外均能抑制病毒的复制。此外,该研究还发现YAP独立于Hippo和LATS1/2调控的新机制,即病毒活化的IKKε能促进YAP的Ser403位点磷酸化,引发溶酶体中YAP降解,使得YAP介导的抑制细胞抗病毒效应减轻。近期,Lv等[37]研究发现,炎症介质LPS、TNF-α和H2O2可激活TLR4,通过TLR4-MyD88-IRAK1/4-TRAF6-YAP-TAK1-NF-κB系列传导途径促进炎症的发生,而Hippo信号通路中的 YAP蛋白可直接作用于信号传导通路中的TRAF6,一方面促进TRAF6 K48位点泛素化而使蛋白降解,另一方面抑制K63位点泛素化,从而抑制对下游蛋白TAK1的激活,进而抑制核转录因子NF-κB信号通路来减轻炎症的发生,发挥抗炎作用。Deng等[38]研究发现,关节炎发生时,关节软骨中的YAP蛋白表达明显降低,其表达水平随关节损伤程度的加剧而逐渐降低,其机制与炎性细胞因子TNF-α、IL-1β可加速YAP/TAZ蛋白的降解,抑制YAP/TAZ的转录活性有关。同时炎性介质激活Toll样受体信号通路,TLRs信号通路关键分子TAK1可促进YAP/TAZ磷酸化,并促进YAP/TAZ与β-TRCP结合,进而通过泛素化使其降解。此外,该研究也发现YAP可通过抑制NF-κB信号传导通路以缓解关节炎进程。Boro等[39]研究表明,Hippo通路还参与了结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染机体后的炎性反应。Mtb感染机体后, CCL2、CCL3、CCL7、CXCL1、CXCL2、CXCL15等多种促炎趋化因子表达增加,而敲除MST1/2基因的巨噬细胞经Mtb感染后趋化因子CXCL1/2分泌量不发生显著改变,由此表明CXCL1/2分泌可受Hippo信号通路MST1/2分子调节,进一步研究发现TLR2识别入侵Mtb抗原后,通过IRAK1/4激活MST1/2,MST1/2活化非经典Hippo通路下游转录分子IRF3,进而上调CXCL1/2和抗菌肽的表达。IRF3的活化程度与MST1/2的磷酸化正相关,抑制IRF3活性,CXCL1/2表达受抑制。因此Mtb感染宿主后,可通过TLR2-IRAK1/4-MST1/2-IRF3途径,诱导促炎趋化因子CXCL1/2分泌和抗菌肽表达,从而保护机体抵抗Mtb病原体损伤。
2.3Hippo信号通路与TGF-β/Smad信号通路 转化生长因子β(transforming growth factor beta,TGF-β)是一种多向性、多效性的炎症细胞因子。在造血细胞、骨折及伤口等部位,机体细胞分泌的非活性TGF-β首先与其Ⅰ型受体(type Ⅰ TGF-β receptor,TβR-Ⅰ)及Ⅱ型受体(type Ⅱ TGF-β receptor,TβR-Ⅱ)结合,形成异源三聚体,三聚体中TβR-Ⅱ磷酸化TβR-Ⅰ,磷酸化的TβR-Ⅰ进而激活受调节的Smads(receptor-regulated Smads,R-Smads)蛋白,将信号传递至胞浆。R-Smad作为TGF-β受体的底物被磷酸化后与共同通路型Smads(common-parnter Smads,Co-Smad)结合,成为有转录活性的模块,转移至细胞核,与靶基因结合,调节蛋白合成,参与创伤修复、免疫功能、细胞增殖、分化、凋亡及纤维化等生物过程的调节[40-42]。与Hippo信号通路一致,TGF-β/Smad转导通路的活性输出有赖于其效应蛋白的核转位。
早期Varelas等[43]研究YAP/TAZ与TGF-β蛋白核质穿梭的相互作用发现,TGFβ刺激人胚胎细胞后,TAZ与细胞内Smads复合物结合,并促进Smads核定位,进而诱导维持人胚胎细胞多能性的基因转录,且基因转录与TAZ表达水平相关,低水平的TAZ促进核累积,当TAZ浓度增加时,它主要定位于细胞质内,阻断Smads的核定位,提示Smad蛋白的核累积强烈依赖于TAZ的表达水平和活化状态。之后,多项研究结果均证实,TGF-β/Smad信号通路与Hippo信号通路存在交联[44]。活化Hippo通路后,滞留于细胞质内的YAP1/TAZ阻止了Smads的核积累,并限制其转录活性。反之,抑制Hippo通路,YAP/TAZ的核转位则增强核内Smads活性[45]。通过Hippo通路和TGFβ-SMAD信号传导之间的相互协同,共同参与青光眼的形成、癌症的发展和转移、调节组织细胞的稳态、人胚胎干细胞的自我更新及修复等疾病过程[46]。此外,多项研究表明TGF-β信号传导是心脏、肺、肝、肾和皮肤炎症纤维化的关键调节因子[47-49]。纤维化是由于炎症导致器官实质细胞发生坏死,组织内细胞外基质异常增多和过度沉积的病理过程。Nishio等[45]研究表明,特异性敲除小鼠肝脏中Mob基因,可导致小鼠细胞增生、伴有炎性细胞浸润、纤维化、TGF-β表达显著上调。而抑制肝脏Mob缺陷小鼠的TGF-β受体基因表达,可部分缓解肝脏炎性肿大、纤维化和肿瘤的发生。Fujii等[50]也证实了Hippo信号通路与TGF-β/Smad信号通路存在相互作用,两条通路的相关蛋白分子可形成 YAP-TEAD-Smad3-p300 复合物,该复合物可被募集到结缔组织生长因子(CTGF)启动子上的推定结合位点,进而提高CTGF基因的表达,促进炎症纤维化的发展。
2.4Hippo信号通路与G蛋白偶联受体 G蛋白偶联受体(G-protein-coupled receptors,GPCRs)含有7个跨膜结构域,该受体通过与G蛋白偶联介导信号的传递。GPCR是介导细胞外信号向胞内传递的细胞表面受体中的最大家族,其介导了包括视觉控制、肾脏功能、肿瘤发生、机体免疫调节、炎症反应等在内多种病理、生理过程的信号传递。有研究报道,GPCRs可作为上游调控因子,调节Hippo信号通路的表达[51]。Guan研究团队通过研究血清对YAP/TAZ磷酸化和激活的影响,以寻找Hippo途径的上游调节因子。结果显示,血清中的生物活性磷脂溶血磷脂酸(LPA)和鞘氨醇1-磷酸(S1P)可激活G12/13偶联受体,通过Rho-GTP酶抑制LATS1/2活性,从而诱导YAP去磷酸化和核转位。此外,激活GPCRs的胰高血糖素、肾上腺素或多巴胺可促进LATS1/2的活化,从而诱导YAP/TAZ磷酸化。Sonika等[52]研究发现,特异性敲除小鼠骨髓G蛋白偶联受体激酶2(G protein-coupled receptor kinase2,GRK2)基因,经病原微生物感染脓毒症后,表现出过度的细胞因子反应,其机制与GRK2对NF-κB1p105-TPL2-MEK-ERK途径的负调节有关。Nandakumar等[53]研究发现GRK5缺失可抑制组织和巨噬细胞中NF-κB的活化,从而减少细胞因子反应,且动物水平研究显示GRK5缺陷小鼠胸腺细胞凋亡和免疫抑制减轻。以上研究结果提示GPCR在机体病原菌感染后的炎症反应中发挥着重要的调节作用,然而GPCR的这些功能作用是否与Hippo通路相关目前尚无文献报道,有待于进一步深入研究。
3 结语与展望
尽管目前Hippo信号通路的研究取得了迅速而广泛的进展,但对Hippo信号通路与炎症疾病的相关性及其作用机制的研究报道并不多,相关研究也多集中于探究通路中的关键激酶MST1,MST2和下游转录激活分子YAP对免疫细胞和相关信号通路的调节作用,但Hippo信号通路中其他分子如SAV1、LAST1/2和TEAD的相关研究较少。Hippo信号通路对感染性炎症相关的Toll样受体信号通路的相互作用的研究较多,且较为深入,但对其他炎症相关信号通路的调节研究较少。因此,Hippo信号通路对其他炎症相关细胞的调控,以及Hippo信号通路相关分子与炎症相关信号通路的相互作用都有待于进一步深入研究。深入剖析Hippo信号通路对炎症疾病的调控,不但有助于深入阐明炎症疾病的发病机制,而且可为寻找新的潜在疾病治疗靶点提供新契机和思路。
